近紅外發光釕配合物在細胞pH傳感中的應用的製作方法
2023-06-12 21:39:46 1
本發明涉及細胞ph傳感領域,具體涉及一個雙核釕配合物在腫瘤細胞ph測定中的應用。
背景技術:
細胞ph與細胞的功能密切相關[r.a.gottlieb,j.nordberg,e.skowronski,b.m.babior,apoptosisinducedinjurkatcellsbyseveralagentsisprecededbyintracellularacidification,proc.natl.acad.sci.usa,1996,93,654.]。一般情況下細胞內存在兩個較寬的ph範圍,如細胞質和溶酶體的ph範圍分別為6.8~7.4和4.5~6.0[f.galindo,m.i.burguete,l.vigara,s.v.luis,n.kabir,j.gavrilovic,d.a.russell,syntheticmacrocyclicpeptidomimeticsastunablephprobesforthefluorescenceimagingofacidicorganellesinlivecells,angew.chem.int.ed.engl.,2005,44,6504.]。細胞功能紊亂、癌症和老年痴呆症等疾病會導致細胞內ph值偏離正常值[h.izumi,t.torigoe,h.ishiguchi,h.uramoto,y.yoshida,m.tanabe,t.ise,t.murakami,t.yoshida,m.nomoto,k.kohno,cellularphregulators:potentiallypromisingmoleculartargetsforcancerchemotherapy,cancertreat.rev.,2003,29,541.]。因此檢測細胞內ph變化對研究細胞的生理和病理過程具有重要意義。近年來發展起來的細胞ph傳感器具有快速、無損傷、直觀和靈敏度高等特點,已廣泛用於監控細胞內ph的變化。但這類傳感器主要局限於有機分子,且常常採用高能的紫外光激發,對細胞有損傷[j.y.han,k.burgess,fluorescentindicatorsforintracellularph,chem.rev.,2010,110,2709.]。與有機小分子相比較,基於釕配合物的近紅外發光ph傳感器具有較長的壽命,較大的斯託克位移,對生物組織穿透能力強、損傷小,並且釕配合物有一定的水溶性,這對檢測活體細胞體系的ph非常重要。但這類配合物在細胞ph傳感方面的應用報導極為少見。
技術實現要素:
本發明的目的是公開一個含咪唑環的雙核釕配合物的細胞ph傳感中的應用。
本發明的技術方案如下:
本實驗中所用的雙核釕配合物細胞ph傳感器為[(bpy)2ru(hl1)ru(h2l2)](clo4)4,配陽離子結構式如下所示:
[(bpy)2ru(hl1)ru(h2l2)](clo4)4按照我們公開的專利方法[王克志、孟婷婷、鄭澤寶,近紅外發光釕配合物ph傳感器,專利申請號:201510434319.x]合成。與現有的細胞ph傳感器相比,本發明的傳感器的有益效果在於:
能通過可見光激發,通過流式細胞術方便地監測細胞內ph對細胞近紅外發光強度的影響,傳感hela細胞內的ph。另外普通顯微鏡和雷射共聚焦顯微鏡成像的發光強度也能也能敏感響應細胞內的ph。結果還表明,本專利涉及的釕配合物在成像的濃度下,幾乎無細胞毒性。此外,本專利涉及的釕配合物具有可見光激發,近紅外區發光的特性,較紫外光激發的細胞探針具有對細胞損傷小的優點。
附圖說明
圖1不同濃度的釕配合物(10,20,40和80μm)以及5μm的順鉑(ddp)對hela細胞增殖的影響。
圖2(a)不同濃度的釕配合物(10,20,40和80μm)以及5μm的順鉑(ddp)對hela細胞周期g1相的影響(縱坐標為g1相所佔的百分比);圖2(b)不同濃度的釕配合物(10,20,40和80μm)以及5μm的順鉑(ddp)對hela細胞周期s相的影響(縱坐標為s相所佔的百分比);圖2(c)不同濃度的釕配合物(10,20,40和80μm)以及5μm的順鉑(ddp)對hela細胞周期g2/m相的影響(縱坐標為g2/m相所佔的百分比);圖2(d)不同濃度的釕配合物(10,20,40和80μm)以及5μm的順鉑(ddp)對hela細胞凋亡的影響(縱坐標為凋亡的hela細胞所佔的百分比)。
圖3(a)陰性對照(a)以及10μm(b),20μm(c),40μm(d),80μm(e)的釕配合物處理hela細胞2h後流式細胞術檢測的細胞發光強度圖;圖3(b)不同濃度的釕配合物處理hela細胞2h後流式細胞術檢測的細胞發光強度隨配合物濃度變化圖。
圖4(a)流式細胞術檢測的hela細胞發光強度:(a)陰性對照;40μm的釕配合物孵育hela細胞(b)2h,3.5h(c),5.5h(d),7.5h(e),9.5h(f);圖4(b)40μm的釕配合物孵育hela細胞時間對流式細胞術檢測到的hela細胞發光強度的影響。
圖5(a)流式細胞術檢測的細胞內不同ph時對hela細胞發光強度影響:(a)陰性對照;(b)ph7.4,(c)ph7.0,(d)ph6.0,(e)ph5.5,(f)ph5.0,(g)ph4.5,(h)ph4.0;圖5(b)hela細胞內ph對流式細胞術檢測的細胞發光強度的影響。
圖6釕配合物成像不同ph的hela細胞的雷射共聚焦顯微鏡成像圖。
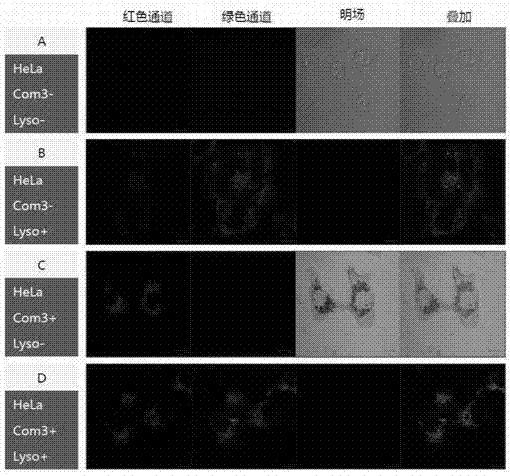
圖7釕配合物與溶酶體染料lysogreen在hela細胞中共定位雷射共聚焦顯微鏡成像圖。(a)hela;(b)hela+lysogreen;(c)hela+釕配合物;(d)hela+lysogreen+釕配合物。
具體實施方式
實施例1:細胞培養和細胞毒性實驗
宮頸癌hela細胞在370℃下用細胞培養液培養在co2培養箱中培養(95%相對溼度,5%co2).配合物的體外細胞毒在moleculardevices公司生產的高內涵分析系統上測定。取處於指數生長期狀態較好宮頸癌hela細胞,用培養基製成細胞懸液後,以細胞計數板計數,按照6×103個細胞/孔接種於96孔板,進行傳代培養。細胞傳代24小時後,加入配合物的二甲基亞碸溶液使其最後濃度10~80μm.100μl的培養基和順鉑分別做陰性和陽性對照。將96孔板放入37℃的相對溼度95%,5%二氧化碳培養箱孵育48小時。然後將10μg/mlhoechst33342and1μg/ml碘化丙啶pi的磷酸鹽緩衝液中染色20分鐘,用磷酸鹽緩衝液衝洗兩次後進行高內涵成像分析。對pi呈陽性的細胞標記為凋亡後的死細胞,對pi呈陰性的細胞按照hoechst33342的染色強度分為g1,sandg2/m相細胞.所有數據來自3次獨立的實驗,表達為平均值±標準偏差。
由圖1可知,10μm,20μm,40μm的釕配合物對hela細胞的增殖幾乎無影響,而80μm的釕配合物對細胞的增殖有小的影響,與順鉑(ddp)對細胞增殖有顯著影響形成鮮明的對照。由圖2(a)-2(d)可知,10μm,20μm,40μm的釕配合物幾乎不影響細胞周期和引起細胞凋亡,40μm的釕配合物才引起細胞周期g1和s相成分減小,g2/m相和細胞凋亡成分增加,與順鉑(ddp)對細胞周期和引起細胞凋亡有顯著影響形成鮮明的對照。上述結果表明,配合物濃度小於等於40μm時對細胞幾乎無毒性。
實施例2:流式細胞術分析
宮頸癌hela細胞通過胰蛋白酶消化後,懸浮於5ml磷酸鹽緩衝,在1000轉/分的速度下離心10分鐘。丟棄上清液後加1ml磷酸鹽緩衝重新懸浮細胞。通過novocyte型流式細胞儀(acea,usa)分析含有20000個細胞的樣品。激發波長488nm,經過780/20nm的濾光片收集發射的光子。
我們通過流式細胞術探討了配合物最佳濃度和最佳孵化時間。由圖3可知,當配合物濃度為80μm時,細胞的發光強度仍未飽和,由於受配合物溶解度的限制,我們實驗中選取接近細胞最大發光強度的40μm配合物濃度。由圖4可知,當孵化時間達8h後,細胞達最大發光強度,因此我們選取孵化時間8h,研究配合物在hela細胞傳感中的應用。由圖5可知,當細胞內的ph由4.0增加到7.0時,細胞的發光強度初始時隨ph增加顯著增加,ph4.0-5.5範圍內發光強度隨ph增加線性增加,當ph大於等於7時,發光強度達到飽和。上述細胞發光強度隨細胞ph變化曲線與配合物溶液發光強度隨溶液ph變化曲線[王克志、孟婷婷、鄭澤寶,近紅外發光釕配合物ph傳感器,專利申請號:201510434319.x]完全吻合,表明配合物是非常優異的細胞內ph探針。
實施例3:hela細胞ph成像
為完成雷射共聚焦成像,宮頸癌hela在20mm2雷射共聚焦顯微鏡培養皿中培養細胞(每孔1.0×104個細胞)。細胞在在37℃下5%co2氣氛下維持24小時直到達到70%匯集。10mm的配合物二甲基亞碸溶液用細胞培養液稀釋到最終濃度為40μm。細胞經孵育7.5小時後,過量的配合物用磷酸鹽緩衝(ph7.4)洗3次後,進一步處理10分鐘。然後,細胞再經磷酸鹽緩衝(ph7.4)洗3次,再用不同ph值(4.0,4.5,5.0,5.5,6.0,7.0和7.4)10μm的奈及利亞菌素孵育15分鐘.通過配有控溫在37℃的zeissaxioobservera1型普通顯微鏡發光成像(激發波長450–490nm,收集發射波長大於515nm的發射光子)。用zeisslsm700共聚焦顯微鏡進行成像分析。在配置截止波長為640nm的長波通發射濾光片,氬氪離子雷射的zeisslsm700共聚焦顯微鏡下用488nm激發配合物成像。
通過普通顯微鏡和雷射共聚焦顯微鏡成像結果(圖6)表明,隨ph增加,配合物紅色發光通道的發光強度隨ph增加而減弱,與流式細胞術的檢測結果一致。低ph時明顯可見配合物在細胞內染色均勻。
實施例4:釕配合物與溶酶體染料lysogreen在hela細胞中的共定位實驗
此實驗按如下六步完成:(1)將hela細胞接種到8孔培養皿中,37℃細胞培養箱培養24小時;(2)加入40μm釕配合物,繼續培養20小時;(3)hbss換液洗1次,每次5min;(4)分別加入染料:0.2μmlysogreen,37℃孵育30min;(5)hbss洗2次,每次5min。(6)用zeisslsm700共聚焦顯微鏡進行成像分析:紅色通道(釕配合物):405nm激發,發射640nm-∞;綠通道(lysogreen):488nm激發,發射500-555nm;明場:觀察細胞形態。物鏡:zeissplan-apochromat63x/1.40oil。
共聚焦顯微鏡進行成像結果(圖7)表明,且發現釕配合物的紅光與溶酶體染料lysogreen所發的綠光重疊,表明配合物能點亮hela細胞中的溶酶體。類似的實驗檢驗釕配合物與線粒體染料mitotracker共定位結果表明,釕配合物並不能點亮線粒體。
