檢測肺癌標誌物的試劑盒的製作方法
2023-06-01 19:24:36
本實用新型涉及生物檢測領域,具體的,本實用新型涉及檢測肺癌標誌物的試劑盒。
背景技術:
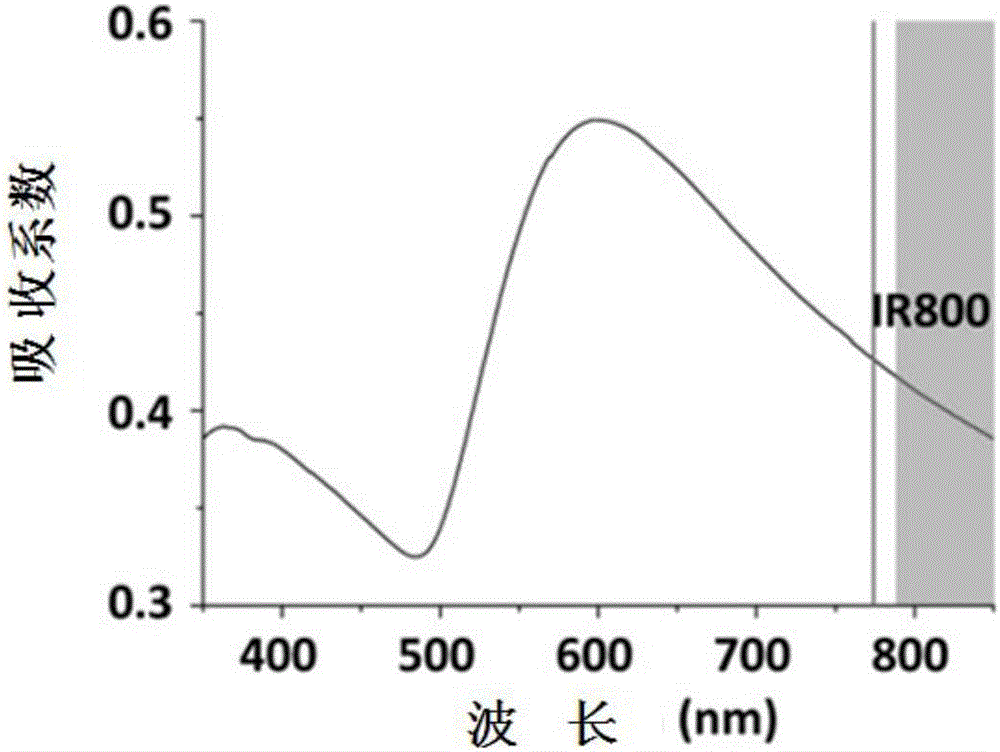
:作為全球最常見的癌症之一,肺癌威脅著人類的健康,其高死亡率佔所有惡性腫瘤死亡人數的19%。精確的診斷可以顯著提高患者的5年生存率和降低肺癌管理的醫療費用。因此,發展一種高靈敏和高特異性的肺癌檢測診斷技術,顯得至關重要。技術實現要素:本實用新型旨在至少在一定程度上解決相關技術中的技術問題之一。本實用新型是基於發明人的下列發現而完成的:本實用新型人在研究過程中發現,傳統肺癌檢測技術包括Luminex技術與酶聯免疫吸附檢測的聯合檢測,具重複性好和線性範圍廣的優點,還能滿足高通量臨床診斷的需求,只是檢測樣品的消耗量較高而不利於大規模的臨床診斷。而且,採用循環生物標記物檢測肺癌的技術,可以用血液為樣本,並通過簡單的即時診斷技術來實現非侵入式的檢測,但是,以這些標記物為基礎的檢測方法的靈敏度和特異性遠未達到理想的程度。本實用新型的發明人經過深入研究發現,等離子體金晶片(以下簡稱p-GOLDchip)之類的等離子體貴金屬層,具有特殊納米微觀結構,其表面分布著許多非連續的金島,並且金島間距離均勻,每個金島的大小都在納米級,這種結構產生的等離子體共振特性,能夠增強近紅外(波長在650~1700nm)的螢光效應和拉曼散射效應。因此,發明人在上表面具有等離子體貴金屬層的玻璃基體上,將3種肺癌標誌物的捕獲抗體分別固定到檢測陣列中;再將固定有捕獲抗體的近紅外螢光增強蛋白晶片依次與人體液樣品、螢光染料標記的檢測抗體接觸,然後通過螢光檢測來同時測定出人體液樣品中3種肺癌標記物的濃度值,如此能夠提高檢測的靈敏度和特異性。有鑑於此,本實用新型的一個目的在於提出一種高靈敏性、高特異性、高通量、多指標和低耗損的檢測肺癌標誌物的試劑盒。在本實用新型的第一方面,本實用新型提出了一種檢測肺癌標誌物的試劑盒。下面參考圖17所示的試劑盒的結構示意圖,進行詳細的說明。根據本實用新型的實施例,所述肺癌標誌物包括癌胚抗原、細胞角蛋白19的可溶性片段和神經元特異性烯醇化酶,且所述試劑盒包括近紅外螢光增強蛋白晶片100、檢測抗體和捕獲抗體;其中,所述近紅外螢光增強蛋白晶片100包括:玻璃基底110,和等離子體貴金屬層120,所述等離子體貴金屬層120設置在所述玻璃基底110上,且所述等離子體貴金屬層120上設有檢測陣列200;所述捕獲抗體固定在所述檢測陣列200上,且用於特異性捕獲所述肺癌標誌物;所述檢測抗體攜帶有可檢測的螢光標記,且用於與所述肺癌標誌物特異性結合。本實用新型的發明人經過長期研究發現,腫瘤標誌物是腫瘤細胞本身存在或分泌的特異性物質,目前發現的腫瘤標誌物中大部分存在於惡性腫瘤、良性腫瘤、胚胎組織甚至正常組織中。對於肺癌而言,癌胚抗原(CEA)是非小細胞肺癌的腫瘤標誌物,細胞角蛋白19的可溶性片段(Cyfra21-1)是非小細胞肺癌的腫瘤標誌物,以及神經元特異性烯醇化酶(NSE)是小細胞肺癌的腫瘤標誌物。現階段,單一腫瘤標誌物的檢測在肺癌中的靈敏度或特異性均欠佳。本實用新型的發明人經過研究又發現,捕獲抗體的一端被固定在近紅外螢光增強蛋白晶片100的等離子體貴金屬層120的檢測陣列上,另一端的位點可與特定的肺癌標誌物發生特異性結合,從而可從待測的人體液樣品中同時檢測三種肺癌標誌物。同時,近紅外螢光增強蛋白晶片100捕獲的肺癌標誌物還可與檢測抗體也發生特異性結合,從而使被螢光染料標記的檢測抗體也被捕獲在近紅外螢光增強蛋白晶片上,再在螢光下獲得檢測陣列200的螢光強度,通過查看與螢光強度對應的肺癌標誌物濃度值,即可高效地檢測出人體液樣品中各種肺癌標誌物的濃度。並且,近紅外螢光增強蛋白晶片100上的等離子體貴金屬層120能夠增強兩個數量級的近紅外螢光強度,從而提高檢測的靈敏性、並降低樣品消耗量。發明人意外地發現,採用本實用新型實施例的檢測肺癌標誌物的試劑盒,能夠同時進行多項組合檢測,滿足高通量臨床診斷的需求,且與單項標誌物檢測相比具有更高的靈敏性和特異性,以及更低的檢測極限(LOD)和定量檢測限(LOQ),而且只需一滴人體液(1~10微升)的低樣品消耗量,降低了檢測費用,可用於大規模的臨床診斷。另外,根據本實用新型上述實施例的檢測肺癌標誌物的試劑盒,還可以具有如下附加的技術特徵:根據本實用新型的實施例,所述等離子體貴金屬層為等離子體金層或等離子銀層,且所述等離子體貴金屬層具有非連續的納米島狀結構。本實用新型的發明人意外地發現,等離子體貴金屬層120具有特殊納米微觀結構,其表面分布著許多非連續的島,並且島間距離均勻,每個島的大小都在納米級,這種結構產生的等離子體共振特性,能夠增強近紅外光的螢光效應。由此,採用本實用新型實施例的等離子體貴金屬層,能夠進一步增強試劑盒檢測的螢光強度,從而可更高靈敏地、更高特異性地、並能夠定量地檢測出肺癌標誌物,而且只需要消耗更少的人體液樣品。根據本實用新型的實施例,所述納米島狀結構的相鄰島之間的距離為1~50nm,優選為10nm。本實用新型的發明人意外地發現,等離子體貴金屬層表面分布的非連續的島間距離均勻,大致在1~50nm之間。這種非連續的均勻的島間距離,增強了在近紅外(波長在650~1700nm)的等離子體共振,增強了在近紅外的螢光效應和拉曼散射效應。本實用新型的發明人經過長期研究還發現,非連續的島間距離主要在10nm區間。由此,採用本實用新型實施例的等離子體貴金屬層,能夠進一步增強試劑盒檢測的螢光強度,從而可更高靈敏地、更高特異性地、並能夠定量地檢測出肺癌標誌物,而且只需要消耗更少的人體液樣品。根據本實用新型的實施例,所述納米島狀結構的島面積為1000~100000nm2。本實用新型的發明人意外地發現,等離子體貴金屬層表面分布的非連續的島,每個島的大小都在納米級,這種結構產生的等離子體共振特性,能夠增強近紅外光的螢光效應。由此,採用本實用新型實施例的等離子體貴金屬層,能夠進一步增強試劑盒檢測的螢光強度,從而可更高靈敏地、更高特異性地、並能夠定量地檢測出肺癌標誌物,而且只需要消耗更少的人體液樣品。根據本實用新型的實施例,所述等離子體貴金屬層120的厚度為20~200nm。本實用新型的發明人意外地發現,由於納米空隙之間的局域電場增強、以及等離子體與近紅外螢光染料之間的共振效應,具有納米結構的近紅外螢光增強蛋白晶片可提供大約兩個數量級的近紅外螢光增強效果。同時,本實用新型的發明人經過長期研究發現,等離子體貴金屬層120的厚度為20~200nm的螢光增強效應最好,因為離子體貴金屬層的厚度小於20nm則無法起到螢光增強的效果,而厚度超過200nm後會失去特殊的納米結構才具有的等離子體共振特性而沒有螢光增強效應。由此,採用本實用新型實施例的等離子體貴金屬層,能夠進一步增強並成百倍地增強試劑盒檢測的螢光強度,從而可更高靈敏地、更高特異性地、並能夠定量地檢測出肺癌標誌物,並且檢測極限和定量檢測限都更低,而且只需一滴人體液的低樣品消耗量。根據本實用新型的實施例,所述檢測陣列200包含多個陣列排布的檢測點;任選地,所述檢測點為圓形,且所述檢測點的直徑為300~500微米。需要說明的是,「多個」可理解為兩個及兩個以上。本實用新型的發明人經過長期研究發現,採用陣列排布的方式,在提高單項檢測準確性的基礎上,還可實現聯合多項的檢測。具體的例如,根據本實用新型的實施例檢測點採用3×3的陣列排布,形成固定有三種不同種類的捕獲抗體的檢測陣列,其中每一行都是同一種類的捕獲抗體,每行分布有3個檢測點可提高針對同一種肺癌標誌物的單項檢測準確性,而且每列分布著三種不同種類的捕獲抗體,可實現同時對人體液中三種肺癌標誌物的聯合檢測,以此來提高檢測的靈敏性和特異性。本實用新型的發明人經過研究還發現,藉助列印技術可將特定的肺癌標誌物的捕獲抗體,固定到近紅外螢光增強蛋白晶片上特定的檢測點上,列印出的檢測點形狀具體為圓形的斑點狀。並且,根據本實用新型的實施例,每個檢測點可定量列印上捕獲抗體,且重複列印3次後,列印出的檢測點直徑為300~500微米。由此,採用本實用新型實施例的檢測陣列,藉助微液滴列印技術可在檢測陣列的特定檢測點上獲得等量的特定肺癌標誌物的捕獲抗體,並能夠直觀清晰地顯示出近紅外螢光增強蛋白晶片上對三種肺癌標誌物的獨立檢測結果,還可通過聯合多項檢測的實現,既可提高單項檢測的準確性,還可提高檢測的靈敏性和特異性。根據本實用新型的實施例,所述捕獲抗體包括第一捕獲抗體、第二捕獲抗體和第三捕獲抗體,所述第一捕獲抗體、所述第二捕獲抗體和所述第三捕獲抗體分別特異性捕獲所述癌胚抗原、所述細胞角蛋白19的可溶性片段和所述神經元特異性烯醇化酶。發明人意外地發現,蛋白晶片上固定的捕獲抗體,能夠與肺癌標誌物特異性地結合,從而從微量的人體液樣品中檢測到肺癌標誌物的存在。因此,針對三種典型的肺癌標誌物,本實用新型的發明人選擇了癌胚抗原的捕獲抗體、細胞角蛋白19的可溶性片段的捕獲抗體和神經元特異性烯醇化酶的捕獲抗體。需要說明的是,本實用新型對捕獲抗體的具體類型不做具體的限定,只需要捕獲抗體能夠捕獲特定的肺癌標誌物即可,本領域技術人員可根據實際需要進行選擇。由此,採用本實用新型實施例的特定捕獲抗體,就能夠同時高效地捕獲到人體液樣品中存在的三種特定的肺癌標誌物,再通過被標記的檢測抗體在螢光下的顯示作用,即可高靈敏性地、高特異性地檢測出肺癌標誌物。根據本實用新型的實施例,所述癌胚抗原的捕獲抗體、所述第一捕獲抗體、第二捕獲抗體和第三捕獲抗體分別固定在所述檢測陣列的不同檢測點上;優選的,所述第一捕獲抗體、第二捕獲抗體和第三捕獲抗體分別固定在所述檢測陣列的不同行或列上。發明人意外地發現,採用陣列排布的檢測點後,每行檢測點都可列印上同一肺癌標誌物的捕獲抗體,從而可提高各個單項檢測準確性,同時,三項聯合檢測可提高綜合檢測的靈敏性和特異性。具體的例如,根據本實用新型的實施例,3×3的陣列排布的檢測點中,第一行分布的是癌胚抗原的捕獲抗體,第二行分布的是細胞角蛋白19的可溶性片段的捕獲抗體,而第三行分布的是神經元特異性烯醇化酶的捕獲抗體,如此分行地分布能夠有效地區分三種肺癌標誌物的檢測結果,並且減少交叉檢測的幹擾。由此,採用本實用新型實施例的捕獲抗體的特定分布,可直觀清晰地顯示出近紅外螢光增強蛋白晶片上對三種肺癌標誌物的獨立檢測結果,並儘可能地減少交叉檢測帶來的互相干擾。根據本實用新型的實施例,所述螢光標記為螢光染料,且所述螢光染料為IRDye800;並且所述檢測抗體包括第一檢測抗體、第二檢測抗體和第三檢測抗體,所述第一檢測抗體、第二檢測抗體和第三檢測抗體分別對應與所述癌胚抗原、所述細胞角蛋白19的可溶性片段和所述神經元特異性烯醇化酶特異性結合。發明人經過長期研究發現,螢光染料IRDye800是蛋白質和抗體標記的理想選擇,IRDye800具有高水溶性,高耐鹽性以及低非特異性結合,可以保持準確的螢光強度。並且,被IRDye800標記後的檢測抗體,不僅可與人體液樣品中肺癌標誌物特異性地結合,還能夠在螢光檢測中通過螢光強度定量地顯示出的濃度。發明人還意外地發現,與捕獲抗體的功能類似,後加入的檢測抗體可與蛋白晶片上捕獲的肺癌標誌物發生進一步的特異性結合,同時,被IRDye800標記的檢測蛋白在螢光下會顯現,從而使試劑盒能夠檢測出微量的人體液樣品中肺癌標誌物的存在。因此,針對三種典型的肺癌標誌物,本實用新型的發明人選擇了癌胚抗原的檢測抗體、細胞角蛋白19的可溶性片段的檢測抗體和神經元特異性烯醇化酶的檢測獲抗體。同樣需要說明的是,本實用新型對檢測抗體的具體類型不做具體的限定,只需要捕獲抗體能夠捕獲特定的肺癌標誌物即可,本領域技術人員可根據實際需要進行選擇。由此,採用本實用新型實施例的捕獲抗體,通過被螢光染料標記,能夠在螢光檢測中同時顯示出被近紅外螢光增強蛋白晶片捕獲的三種肺癌標誌物,螢光檢測的結果更直觀,還可高靈敏性地、高特異性地、定量地檢測出人體液樣品中肺癌標誌物的濃度。本實用新型的附加方面和優點將在下面的描述中部分給出,部分將從下面的描述中變得明顯,或通過本實用新型的實踐了解到。附圖說明本實用新型的上述和/或附加的方面和優點從結合下面附圖對實施例的描述中將變得明顯和容易理解,其中:圖1是根據本實用新型的一個實施例的近紅外螢光增強蛋白晶片的掃描電鏡圖;圖2是根據本實用新型的另一個實施例的消光光譜圖;圖3是根據本實用新型的另一個實施例的不同濃度的CEA樣品的螢光掃描圖;圖4是根據本實用新型的另一個實施例的不同濃度的Cyfra21-1樣品的螢光掃描圖;圖5是根據本實用新型的另一個實施例的不同濃度的NSE樣品的螢光掃描圖;圖6是根據本實用新型的另一個實施例的3種標誌物在3種基底上的標準曲線對比圖;圖7是根據本實用新型的另一個實施例的3種基底的數據誤差分析圖;圖8是根據本實用新型的一個對比例的3種標誌物的標準曲線對比圖;圖9是根據本實用新型的另一個實施例的3種單項肺癌標誌物的螢光掃描圖;圖10是根據本實用新型的另一個實施例的3種單項肺癌標誌物的數據誤差分析圖;圖11是根據本實用新型的另一個實施例的3種雙項肺癌標誌物的螢光掃描圖;圖12是根據本實用新型的另一個實施例的3種雙項肺癌標誌物的數據誤差分析圖;圖13是根據本實用新型的另一個實施例的4個血液樣品的3種標誌物的檢測結果柱狀圖;圖14是根據本實用新型的另一個實施例的一系列血液樣品的檢測濃度與螢光強度的相關性分布圖;圖15是根據本實用新型的另一個實施例的一系列血液樣品的檢測誤差分析圖;圖16是根據本實用新型的另一個實施例的一系列血液樣品的3種標誌物的pGOLD晶片和Luminex檢測的對比圖;以及圖17是根據本實用新型的另一個實施例的檢測肺癌標誌物的試劑盒的結構示意圖。附圖標記100近紅外螢光增強蛋白晶片110玻璃基底120等離子體貴金屬層200檢測陣列具體實施方式下面詳細描述本實用新型的實施例,本
技術領域:
人員會理解,下面實施例旨在用於解釋本實用新型,而不應視為對本實用新型的限制。除非特別說明,在下面實施例中沒有明確描述具體技術或條件的,本領域技術人員可以按照本領域內的常用的技術或條件或按照產品說明書進行。所用試劑或儀器未註明生產廠商者,均為可市購到的常規產品。除非明確說明,在下列實施例中採用下述製備方法和測試條件:儀器型號和測試條件:磁控檢測儀,中國瀋陽科晶自動儀器有限公司,GSL-1100X-SPC-16M;掃描電子顯微鏡,日立S-4800,加速電壓為10.0kV;分光光度計,UV1901PC;印表機,GeSimNano-PlotterTM2.1;多功能流式細胞點陣儀,Luminex200;以及螢光掃描器,LI-COROdyssey,採用800納米通道,雷射波長為785nm,雷射強度為7.0,解析度為20微米,掃描獲得的圖像為16位灰度,並藉助軟體ImageStudioVersion3.1.4分析圖像。試劑:捕獲抗體(包括CEA、Cyfra21-1和NSE的捕獲抗體)、檢測抗體(包括CEA、Cyfra21-1和NSE的檢測抗體)、CEA校準品、CYFRA21-1校準品、NSE校準品、CEA定量檢測試劑盒、CYFRA21-1定量檢測試劑盒以及NSE定量檢測試劑盒,都是購自上海Tellgen生命科學公司,800CWNHS酯是購自LI-COR公司,PBS、FBS、PBST和吐溫20購自Sigma-Aldrich公司,環氧基改性玻璃晶片(規格為75毫米×25毫米)購自博奧公司。肺癌患者血液樣品:所有樣品均在上海胸科醫院收集;其中,將3毫升的血液吸引到一個EDTA管,並分成等份用於血液試驗;對於血清試驗,將3毫升的血液加入至血清管中,並在每分鐘3000轉的條件下離心15分鐘,收集離心管的上清液;並且,所有樣品使用前儲存在-20℃條件下。實施例1在該實施例中,製備出近紅外螢光增強蛋白晶片。具體的製備方法為,在環氧基改性玻璃晶片的表面,通過磁控檢測儀在40毫安電流的真空環境下表面進行4分鐘的金濺射處理,系統的沉積壓強為0.1mbar;再浸入濃度為3mmol/L的氯金酸溶液中,按照1:50的體積比加入濃度為0.15mol/L的氨水,振蕩1分鐘;去離子水洗滌,然後將其浸漬在濃度為1mmol/L的硼氫化鈉溶液,浸漬1分鐘;再用去離子水洗滌一次,並浸漬在濃度為0.5mmol/L的氯金酸和濃度為0.5mmol/L羥胺組成的混合溶液中,搖動5分鐘並孵育10分鐘,最終得到近紅外螢光增強蛋白晶片。該實施例的近紅外螢光增強蛋白晶片,在掃描電鏡下的表面形貌如圖1所示。由圖1可看出,製得的近紅外螢光增強蛋白晶片表面具有獨特的各自分隔的維納金島形貌,以及大量距離分布在10nm左右的空隙。由於納米空隙之間的局域電場增強、以及等離子體與近紅外螢光染料之間的共振效應,具有納米結構的近紅外螢光增強蛋白晶片可提供大約兩個數量級的近紅外螢光增強效果。實施例2在該實施例中,製備出IRDye800標記的檢測抗體。具體的製備方法為,檢測抗體預先與1-乙基-3-(3-二甲基氨基丙基)碳二亞胺/N-羥基進行共價偶聯反應,並用柱分離IRDye-800,且800CWNHS酯用DMSO稀釋並避光保存在-20℃;檢測抗體和IRDye800以1:1的摩爾比混合,室溫下搖動,黑暗中反應1.5小時;用再NAP-5柱除去未結合的染料,並以PBS緩衝液為流動相,收集IRDye800標記的檢測抗體,並避光儲存在-20℃。該實施例的IRDye800標記的檢測抗體,可直接塗覆在實施例1的近紅外螢光增強蛋白晶片表面,再通過分光光度計可獲得消光光譜圖,如圖2所示。從圖2可看出,等離子體在近紅外區具有共振效應,且近紅外螢光增強蛋白晶片的消光光譜與IR800染料的激發(785nm)和發射區域(790-810nm)重疊。實施例3在該實施例中,製備並使用檢測肺癌標誌物的試劑盒,檢測樣品。具體的製備方法為,採用印表機固定捕獲抗體至近紅外螢光增強蛋白晶片上,其中,捕捉抗體用PBS緩衝液稀釋至濃度為3微摩爾/升,再加入到384孔板中;通過運行設計的列印方案,捕獲抗體以每個點3nL的列印量、且每個點重複列印3次,獲得直徑為400微米的圓形斑點,並逐行列印後,最終得到列印固定有捕獲單體的近紅外螢光增強蛋白晶片。具體使用近紅外螢光增強蛋白晶片之前,在4℃下放置過夜,再密封在含有10v/v%FBS的PBS緩衝液中搖動1小時,以減少非特異性結合;然後,每個檢測點用150微升的含有0.05v/v%吐溫20的PBST緩衝液清洗後,將含有10微升樣品和90微升FBS的總共100微升混合溶液,依次加入至每個檢測點,搖動2小時;隨後,用PBST洗滌晶片五次,加入IRDye800標記的檢測抗體,在黑暗中半小時搖動染色;再用PBST洗滌五次,每個檢測點分別加入100微升的PBST和PBS,在黑暗中靜置15分鐘後搖動5分鐘;最後,用純水清洗並乾燥,得到用於螢光掃描的檢測晶片。實施例4在該實施例中,按照與實施例3基本相同的方法,分別製備出CEA校準品、CYFRA21-1校準品和NSE校準品的一系列不同樣品濃度的檢測晶片,再進行螢光掃描檢測。該實施的螢光掃描圖如圖3~5所示,具體的,為對比出近紅外螢光增強蛋白晶片(pGOLDchip)的增強效果,還增了加玻璃晶片(Glassslide)和均一金膜晶片(Coldslide)的檢測效果。其中,圖3為CEA校準品、圖4為CYFRA21-1校準品和圖5為NSE校準品的一系列不同濃度的螢光檢測結果。從圖3、圖4和圖5可以看出,等離子體具有明顯的近紅外螢光增強效應,並且CYFRA21-1和NSE在近紅外螢光增強蛋白晶片上,相對於玻璃和均一的金膜分別有50倍和100倍螢光增強的效果。再分別以近紅外螢光增強蛋白晶片、玻璃晶片以及均一金膜晶片檢測CEA標準品、Cyfra21-1標準品和NSE標準品的數據,能夠得到CEA標準曲線圖、Cyfra21-1標準曲線圖和NSE標準曲線圖,具體的如圖6所示。然後,比較檢測限和動態範圍,包含已知濃度的生物標記物樣本來源於Tellgen公司,在近紅外螢光增強蛋白晶片上做了三個獨立的實驗計算標準偏差和誤差棒,具體的如圖7所示,且數據顯示了平均±s.d.(n=3)。結合圖6和圖7可看出,通過商品化的含有已知濃度CEA標準品、Cyfra21-1標準品和NSE標準品獲得的標準曲線中,相比玻璃和均一金膜,pGOLD晶片的檢測結果顯示出更高的信噪比和動態測量範圍。與pGOLD晶片的結果相反,無特殊納米結構的均一金膜上顯示出微小的螢光淬滅而非近紅外螢光增強,從而導致了靈敏度的降低和信號動態範圍的減少。因此,通過近紅外螢光增強檢測可以證明,pGOLD是一個在生物標記物檢測方面優於傳統基質的平臺。對比例1在該對比例中,使用Luminex檢測方法檢測一系列不同濃度的肺癌標誌物標準品。具體的使用方法為,預先將Luminex試劑盒中的材料在室溫下放置30分鐘,並良好混合各個試劑;校準材料在純水中溶解,靜置2分鐘;分別將25微升反應緩衝液、10微升校準材料和25微升藻紅蛋白(PE)標記的混合抗體加入到每個檢測點的96孔板中,密封,充分混合;然後,移至培養箱中在37℃下避光5分鐘;每個檢測點添加25微升的微球懸浮液,密封和搖動後,再次放置在37℃培養箱中黑暗下反應60分鐘;最後,每個檢測點添加100微升終止緩衝,充分混合,得到檢測板,並用Luminex200多功能流式細胞點陣儀檢測,得到一系列不同肺癌標誌物標準品濃度的檢測結果。再分別以近紅外螢光增強蛋白晶片、玻璃晶片以及均一金膜晶片檢測CEA標準品、Cyfra21-1標準品和NSE標準品的數據,能夠得到CEA標準曲線圖、Cyfra21-1標準曲線圖和NSE標準曲線圖,具體的如圖8所示。對比圖6和圖8,通過比較pGOLD晶片和Tellgen商業化Luminex試劑盒這兩種方法測得的標準曲線,觀察到在檢測肺癌蛋白標記物中,pGOLD晶片可以獲得更高的靈敏度和檢測重現性。根據標準曲線計算結果證明,pGOLD晶片方法在檢測CEA,Cyfra21-1以及NSE中,其LOD和LOQ較Luminex方法提高了6~20倍,具體數據請見表1。表1.pGOLD晶片和Luminex平臺的LOD和LOQCEA[ng/mL]Cyfra21-1[ng/mL]NSE[ng/mL]Luminex-LODa1.0710.2540.831pGOLDchip-LODa0.1850.0490.146Luminex-LOQb4.3021.3464.003pGOLDchip-LOQb0.2780.0780.667a)LODs通過將平均空白值加上標準誤差的3倍計算;b)LOQs通過平均空白值加標準誤差的10倍獲得。而且,在生物標記物檢測的低濃度區域,pGOLD晶片上多次檢測的結果比Luminex平臺顯示出更好的重現性。其中,pGOLD的變異係數為6.42-24.13%,Luminex的變異係數為5.47~60.33%,具體數據見表2、表3和表4。這些結果具有重要的意義,且檢測過程使用了相同的抗體和標準品,證明等離子體螢光增強晶片平臺檢測效果優於Luminex平臺。表2.pGOLD晶片和Luminex平臺檢測不同濃度CEA的變異係數Concentration[ng/mL]pGOLDa(%)Luminexa(%)118.3315.262.3829.5811.773.0911.838.674.042.967.195.141.188.985.470.597.5134.260.127.9212.86Blank6.4248.26a)異係數由三個獨立試驗由標準偏差除以平均強度計算而得。表3.pGOLD晶片和Luminex平臺檢測不同濃度Cyfra21-1的變異係數表4.pGOLD晶片和Luminex平臺檢測不同濃度NSE的變異係數Concentration[ng/mL]pGOLDa(%)Luminexa(%)10035.634.752514.374.97108.9810.702.511.1517.3619.4136.080.524.136.740.122.3422.12Blank14.2060.33實施例5在該實施例中,通過pGOLD晶片同時檢測多種生物標記物,用於驗證檢測方法的特異性,以及檢測過程中無交叉汙染。具體的製備方法與實施例3基本相同,區別在於,CEA、Cyfra21-1和NSE的捕獲抗體以3×3點陣形式被列印固定到pGOLD晶片上,每行固定一種抗體,且每種抗體分別固定於同一行上的三個點;待晶片上的點陣與三種蛋白標記物的混合物孵育後,加入螢光標記的捕獲抗體(一種或多種的混合物)用於結合被捕獲在晶片上的CEA,Cyfra21-1和NSE,最後通過檢測螢光強度來檢測標記物。當加入的螢光標記的捕獲抗體是一種時,能夠得到單項肺癌標誌物的檢查結果,如圖9所示,以及三種標誌物單項檢測結果的誤差分析,具體見圖10。而當使用兩種檢測抗體混合物時,晶片上只會呈現兩行對應的螢光顯色光斑,而對于于缺失檢測抗體的那一行不顯色螢光,具體檢測結果如圖11和圖12所示。從圖9~12可以看出,pGOLD微陣列檢測晶片在同時檢測多種生物標記物時具有良好的特異性,無交叉汙染。實施例6在該實施例中,按照與實施例3基本相同的使用方法和檢測條件,對4個肺癌病人分別進行全血和血清進行對照檢測。區別在於,在該實施例中,螢光標記的捕獲抗體中含有10nmol的CEA檢測抗體、10nmol的CYFRA21-1檢測抗體和1nmol的NSE檢測抗體。該實施例的肺癌病人的血液樣品檢測結果,如圖13所示。由圖13可看出,CEA和Cyfra21-1的檢測信號相當,但是血液樣本中對應NSE的信號強度明顯高於血清樣本所測得的信號,說明NSE來源於血紅細胞的釋放。實施例7在該實施例中,按照與實施例6基本相同的使用方法和檢測條件,對48個肺癌病人和24個健康的人進行全血和血清進行對照檢測。該實施例的血液樣品檢測結果的統計數值,如表6、圖14~16所示。該實施例的檢查結果顯示,等離子金晶片檢測通過調整臨界值至更低的濃度,甚至可以觀察到更高的CEA和NSE檢測靈敏度,分別為18.8%和25.0%,同時具有100%的特異性。肺癌診斷中,等離子體金晶片展現出更優的檢測靈敏度,其主要原因是等離子體方法提供更優的LOD和LOQ,同時在低濃度檢測區域具有更小的檢測變異係數(CV)。由於單個標記物的檢測方法通常靈敏度有限,為了提高檢測靈敏度,同時檢測三個標記物。使用金等離子體螢光增強平臺,發現用三種標記物檢測肺癌時,可以獲得52%的靈敏度和95.8%的特異性(如果其中一個標記物的濃度高於臨界值,認為此樣品為陽性)。對比例2在該實施例中,採用Luminex試劑盒,即按照與對比例1基本相同的使用方法和檢測條件,對實施例7中同樣的48個肺癌病人和24個健康的人進行全血和血清進行對照檢測。並且,根據商品化Luminex試劑盒上推薦的截斷值水平:CEA為5ng/mL,Cyfra21-1為5ng/mL以及NSE為25ng/mL,具體可參考表5。表5.截斷值總結該對比例的血液樣品檢測結果的統計數值,如表6所示。將實施例7的數據與該對比例的數據進行對比可發現,實施例7的pGOLD晶片的單項CEA(12.5%)和Cyfra21-1(35.4%)的檢測靈敏度更高,並且基於等離子體近紅外螢光增強和Luminex的方法均可以提供91%到100%不等的超高特異性。並且,根據Luminex試劑盒和pGOLD晶片降低的截止值獲得的診斷結果,如表7所示。表6.pGOLD晶片和Luminex平臺的靈敏度和特異性LuminexapGOLDloweredcutoffsbLuminex-ROCcpGOLD-ROCcSensitivity-CEA10.42%18.75%8.33%39.58%Specificity-CEA91.67%100%100%91.67%Sensitivity-Cyfra21-14.17%35.42%14.58%62.5%Specificity-Cyfra21-1100%95.83%95.83%83.33%Sensitivity-NSE18.75%25%20.83%93.75%Specificity-NSE100%100%100%62.5%Sensitivity-Combination29.17%52.08%33.33%93.75%Specificity-Combination91.67%95.83%95.83%50%a)敏感性和特異性分別按照商業Luminex公司試劑盒的推薦截止值獲得;b)敏感性和特異性按照調整的截止值(10倍血清稀釋)獲得,在pGOLD晶片上測試82例CEA,271例Cyfra21-1和170例NSE,所對應的血清中生物標記物濃度也應用於Luminex平臺的敏感性和特異性計算;c)敏感性和特異性根據由ROC曲線優化的截斷值獲得。表7:根據試劑盒截止值和pGOLD晶片降低的截止值.獲得的診斷結果除此以外,pGOLD晶片和Luminex平臺檢測CEA、Cyfra21-1以及NSE的受試者工作特徵曲線如圖14、圖15和圖16所示。PGold晶片所測的三個標記物的曲線顯示出更大的曲線積分面積(CEA:pGOLD晶片和Luminex結果分別為0.640和0.205;Cyfra21-1:pGOLD晶片和Luminex結果分別為0.750和0.450;NSE:pGOLD晶片和Luminex結果分別為0.830和0.297)。這些結果證明pGOLD晶片檢測可獲得比Luminex平臺更優的檢測結果。由於肺癌病人在腫瘤學上可分為非小細胞肺癌(NSCLC,28例)和小細胞肺癌(SCLC,20例),發現,通過pGold晶片方法檢測,對於NSCLC來說,多指標檢測的靈敏度可達到46%,特異性可達到95%,然而對於SCLC來說,多指標檢測可獲得大約60%的靈敏度和98%的特異性。雖然CEA,Cyfra21-1和NSE在診斷肺癌的價值方面早就被承認,但是通過ELISA和化學發光技術獲得的檢測靈敏度僅僅為~4-24%之間(特異性大於95%)。使用這些技術檢測肺癌時,靈敏度的提高將不可避免地降低特異性。在本研究中,基於單指標檢測,可以獲得更高的靈敏度(CEA:19%,Cyfra21-1:35%,NSE:25%),同時具有很高的特異性(CEA:100%,Cyfra21-1:95.83%,NSE:100%)。使用單個標記物聯合檢測時,可以獲得更高的52%的靈敏度和非常高的96%的特異性,這些結果很顯然優於Luminex檢測方法和之前報導的基於類似標記物檢測手段。pGOLD優越的檢測效果歸結於其生物標記物優越的定量檢測限和檢測限,使得在檢測臨界值處獲得準確的定量檢測效果。總結總體上說,本實用新型將pGOLD晶片作為一種非侵入式的診斷工具應用於靈敏、特異的肺癌檢測。根據實施例1~7和對比例1~2中,通過近紅外螢光增強檢測,pGOLD晶片與其它的晶片和Luminex檢測平臺相比,其提供了優異的檢測限(0.049-0.185ngmL-1)、定量檢測限(0.078-0.667ngmL-1)和重現性。將微陣列高通量檢測技術、多指標近紅外光增強檢測技術應用於肺癌的診斷方法具有高的靈敏度和特異性,同時極大地減少樣品耗費量和檢測成本,具有即時診斷應用的潛力。Tips:在本實用新型的描述中,需要理解的是,術語「中心」、「縱向」、「橫向」、「長度」、「寬度」、「厚度」、「上」、「下」、「前」、「後」、「左」、「右」、「豎直」、「水平」、「頂」、「底」、「內」、「外」、「順時針」、「逆時針」、「軸向」、「徑向」、「周向」等指示的方位或位置關係為基於附圖所示的方位或位置關係,僅是為了便於描述本實用新型和簡化描述,而不是指示或暗示所指的裝置或元件必須具有特定的方位、以特定的方位構造和操作,因此不能理解為對本實用新型的限制。在本說明書的描述中,參考術語「一個實施例」、「一些實施例」、「示例」、「具體示例」、或「一些示例」等的描述意指結合該實施例或示例描述的具體特徵、結構、材料或者特點包含於本實用新型的至少一個實施例或示例中。在本說明書中,對上述術語的示意性表述不必須針對的是相同的實施例或示例。而且,描述的具體特徵、結構、材料或者特點可以在任一個或多個實施例或示例中以合適的方式結合。此外,在不相互矛盾的情況下,本領域的技術人員可以將本說明書中描述的不同實施例或示例以及不同實施例或示例的特徵進行結合和組合。儘管上面已經示出和描述了本實用新型的實施例,可以理解的是,上述實施例是示例性的,不能理解為對本實用新型的限制,本領域的普通技術人員在本實用新型的範圍內可以對上述實施例進行變化、修改、替換和變型。當前第1頁1 2 3 
