用於治療腦癌的化合物的製作方法
2023-06-23 20:12:42 2
本發明涉及對腦癌的新治療方法,所述腦癌在過去對於治療特別有抗性,即星形膠質細胞腦腫瘤,腦癌(轉移性癌症)和原發性CNS淋巴瘤。
發明背景
癌症是最具有生命威脅的疾病之一。癌症是其中身體一部分中的細胞經歷失控生長的病症。根據來自美國癌症協會的最新數據,估計在2014年美國有167萬新增癌症病例。癌症是美國第二大死因(僅次於心臟病)並且估計在2014年奪去超過585,000條生命。實際上,預計生活在美國的所有男性中的50%和所有女性中的33%在他們的有生之年都將發展某種類型的癌症。因此,癌症構成重大的公共健康負擔並且在美國導致了顯著成本。這些數字在其他地方在全球大多數國家中反映,儘管癌症的類型和發展癌症的群體的相對比例取決於許多不同因素(如包括遺傳和飲食)而變化。
世界衛生組織(WHO)將原發性腦腫瘤分成四類。WHO I和II級是低級膠質瘤,而間變性星形細胞瘤和間變性少突神經膠質瘤(WHOIII級)以及膠質母細胞瘤(GBMs)(WHO IV級)總稱為惡性膠質瘤。大多數原發性和繼發性腦腫瘤的預後是極壞的,因為缺乏有效的治療劑。它們是兒童中由於實體瘤導致的死亡的首因並且是年齡在15-34歲的青少年和成人中癌症導致的死亡的第三大原因(Jemal等,CA Cancer J Clin 59 2009 225-249)。
在惡性膠質瘤中,GBM是最常見的和致命的腫瘤,代表所有膠質瘤的約50%。GBM的預後令人沮喪,突出了對新治療策略的需要。外科手術接著是烷基化劑替莫唑胺(TMZ)和放療的組合療法是對於患有GBM的患者的標準治療。TMZ的主要作用機制是通過DNA鹼基的異常甲基化引發的,特別是DNA中的O6-甲基鳥嘌呤(Verbeek等,Br Med Bul,85,2008,17-33)。然而,許多患者對TMZ具有抗性或者僅顯示弱反應。這已經顯示是由O6-甲基鳥嘌呤-DNA甲基轉移酶(MGMT)介導的錯配修復(MMR)賦予的(參見Weller等,Nat Rev Neurol,6,2010,39-51)。具有該修復系統的患者具有『MGMT陽性GBM』。mTOR/DNAPKC途徑的激活也被認為發揮作用。迄今還未開發出針對MGMT陽性GBM具有活性的化療劑。MGMT的活性在其他星形膠質細胞的腦腫瘤(即瀰漫性星形細胞瘤(WHO II級)和間變性星形細胞瘤(WHOIII級))中也是重要的。這些至GBM的進展主要通過MGMT的甲基化來介導。因此可以看出,針對MGMT陽性星形細胞瘤具有活性的治療劑在防止這些瀰漫性和間變性星形細胞瘤進展為GBM方面將是理想的。
因此,關鍵的是急切開發一種具有優異抗腫瘤活性的新治療劑,其不僅針對MGMT陰性GBM還針對MGMT陽性GBM(以及其他星形膠質細胞的腦腫瘤),顯示優異的CNS穿透並且具有可耐受的毒性性質。
轉移性腦腫瘤作為癌症起始於身體別處並擴散至腦。乳腺癌、肺癌、黑素瘤、結腸癌和腎癌通常轉移。經常地,在原發性腫瘤之前發現轉移性腦腫瘤。轉移性腦腫瘤是成人中所有腦腫瘤中最常見的。估計每年可能存在高達170,000例新病例。儘管比GBM稍微好點,但是轉移性腦癌的預後通常是差的。再次,採用外科手術、治療和化療的組合,這些選項之中的確切組合取決於轉移癌的本性和發展階段(以及患者的健康)。外科手術(當可能時)和放療是應用的標準治療。有時候使用化療。不幸的是,迄今還未有很大成功。這部分是由於需要化療劑顯示優異的CNS穿透(當然,還有優異的抗腫瘤活性和可耐受的毒性性質)。許多現有的化療劑顯示對血腦屏障的差的穿透。急切需要解決這些問題的新治療劑。
原發性中樞神經系統(CNS)淋巴瘤源自淋巴細胞,但是應當認為是腦腫瘤,因為其位置僅在腦中並且治療挑戰類似於其他腦腫瘤的那些。具體地,藥物遞送被血腦屏障阻礙並且腦毒性限制當前治療的使用。大多數原發性CNS淋巴瘤是瀰漫性大B-細胞淋巴瘤(約90%)。儘管其相對稀少,但是其發病率和流行程度正在增加。當前,使用現有治療方案的中值存活率為44個月。對於該病症還未建立特別有效的治療方案。當前優選的化療劑是甲氨蝶呤。然而,其對血腦屏障的穿透並不令人滿意,並且不得不以極高的劑量施用。使用放療的組合療法可以改善結果,但是副作用可能是非常嚴重的。因此,需要一種改進的化療劑,其具有更大的穿透血腦屏障的能力並且還顯示針對原發性CNS淋巴瘤的優異的抗腫瘤活性。
在WO-A-2010/085377中,公開了以下式I的化合物。它是首創一類(first-in-class)雙功能烷基化-HDACi融合分子,其有效地抑制HDAC途徑。
生物學測定顯示,式I的化合物有效地抑制1類和2類HDAC酶(例如HDAC1,IC50為9nM),並且已經顯示具有針對多發性骨髓瘤細胞系的優異的體外活性。此外,其通過顯著下調FANCD2,BRCA1,BRCA2,和TS(胸苷酸合成酶)抑制DNA修復,可能涉及HDAC6和HDAC8抑制。在NCI-60細胞系中的細胞毒性測定已經顯示其具有極強的抗癌活性,與苯達莫司汀(Bendamustine)的72μM相比,其IC50中值為2.2μM。WO-A-2013/113838包括了顯示式I的化合物(在說明書中稱為NL-101)針對許多細胞系的活性的數據,所述細胞系包括一些成膠質細胞瘤細胞系。然而,考慮的細胞系中的每一種都是MGMT陰性GBM腫瘤細胞系。
發明概述
在本發明的第一方面,提供用於治療腦癌的式I的化合物或其藥用鹽:
所述腦癌選自MGMT陽性星形膠質細胞腦腫瘤、轉移性腦癌和原發性CNS淋巴瘤。
在臨床前體外和體內研究中,已經顯示式I的化合物不僅針對MGMT陰性GBM腫瘤具有活性,而且對於MGMT陽性GBM腫瘤具有活性。由此,還可以預期其對於其他MGMT陽性星形膠質細胞腫瘤具有活性。已經發現,式I的化合物能夠非常好地穿透血腦屏障,使得其不僅針對MGMT陽性星形膠質細胞腫瘤而且針對其他腦腫瘤的治療應用理想。特別是,已經進一步發現其具有非常好的針對轉移性腦癌以及原發性CNS淋巴瘤的活性。
在本發明的第二方面,提供了式I的化合物或其藥用鹽在製備藥物中的應用,所述藥物用於治療選自MGMT陽性星形膠質細胞腦腫瘤、轉移性腦癌和原發性CNS淋巴瘤的腦癌。
在本發明的第三方面,提供了一種在需要其的患者中治療腦癌的方法,所述腦癌選自MGMT陽性星形膠質細胞腦腫瘤、轉移性腦癌和原發性CNS淋巴瘤,所述方法包括將式I的化合物或其藥用鹽施用於所述患者。
附圖描述
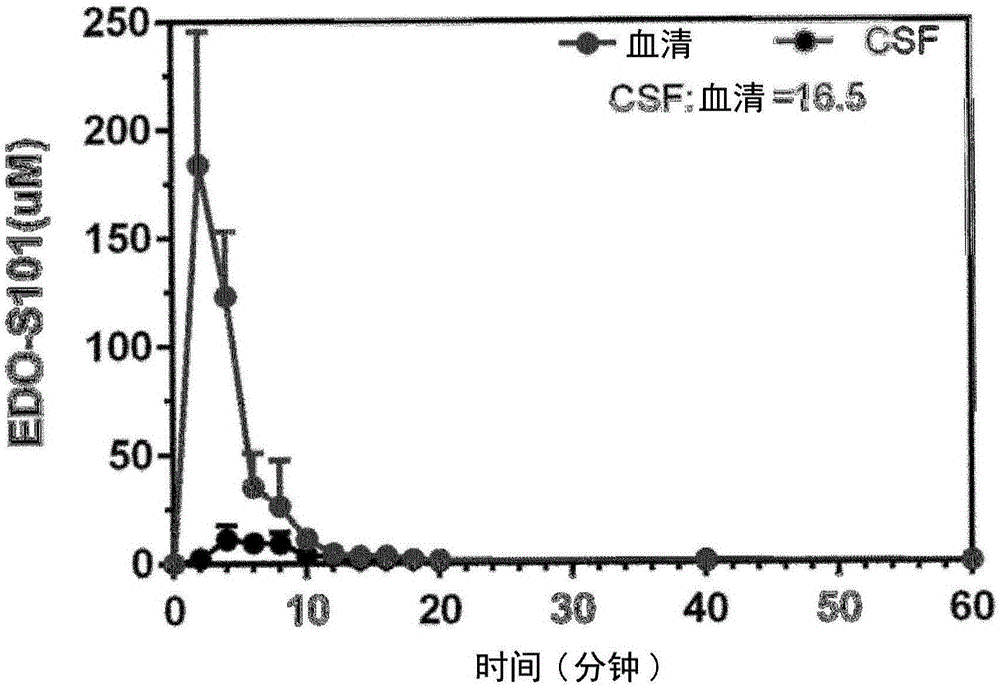
圖1是在腦脊液和血液中EDO-S101濃度(μM)對時間的圖表;
圖2是在施用替莫唑胺之後,12種測試的GBM細胞系的IC50的圖表;
圖3是在施用替莫唑胺和伏林司他(vorinostat)之後,12種測試的GBM細胞系的IC50的圖表;
圖4是在施用苯達莫司汀之後,12種測試的GBM細胞系的IC50的圖表;
圖5是在施用苯達莫司汀和伏林司他後,12種測試的GBM細胞系的IC50的圖表;
圖6是對於12種測試的細胞系的每一種,細胞存活百分比針對EDO-S101(μM)濃度的圖表;
圖7a是作為注射後GBM12細胞生長測量值的發光針對時間的圖表;
圖7b是存活百分比針對時間的圖表,顯示了EDO-S101針對苯達莫司汀和對照的存活的延長。
圖8是對於移植了用EDO-S101處理的U251腫瘤的小鼠,進展時間(TTP)概率(%)針對時間的圖表;
圖9是對於移植了用EDO-S101處理的U87腫瘤的小鼠,進展時間(TTP)概率(%)針對時間的圖表;
圖10是對於僅用放療處理、用放療和2.5μM EDO-S101(在圖中顯示為NL-101)和5μM EDO-S101EDO-S101處理的U251,U87和T98G細胞,存活分數針對放療劑量(Gy)的圖表;
圖11是對於移植了用對照、放療和EDO-S101處理的U251腫瘤的小鼠,進展時間(TTP)概率(%)針對時間的圖表;
圖12是對於移植了用對照、放療和替莫唑胺、EDO-S101以及放療和EDO-S101處理的U251腫瘤的小鼠,進展時間(TTP)概率(%)針對時間的圖表;
圖13是對於移植了用對照、放療和EDO-S101處理的U87腫瘤的小鼠,進展時間(TTP)概率(%)針對時間的圖表;
圖14是對於移植了用對照、放療和替莫唑胺、EDO-S101、以及放療和EDO-S101處理的U87腫瘤的小鼠,進展時間(TTP)概率(%)針對時間的圖表;
圖15和16是在用對照載體、EDO-S101、替莫唑胺、以及放療和替莫唑胺處理後,原位螢光素酶-轉染的U251GBM小鼠的生物發光圖像;
圖17是在用對照載體、放療、EDO-S101、替莫唑胺、以及放療和替莫唑胺處理後,對於原位螢光素酶-轉染的U251GBM小鼠存活概率(%)針對時間的圖表;
圖18是對於移植了用對照、苯達莫司汀和EDO-S101處理的OCI-LY10CNS淋巴瘤的小鼠,存活百分比針對時間的圖表;和
圖19是對於在用MB-468乳腺癌細胞轉染後具有腦的三陰性轉移性乳腺癌的小鼠,存活百分比針對時間的圖表,所述MB-468乳腺癌細胞用對照、苯達莫司汀和EDO-S101處理。
發明詳述
在本發明中,使用許多通用術語和措詞,其應該如下解釋。
星形膠質細胞腦腫瘤是源自於腦內星形的膠質細胞(星形膠質細胞)的腫瘤。它們分為低級(I和II)和高級(III和IV)。已知II級星形膠質細胞腫瘤為瀰漫性星形細胞瘤。儘管這些生長較慢,但是它們可以發展成為惡性原發性腫瘤。已知III級星形膠質細胞腫瘤為間變性星形細胞瘤。這些是惡性腫瘤;它們生長更快並且傾向於侵入附近健康組織。已知IV級星形膠質細胞腫瘤是多形性成膠質細胞瘤(GBM)。這些是高度惡性的,生長快速,容易擴散到附近組織,並且非常難以用常規治療來治療。
目前的標準化療治療是使用替莫唑胺(TMZ)。然而,許多患者對於反應具有抗性或者僅顯示弱反應。已經顯示這是通過O6-甲基鳥嘌呤-DNA甲基轉移酶(MGMT)介導的錯配修復(MMR)賦予的(參見Weller等,Nat Rev Neurol,6,2010,39-51)。具有該修復系統的患者具有『MGMT陽性GBMs』。GBMs因此分成MGMT陰性GBMs和MGMT陽性GBMs,這取決於它們是否表達MGMT基因。已經顯示本發明式I的化合物或其藥用鹽不僅具有針對MGMT陰性的GBMs的活性,而且具有針對MGMT陽性GBMs的活性。
MGMT活性在其他星形膠質細胞腦腫瘤中也是重要的,所述其他星形膠質細胞腦腫瘤即瀰漫性星形細胞瘤(WHO II級)和間變性星形細胞瘤(WHO III級)。這些至GBMs的進展主要是通過MGMT導致的甲基化介導的。因此可以看到,因為式I的化合物及其藥用鹽具有針對MGMT陽性星形細胞瘤的活性,因此它也能夠預防這些瀰漫性和間變性星形細胞瘤至GBMs的進展。
轉移性腦腫瘤是作為身體內其他地方的癌症起始並且擴散到腦的腦腫瘤。乳腺癌、肺癌、黑素瘤、系統性淋巴瘤、肉瘤、結腸癌、胃腸癌和腎癌通常轉移。
在本發明上下文中的原發性CNS淋巴瘤是源自腦內的淋巴細胞、由所述淋巴細胞形成的惡性細胞的淋巴瘤。因此,認為其為腦腫瘤,因為其位置和治療挑戰類似於其他腦腫瘤的那些。
「藥用鹽」是指本發明化合物的鹽,其是藥學上可接受的,如上定義,並且具有所需的藥理學活性。這些鹽包括與無機酸或與有機酸形成的酸加成鹽。藥用鹽還包括鹼加成鹽,其當存在的酸性質子能夠與無機或有機鹼反應時可以形成。通常,這樣的鹽例如通過將游離酸或鹼形式的這些化合物與化學計算量的適當的鹼或酸在水中或在有機溶劑中或在這兩者的混合物中反應來製備。通常,優選非水性介質如乙醚、乙酸乙酯、乙醇、異丙醇或乙腈。酸加成鹽的實例包括無機酸加成鹽,如例如鹽酸鹽,氫溴酸鹽,氫碘酸鹽,硫酸鹽,硫酸氫鹽,氨基磺酸鹽,硝酸鹽,磷酸鹽,和有機酸加成鹽,如例如乙酸鹽,三氟乙酸鹽,馬來酸鹽,富馬酸鹽,檸檬酸鹽,草酸鹽,琥珀酸鹽,酒石酸鹽,水楊酸鹽,甲苯磺酸鹽,乳酸鹽,萘磺酸鹽,蘋果酸鹽,扁桃酸鹽,甲磺酸鹽和對甲苯磺酸鹽。鹼加成鹽的實例包括無機鹽,如例如,鈉、鉀、鈣和銨鹽,和有機鹼鹽,如例如乙二胺、乙醇胺、N,N-二亞烷基乙醇胺、三乙醇胺和鹼性胺基酸鹽。
在本發明中,式I的化合物的藥用鹽可以優選為鹽酸鹽,氫溴酸鹽,氫碘酸鹽,硫酸鹽,硫酸氫鹽,氨基磺酸鹽,硝酸鹽,磷酸鹽,檸檬酸鹽,甲磺酸鹽,三氟乙酸鹽,穀氨酸鹽,葡糖醛酸鹽,戊二酸鹽,蘋果酸鹽,馬來酸鹽,琥珀酸鹽,富馬酸鹽,酒石酸鹽,甲苯磺酸鹽,水楊酸鹽,乳酸鹽,萘磺酸鹽或乙酸鹽,並且更優選乙酸鹽。
在本發明中,當將式I的化合物或其藥用鹽用於治療MGMT陽性星形膠質細胞腦腫瘤時,這優選選自MGMT陽性多形性成膠質細胞瘤、瀰漫性(WHO II級)星形細胞瘤和間變性(WHOIII級)星形細胞瘤,並且最優選為MGMT陽性多形性成膠質細胞瘤。
在本發明中,當將式I的化合物或其藥用鹽用於治療轉移性腦癌時,這優選選自轉移性乳腺癌、轉移性系統性淋巴瘤、轉移性肺癌、轉移性黑素瘤、轉移性肉瘤和轉移性胃腸癌,並且最優選轉移性乳腺癌。
根據本發明第一、第二和第三方面施用於患者的式I的化合物或其藥用鹽和包含其的藥物的治療有效量是以下量,所述量以適用於任何藥物治療的合理的效益/風險比賦予對所治療的受試者根據本發明的治療效果。治療效果可以是客觀的(即,通過某種測試或標記可測量的)或主觀的(即,受試者給出效果指示或感覺)。認為根據本發明的式I的化合物或其藥用鹽的有效量是這樣的量,其中以0.1至70mg/kg患者體重(例如,0.5至50mg/kg體重,如1,5,10,20,30,40or 50mg/kg體重)的劑量範圍包括式I的化合物或其藥用鹽。
對於任何具體患者的特定治療有效劑量水平將取決於各種因素,所述因素包括被治療的病症和病症嚴重性;使用的具體化合物的活性;使用的具體組合物;患者的年齡,體重,整體健康,性別和飲食;給藥時間,給藥途徑和使用的具體化合物的排洩率;治療持續時間;與使用的具體化合物組合或同時使用的藥物;和醫藥領域公知的類似因素。
根據本發明第一、第二和第三方面的式I的化合物或其藥用鹽和包含它們的藥物的給藥形式的適當實例非限制性地包括口服、局部、腸胃外、舌下、直腸、陰道、經眼和鼻內。腸胃外給藥包括皮下注射,靜脈內、肌內、胸骨內注射或輸注技術。優選地,將式(I)的化合物或其藥用鹽和包含它們的藥物腸胃外施用,並且最優選靜脈內施用。
優選地,將式I的化合物或其藥用鹽以0.1mg/kg至70mg/kg患者體重的劑量水平靜脈內施用於需要其的患者,並且最優選以0.5mg/kg至50mg/kg患者體重的劑量水平靜脈內施用於需要其的患者。
已經發現,在本發明的第一、第二和第三方面中,可以優選將式I的化合物或其藥用鹽或包含它們的藥物在治療周期的第1天、第8天和第15天、在治療周期的第1天和第8天或僅在治療周期的第1天施用於需要其的患者。
在本發明第一、第二和第三方面的另一個優選實施方案中,出人意料地發現式I的化合物及其藥用鹽當與放療聯合施用時顯著更有效,並且實際上在體內和體外研究中似乎與放療都具有協同效應。因此,在本發明第一、第二和第三方面中,可以將式I的化合物或其藥用鹽或包含它們的藥物用於治療需要其的患者,其中在用所述式I的化合物或其藥用鹽或包含它們的藥物治療之前或之後,還為需要其的患者提供放療。優選地,在用所述式I的化合物或其藥用鹽或包含它們的藥物治療之前,為所述患者提供放療治療。可以以連續5天1至5Gy並且優選以連續5天2Gy的劑量提供放療。
在本發明第一、第二和第三方面的另一個優選實施方案中,所述治療進一步包括向需要其的患者施用血管內皮生長因子(VEGF)抑制劑,並且所述式I的化合物或其藥用鹽和所述血管內皮生長因子(VEGF)抑制劑可以同時、順序或分開施用,並且優選同時施用。優選地,所述血管內皮生長因子(VEGF)抑制劑是貝伐珠單抗。
在本發明第一、第二和第三個實施方案的另一個優選實施方案中,所述治療還包括向需要其的患者施用聚ADP核糖聚合酶(PARP)抑制劑,並且所述式I的化合物或其藥用鹽和所述聚ADP核糖聚合酶(PARP)抑制劑可以同時、順序或分開施用,並且優選同時施用。優選地,所述聚ADP核糖聚合酶(PARP)抑制劑選自rucaparib、奧拉帕利(olaparib)和veliparib。
在本發明第一、第二和第三個實施方案的另一個優選實施方案中,所述治療還包括向需要其的患者施用PD-1/PDL-1(免疫檢查點)抑制劑,並且所述式I的化合物或其藥用鹽和所述PD-1/PDL-1(免疫檢查點)抑制劑可以同時、順序或分開施用,並且優選同時施用。優選地,所述PD-1/PDL-1(免疫檢查點)抑制劑是伊匹木單抗。
當意欲用於口服給藥時,本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物可以是固體或液體形式,其中半固體、半液體、混懸液和凝膠形式被包括在本文中考慮為固體或液體的形式內。
本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物可以使用藥學領域公知的方法製備用於給藥。適當的藥物製劑和載體的實例描述在E.W.Martin的"Remington′s Pharmaceutical Sciences"中。
作為用於口服給藥的固體組合物,本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物可以配製成粉末、顆粒、壓縮片劑、藥丸、膠囊、口香糖、糯米紙囊劑(wafer)等形式。該固體組合物典型地含有一種或多種惰性稀釋劑,作為包含所有活性劑的單一片劑或作為各自包含本發明的組合的單一活性劑的多個分開的固體組合物(在試劑盒的情形中)。另外,可以存在以下中的一種或多種:粘合劑如羧甲基纖維素,乙基纖維素,微晶纖維素,或明膠;賦形劑,如澱粉,乳糖或糊精,崩解劑,如海藻酸,海藻酸鈉,玉米澱粉等;潤滑劑,如硬脂酸鎂;助流劑,如膠體二氧化矽;甜味劑,如蔗糖或糖精;調味劑如薄荷油,水楊酸甲酯或橙味調味劑;和著色劑。
當本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物是膠囊形式(例如,明膠膠囊)時,除了上述類型的材料以外,它還可以含有液體載體,如聚乙二醇,環糊精或脂肪油。
本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物可以是液體形式,例如酏劑、糖漿、溶液劑、乳劑或混懸劑。該液體可以用於口服給藥或者用於通過注射遞送。當意欲用於口服給藥時,本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物可以包含甜味劑、防腐劑、染料/著色劑和增香劑中的一種或多種。在用於通過注射給藥的本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物中,還可以包括表面活性劑、防腐劑、潤溼劑、分散劑、懸浮劑、緩衝劑、穩定劑和等張劑中的一種或多種。
優選的給藥途徑是腸胃外給藥,包括但不限於,皮內,肌內,腹膜內,靜脈內,皮下,鼻內,硬膜外,鼻內,腦內,心室內,鞘內,陰道內或透皮。優選的給藥方式留待執業醫生判斷,並且將部分取決於醫學病症的部位(如癌症部位)。在更優選的實施方案中,靜脈內施用本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物。
本發明第一、第二和第三方面的液體的式I的化合物或其藥用鹽或包含它們的藥物,無論它們是溶液、混懸液或其他類似形式,還可以包括以下中的一種或多種:無菌稀釋劑,如注射用水,鹽水溶液,優選生理鹽水,林格氏溶液,等張氯化鈉,固定油,如合成甘油單酯或二酯,聚乙二醇,甘油,或其他溶劑;抗細菌劑,如苯甲醇,或對羥基苯甲酸甲酯;和用於調節張力的試劑,如氯化鈉或右旋糖。腸胃外組合或組合物可以被包封在由玻璃、塑料或其他材料製成的安瓿管、一次性注射器或多劑量小瓶中。生理鹽水是優選的輔劑。
可以通過任何便利的途徑,例如通過輸注或推注,通過上皮或皮膚黏膜襯裡吸收,並且優選通過推注,施用本發明第一、第二和第三方面的式I的化合物或其藥用鹽或包含它們的藥物。
實施例
在以下實施例中,將具有下式I的化合物稱為EDO-S101。
如WO-A-2010/085377的實施例6所述,製備EDO-S101。將EDO-S101溶解在DMSO(100X母液)中並保存在4℃,之後在使用日懸浮在介質中。
實施例1在Sprague-Dawley大鼠中EDO-S101的CNS藥物代謝動力學分析
在以40mg/kg尾靜脈注射EDO-S101後在大鼠中確定CNS藥物代謝動力學。通過微透析探針以18時間間隔從血液和腦室中收集微透析液樣品。用UV檢測(CE-UV),通過毛細管電泳,確定這些樣品中的藥物濃度,接著計算各種藥物代謝動力學參數。
使用氣態異氟烷(在20%氧和80%氮氣的混合物中的1%異氟烷)將六隻大鼠麻醉,並且固定在立體定位的框架(KOPF Instruments,Tujunga,CA)中。在整個程序中保持麻醉。將每個引導套管(CMAMicrodialysis Inc.,Acton,MA)立體定位地植入側腦室(AP-0.9,L 1.6,V 3.4,相對於前囟和頭骨),然後通過螺釘和牙科粘合劑固定頭骨。在外科手術後,將每隻大鼠單獨收容,隨意提供食物和水3天,以從插管手術中恢復。在清醒的自由移動的大鼠上進行微透析實驗。在實驗當日,將引導套管中的管心針用微透析探針(CMA/11,具有4mm膜,CMA Microdialysis Inc.,Acton,MA)替換,並且將血管微透析探針(CMA/20,具有4mm膜,CMA Microdialysis Inc.,Acton,MA))植入頸靜脈。所述探針具有進口管,所述進口管與注射器連接以遞送人工腦脊髓液(146mM NaCl,1.2mM CaCl2,3mM KCl,1mM MgCl2,1.9mM Na2HPO4,0.1mM NaH2PO4,pH 7.4)到腦室中並且將Dulbecco’s磷酸鹽緩衝鹽水(D-PBS)遞送到血液中,流速為0.5μl/min。出口管與微級分收集器連接,以在4℃收集微透析液。在劑量給藥之前,允許大鼠恢復至少24小時。在(靜脈內)注射EDO-S101之後,在3小時內收集十八個樣品。將所有樣品加樣至毛細管電泳,用UV檢測(CE-UV)以確定腦脊髓液(CSF)和血液中的EDO-S101的濃度。在實驗後用CO2吸入將大鼠處死。在每個實驗結束時通過目檢證實探針的位置。
通過CE-UV(Agilent 3D CE)測量微透析液中的EDO-S101。簡而言之,用1M氫氧化鈉將毛細管預先處理2分鐘,用水預先處理2分鐘和用運行緩衝液[100mmol/l乙酸銨溶液(用乙酸調節至pH 3.1)-乙腈(50∶50,v/v)]預先處理3分鐘。將樣品以0.7psi的壓力注射5s並且注射體積約為5nl。在注射後,將EDO-S101在50μm I.D.和50/65cm長度(有效長度/總長度)的熔融二氧化矽毛細管中在15kv和25℃下分離。以UV在300nM檢測來自EDO-S101的吸光度。在光電倍增管(PMT)上收集發射。
為了對數據進行統計學分析,使用雙向重複測量ANOVA,接著是Tukey’s檢驗。認為P<0.05是顯著的。作為CSF和血液曲線下面積(AUC)的比率,確定CNS穿透。
在分析結果後,發現EDO-S101以16.5%的CNS穿透,很好地穿過血腦屏障(參見圖1)。其可以以11.2μM的Cmax獲得高CNS濃度。因此,EDO-S101對於腦腫瘤的治療應用是理想的。還顯示其具有非常短的在血液中約6分鐘和在腦中約9分鐘的半衰期。由於藥物濃度是基於EDO-S101在300nM的UV波長下的吸光度確定的,所以所有測量值是關於未代謝化的EDO-S101的。結果總結在以下表1中。
表1
實施例2 EDO-S101和已知化合物對於各種MGMT陽性和陰性細胞系的體外活性測試
設計體外實驗,其中使用一系列代表MGMT陰性和MGMT陽性腫瘤細胞的GBM細胞系。
化合物:1-100μM EDO-S101,1-50μM替莫唑胺(TMZ),1-50μM替莫唑胺+500nM伏林司他,1-40μM苯達莫司汀,1-40μM苯達莫司汀和500nM伏林司他。
細胞系:A172,LN229,SNB19,SW1783,U251,U373和U87:MGMT陰性細胞系;LN18,Mz54,T98G,U138,U118:MGMT陽性細胞系
使用了十二種代表III級和IV神經膠質瘤並且具有不同MGMT表達、藥物和放療敏感性的成膠質細胞瘤細胞系和五種患者來源的成膠質細胞瘤幹細胞(參見以上)。將四種來源於患者的成膠質細胞瘤幹細胞(由Hotchkiss Brain Institute,醫學系,University of Calgary,Calgary,Alberta,加拿大的J.Gregory Cairncross,和Samuel Weiss友情提供)和一種來自米蘭University la Bicocca的Angelo Vescovi教授的轉染螢光素酶的PTC#8在成分確定的無血清培養基(SFM)中和以非貼壁球體培養的方式培養。將細胞重懸浮於無血清的補充有20ng/ml表皮生長因子(Sigma-Aldrich),20ng/ml鹼性成纖維細胞生長因子(Sigma-Aldrich),B-27補充劑1X(Gibco,Life Technologies)和抗生素的DMEM/F12培養基中。在將3×103個細胞鋪平板於具有幹細胞培養基的96孔平板中之後,直接加入EDO-S101處理。在倒置顯微鏡下以×4放大率,在處理後5天對球體計數。如果球體具有至少15個細胞,將球體計數。
將細胞以2x 104個細胞/ml的密度接種到24孔平板中。將細胞留下貼壁並在5%FCS DMEM中培養24小時。此刻之後,將細胞在適當的培養條件下維持。每天用倒置相差顯微照相機(Nikon Diaphot,東京,日本)進行形態學控制,之後將細胞用胰蛋白酶處理並計數。將用胰蛋白酶處理並重懸浮在1.0ml鹽水中的細胞用NucleoCounterTM NC-100(自動細胞計數系統,Chemotec,Cydevang,DK)計數,以便評估細胞生存力。所有實驗一式三份進行。通過GraFit方法(Erithacus Software Limited,Staines,UK)計算IC50值。使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑鎓溴化物(MTT;Sigma-Aldrich)測定測量細胞生存力。
還如上所述測定所有十二種細胞系針對苯達莫司汀和伏林司他的IC50和IC20值。接下來,進行使用固定劑量的伏林司他(IC20值)和改變劑量的苯達莫司汀的組合測定。計算苯達莫司汀當與伏林司他組合時的新IC50值。
如從圖2可以看出的,U251,U373,SW1783,A172和U87 GBM細胞系對於TMZ高度敏感,而LN229,SNB19和U138中等敏感。然而,MGMT陽性GBM細胞系LN18,Mz54,T98G和U118對於TMZ具有抗性。
在分開的實驗中,將TMZ與500nM伏林司他組合使用。已知伏林司他與TMZ在GBM細胞系中具有協同作用。如從圖3張可以看出,儘管MGMT陽性GBM細胞系LN18和U118對於該組合時敏感的,但是T98G和Mz54仍然是極具抗性的。T98G的IC50被降低,但是其並非在人中可以實現的劑量範圍。
圖4顯示GBM細胞系中沒有一種對於苯達莫司汀高度敏感,但是LN18,LN229,SNB19,U138,U251,U373,SW1783和U87 GBM細胞系對於苯達莫司汀中度敏感,而A172,Mz54,T98G和U118對苯達莫司汀具有抗性。如從圖5中可以看出,當苯達莫司汀與500nM伏林司他組合時,獲得了與TMZ和伏林司他非常類似的結果,即所有細胞系(除了Mz54和T98G以外)是高度敏感的,而T98G的IC50降低,它不是人中可實現的劑量範圍。
與其他單一化合物和組合比較,圖6張十二種測試的細胞系的IC50曲線顯示了所有十二種細胞系,包括所有MGMT陽性細胞系,對於EDO-S101是高度敏感的。這顯示EDO-S101是針對MGMT陰性和MGMT陽性GBMs二者的高度有希望的治療劑。
對於不同細胞系的IC50值的總結顯示在以下表2中。
表2
實施例3 EDO-S101在小鼠模型中對於多形性成膠質細胞瘤的體內評估
基於通過生物發光成像確定的腫瘤生長和通過Kaplan-Meier分析確定的存活分析,在鼠腦腫瘤模型中確定EDO-S101針對GBM的治療活性。
使用立體定位平臺,在麻醉下在無胸腺小鼠中通過腦內注射3X105個轉染螢光素酶的GBM12細胞,產生鼠腦腫瘤模型。GBM12是MGMT陰性腫瘤細胞系。在外科手術之前,將十八周齡的無胸腺小鼠進行最少7天適應/隔離。在無菌條件下在層流淨化罩中進行外科手術。給予Tylenol 300mg/kg PO,以用於在外科手術前鎮痛24小時,手術後持續48小時。通過吸入1-2%異氟烷實現麻醉。在小鼠變得完全被麻醉後,將其置於Kopf立體定位儀器中。將少量BNP抗生素軟膏(桿菌肽,新黴素和多粘菌素的混合物)塗抹在其眼睛上以防止手術期間的感染和角膜損傷。將一條軟織物放在小鼠身體和尾巴上以防止手術期間過度熱損失。頭皮區域用2%聚維酮碘(Betadine)清潔並用棉尖塗藥器乾燥。在頭皮中進行中線矢狀切割。
根據通過參考Franklin和Paxinos的小鼠腦地圖測定的坐標(AP:0.5mm,LM:2.5mm),在左頭骨上用外科鑽頭(Kopf)或Dremel鑽頭鑽一個小的鑽孔。將硬腦脊膜外科暴露,並將具有26S-號傾斜針頭的10μl-Hamilton注射器放低到左腦半球中直至3mm的深度,並緩慢輸入(0.5μl/min)5μl的3X105個轉染了螢光素酶的GBM12細胞腫瘤細胞。將針頭放置原位達5分鐘以防止回流,然後緩慢取出。用傷口夾密封皮膚。在外科手術後,將小鼠在溫暖環境中康復並且當運動能力恢復時返回至它們的籠子中。將籠子放在加熱墊頂部以最小化康復期間的身體熱損失。在手術後監視小鼠,至少一天兩次,共5天,或直至康復完成。在腦內腫瘤細胞移植後+4天開始,然後隨後在第+11天和第+18天,通過尾靜脈施用EDO-S101(60mg/kg體重)或苯達莫司汀(50mg/kg體重)。將肢體麻痺作為存活分析的終點。
在腦內注射GBM細胞後,將所有小鼠進行生物發光成像(BLI),從腦內注射後第4天開始,一周兩次,以監視實時體內腫瘤生長。使用Xenogen Lumina光學成像系統(Caliper Life Sciences,Hopkinton,MA)進行BLI。用異氟烷將小鼠麻醉,之後以150mg/kg的劑量進行螢光素的腹膜內注射,提供螢光素酶的飽和底物濃度。在螢光素注射後10分鐘記錄到峰值發光信號。使用Living Image軟體(Xenogen,Alameda,CA)限定涵蓋顱內信號區域的目標區域,並且記錄總光子/s/立體弧度/cm2。
使用ANOVA來確定每個時刻實驗組之間的差異的統計學顯著性。使用Prism4軟體(GraphPad Software,LaJolla CA)產生Kaplan-Meier存活曲線,以對數秩檢驗得出曲線之間的統計學差異。認為P<0.05是顯著的。
在GBM(GBM12)的該患者衍生的異種移植物模型中,將EDO-S101以IV 60mg/kg每周一次在腦內移植腫瘤細胞後+4,+11,+18天施用(MTD劑量)。將苯達莫司汀以IV 50mg/kg在+4,+11,+18天給予(MTD劑量)。發現EDO-S101具有顯著的治療活性,抑制腫瘤生長和延長存活,中值存活為66天,相比之下,苯達莫司汀為58天,並且在非處理對照中為52天(參見圖7a和7b)。EDO-S101具有優異的針對該MGMT陰性多形性成膠質細胞瘤的治療活性。
使用細胞系U87G和U251G,以類似的方式採用上述步驟。再次,通過尾靜脈靜脈內施用EDO-S101(60mg/kg),但是在這些實驗中,將其在第1,8和15天施用。替代苯達莫司汀,施用TMZ作為比較,16mg/kg,連續5天,po。在28天之後處死小鼠。
對於已經植入U251腫瘤的小鼠,在圖8中進展時間(TTP)概率(%)針對時間的圖表顯示,對於用EDO-S101處理的小鼠的TTP顯著長於對於對照小鼠和用TMZ處理的那些觀察到的。對於移植了U87腫瘤的小鼠觀察到了類似的TTP的顯著增加,EDO-S101的TTP顯著長於對照和TMZ兩者(參見圖9)。
實施例4在多形性成膠質細胞瘤的鼠模型中對於放療和替莫唑胺(單獨或組合)EDO-S101(單獨或與放療組合)的體內評估
在第一個實驗中,將U251,U87和T98G細胞系用單獨放療或用放療和EDO-S101處理。
對於克隆存活,將指數生長的細胞(70%匯合)在常規培養基中培養並用適當濃度的EDO-S101或載體(0.1%的DMSO終濃度)處理24小時。使用6MV線性加速器Elekta Synergy,使用臨床上校準的30×30cm的輻射面積進行腫瘤細胞輻射。在完全裝填培養基的細胞培養瓶之上和之下放置兩cm厚的有機玻璃板以補償積累效應(build-up effect)。除了輻射暴露以外,以與輻射的細胞一樣處理非輻射對照。在處理之後,將細胞以適當濃度(1,000個細胞)稀釋並且再接種在新的100mm組織培養皿中(一式三份)並溫育14天。在第14天,去除培養基,並將克隆用甲醇:乙酸(10∶1,v/v)固定,並用結晶紫染色。計數含有超過50個細胞的克隆。計算平板效率(PE)為觀察到的克隆數/鋪平板的細胞數。計算存活分數為與對照中形成的數目相比在處理的平皿中形成的克隆數。根據線性-二次公式:S(D)/S(O)=exp-(aD+bD2),通過加權的、分層的線性回歸擬合數據,使用SPSS(Chicago,IL)統計軟體分析存活曲線。
對於MGMT陰性U251MG成膠質細胞瘤細胞系,測量的IC50對於EDO-S101為6.60μM(相比之下,對於苯達莫司汀為30μM,並且對於替莫唑胺為20μM)。
對於MGMT陰性U87G成膠質細胞瘤細胞系,測量的IC50對於EDO-S101為1.36μM(相比之下,對於苯達莫司汀為50μM,並且對於替莫唑胺為20μM)。
對於MGMT陽性T98G成膠質細胞瘤細胞系,測量的IC50對於EDO-S101為7.70μM(相比之下,對於苯達莫司汀為52μM,並且對於替莫唑胺為>100μM)。
如從圖10可以看出,在所有3種GBM細胞系中,與單獨放療相比,當放療與一個劑量的EDO-S101(2.5μM或5μM)聯用時,成膠質細胞瘤細胞的%存活率顯著降低。
接下來,採用實施例3的步驟,使用GBM細胞系U251和U87,在小鼠中製備GBMs皮下(s.c.)異種移植物模型。
將如上製備的U251小鼠進行放療(2Gy,連續5天),用EDO-S101(60mg/kg,靜脈內,在治療周期的第1,8和15天)或僅對照處理。在任何輻射之前,小鼠用氯胺酮(25mg/ml)/甲苯噻嗪(5mg/ml)的混合物麻醉。麻醉的攜帶腫瘤的小鼠以2Gy的劑量接收病灶輻射,連續5天。使用X-射線線性加速器以200cGy/min的劑量速率在室溫遞送輻射。將所有小鼠用特別設計的鉛裝置屏蔽,以允許輻射到右後肢。將小鼠保持在這些條件下直至所有輻射完成。
根據實施例3的步驟進行GBM的進展研究。進展時間概率(%)針對時間的圖表顯示在圖11中。從這很明顯,用EDO-S101處理的小鼠的進展時間要顯著長於對於放療處理的腫瘤所觀察到的。
在後續實驗中,將以相同方式製備的U251小鼠進行以下處理:當前的放療和替莫唑胺的金標準處理(2Gy,連續5天,和16mg/kg,連續5天,po),用EDO-S101(60mg/kg,靜脈內,在治療周期的第1,8和15天)處理,用EDO-S101和放療(2Gy,連續5天,和60mg/kg,靜脈內,在治療周期的第1,8和15天)或對照處理。在圖12中顯示了進展時間概率(%)針對時間的圖表。從這很明顯,用EDO-S101和放療處理的小鼠的進展時間要顯著長於用單獨EDO-S101處理的腫瘤所觀察到的。此外,對於放療和EDO-S101的組合的進展時間要顯著長於對於用放療和替莫唑胺(當前的金標準處理)處理的腫瘤所觀察到的。
遵照相同的實驗順序,但是這次是使用GBM細胞系U87在小鼠中製備的GBM的皮下異種移植物模型。在第一個實驗中,將如上製備的U87小鼠進行以下處理:放療(2Gy,連續5天),用EDO-S101(60mg/kg,靜脈內,在治療周期的第1,8和15天)或僅對照處理。進行GBM進展的研究。圖13中顯示了進展時間概率(%)針對時間的圖表。從這很明顯,用EDO-S101(在圖13中稱為NL101)處理的小鼠的進展時間要顯著長於對於放療處理的腫瘤所觀察到的。
在與關於U251小鼠所用類似的後續實驗中,將以相同方式製備的U87小鼠進行以下處理:當前的的金標準處理-放療和替莫唑胺(2Gy,連續5天,和16mg/kg,連續5天,po),用EDO-S101(60mg/kg,靜脈內,在治療周期的第1,8和15天)處理,用EDO-S101和放療(2Gy,連續5天,和60mg/kg,靜脈內,在治療周期的第1,8和15天)或對照處理。圖14中顯示了進展時間概率(%)針對時間的圖表。從這很明顯,用EDO-S101和放療處理的小鼠的進展時間要顯著長於對於用單獨EDO-S101處理的腫瘤所觀察到的。此外,對於放療和EDO-S101的組合的進展時間要顯著長於對於放療和替莫唑胺(當前的金標準處理)所觀察到的。還應當注意,對於用單獨EDO-S101處理的U87小鼠觀察到的進展時間確實要大於用組合的放療和替莫唑胺處理所取得的進展時間。
腫瘤的進展時間從對於U251G小鼠異種移植物模型的對照的約17-18天增加至對於放療和替莫唑胺的組合的42天,到對於單獨的EDO-S101的超過50天(顯著性P=0.924),到對於EDO-S101和放療的組合的顯著超過50天(顯著性P=0.0359)。
發現腫瘤的進展時間從對於U87G小鼠異種移植物模型的對照的約15天增加至對於放療和替莫唑胺的組合的35天,到對於單獨的EDO-S101的40天(顯著性P=2372),到對於EDO-S101和放療的組合的顯著超過50天(顯著性P=0.0001)。
實施例5腫瘤的組織學評估:U251-轉染螢光素酶的細胞的原位移植模型
將按照實施例3的步驟用U251-螢光素酶同位素地(isotopically)轉染的小鼠用以下處理:放療(2Gy,連續5天),替莫唑胺(16mg/kg,連續5天,po),放療和替莫唑胺(2Gy,連續5天和16mg/kg,連續5天,po),EDO-S101(60mg/kg,靜脈內,在治療周期的第1,8和15天)或對照載體。
使用Hamamatsu成像系統(Caliper Life Sciences,Hopkinton,MA,USA)監視顱內腫瘤生長。將小鼠用2%至4%異氟烷(Baxter,Deerfield,IL,USA)麻醉,接著腹膜內注射150mg/kg d-螢光素(In Vivo Imaging Solutions)。同時測量五隻動物,並且將發光照相機設置為1分鐘曝光,中等合併(medium binning),1f/光圈(stop),封閉激發濾鏡,和開啟發射濾鏡。將照相機設置為2s曝光,中等合併,和8f/光圈。將視野設定為22cm以一次捕獲五隻小鼠。使用相同的設定,以一周一次的基礎獲取系列圖像。使用Living Image軟體(Caliper Life Sciences)定量生物發光強度。
在任何輻射之前,將小鼠用氯胺酮(25mg/ml)/甲苯噻嗪(5mg/ml)的混合物麻醉。麻醉的攜帶腫瘤的小鼠以2Gy的劑量接收病灶輻射,連續5天。使用X-射線線性加速器以200cGy/min的劑量速率在室溫遞送輻射。將所有小鼠用特別設計的鉛裝置屏蔽,以允許輻射到右後肢。將小鼠保持在這些條件下直至所有輻射完成。
使用下列順序獲得橫平面的所有圖像:橫向T2-加權渦輪自旋迴波(turbo spin-echo,TSE)順序(重複時間[TR]微秒/回波時間[TE]微秒)6766/120,獲得信號數量4,192x 192矩陣),應用的切片厚度0.9mm,交叉間隙(intersection gap)0.0mm,和傾倒角160°。視野為36x 60mm2,其整體包括在腫瘤中,獲得的三維像素尺寸為0.3x 0.3x 1.0mm3。
連續變量總結為平均值和標準偏差(SD)或中值和中值的95%CI。對於非正態分布的連續變量,通過進行Kruskal-Wallis檢驗建立對照和處理組之間的統計學比較。對於正態分布的連續變量,通過對未成對數據(對於兩個比較)進行ANOVA檢驗或進行Student t檢驗,建立對照和處理組之間的統計學比較。
在開始不同治療方案後50天,處死小鼠並在用對照、EDO-S101、替莫唑胺、以及放療和替莫唑胺進行處理的小鼠中,將最終顱內損傷可視化。結果顯示在圖15和16中。使用EDO-S101和替莫唑胺研究獲得類似的結果,兩者都顯示13隻小鼠中5隻(38.5%)具有某個級別的腫瘤,與此對比,在對照中11隻小鼠中8隻(72.7%)具有某個級別的腫瘤。然而,EDO-S101處理的13隻小鼠中僅有1隻顯示大的損傷,而13隻替莫唑胺處理的小鼠中有2隻顯示大的損傷。在放療和替莫唑胺研究中,11隻小鼠中僅2隻(18.2%)在研究結束時顯示損傷,儘管這些兩者都是大損傷。從這可以得出結論,EDO-S101在預防GBMs擴散方面高度有效。
EDO-S101在預防GBMs擴散方面的功效進一步在圖17中強調,該圖顯示了存活概率(%)針對時間(天)的圖表。用EDO-S101處理的小鼠的存活概率顯著大於關於用放療或替莫唑胺處理的那些的存活概率。僅用放療和替莫唑胺的組合處理的小鼠顯示了與單獨EDO-S101相比更高的總存活概率。
實施例6 EDO-S101在原發性CNS淋巴瘤鼠模型中的體內評估
重複實施例3的步驟,除了用1x 105個轉染了螢光素酶的OCI-LY10B淋巴瘤細胞建立鼠模型,產生原發性CNS淋巴瘤模型。在腦內移植OCI-LY10B淋巴瘤細胞後第+4,+11和+18天,將EDO-S101(60mg/kg體重),苯達莫司汀(50mg/kg體重)和對照通過尾靜脈靜脈內施用於分開的測試小鼠組。EDO-S101和苯達莫司汀兩者都顯著抑制腫瘤生長並且延長存活,中值存活分別為62天和54天,與此對比,非處理對照為48天(參見圖18a和18b)。因此,EDO-S101似乎是原發性CNS淋巴瘤的有希望的治療。
實施例7 EDO-S101在腦的三陰性轉移性乳腺癌(Triple Metastatic Breast Cancer)的小鼠模型中的體內評估
重複實施例3的步驟,除了用1x 105個轉染了螢光素酶的MB-468乳腺癌細胞建立小鼠模型,產生原發性CNS淋巴瘤模型。在腦內移植MB-468乳腺癌細胞後第+4天,將EDO-S101(60mg/kg體重),苯達莫司汀(50mg/kg體重)和對照通過尾靜脈靜脈內施用於分開的測試小鼠組。EDO-S101顯示了顯著的治療活性,抑制腫瘤生長並且延長存活,中值存活為71天,與此對比,苯達莫司汀為62天,並且非處理對照為55天(參見圖19a和19b)。因此,EDO-S101似乎是轉移性腦癌的特別有希望的治療。
總之,實驗顯示了EDO-S101穿過血腦屏障的能力是非常好的。這使得它成為治療腦癌的有希望的候選物。實驗數據進一步顯示,其不僅具有針對MGMT陰性GBMs的活性,而且具有針對MGMT陽性GBMs的活性,使得其高度有希望作為治療MGMT陽性GBMs和其他MGMT陽性星形膠質細胞腦腫瘤的治療劑,因為對於這些還未開發出療法。還顯示了它在原發性CNS淋巴瘤和轉移性腦癌中都顯著延長中值存活,再次使得它是兩種病症的非常有希望的候選治療劑。數據還顯示,當將EDO-S101與放療組合施用時,則它在GBM的治療中顯示了與單獨EDO-S101相比顯著改善的活性。
