生物質提取物及其提取方法與流程
2023-10-09 19:20:54 4
本申請要求於2014年4月21日遞交的,序號為61/981,957的美國臨時申請的優先權,其全部內容通過全文引用併入本申請。
技術領域
本發明一般涉及利用生物質的技術。更具體的,本發明提供能夠有效的、大規模的捕獲生物質(例如DDGS)的許多有價值組分的新方法,及其組合物和應用。
背景技術:
具有可溶物的幹酒糟(DDGS)是釀酒過程的副產品。DDGS的傳統來源是來自釀酒商。最近,美國生物乙醇產量從2000年的17億加侖到2014年的150億加侖的顯著增長(http://ethanolrfa.org/pages/statistics)大大增加了DDGS的供應。目前,美國佔全球生物乙醇產量的58%,令人驚訝的複合年增長率(CAGR)為16.8%。(http://ethanolrfa.org/pages/World-Fuel-Ethanol-Production)此外,美國能源部藍圖在2030年前需要400億加侖的生物乙醇。
由於美國的主要原料是玉米,目前超過95%的DDGS由乙醇燃料廠生產。僅在美國和加拿大,每年就會生產3200萬至3900萬噸DDGS,這個數字預計將會繼續增長。在加拿大和美國,超過75%的DDGS用作家畜飼料(「DDGS概述」,明尼蘇達大學動物科學系http://www.ddgs.umn.edu/overview.htm。)
不同於由於含水量而具有四至五天保質期的維生素穀物(WDG),DDGS具有幾乎無限的保質期,並且可以運輸到任何市場,而不管其是否接近乙醇廠。來自乙醇工業,基於玉米的酒糟通常作為高蛋白質家畜飼料而銷售。
DDGS的營養成分取決於所使用的穀物的來源和質量,以及產生DDGS的具體過程。在美國生產的大多數乙醇是由玉米製成。因為玉米包含約三分之二的澱粉,並且大多數澱粉在發酵期間轉化為乙醇,DDGS的營養物(例如蛋白質、脂肪、纖維、灰分和磷)含量比玉米濃2至3倍。不同植物產生的DDGS在營養物質含量和質量上,可以存在大的變化。
除了玉米之外,小麥、大麥、黑麥和高粱(milo)也可用於酒精生產。來自小麥的DDGS比來自玉米和高粱的蒸餾產品具有高得多的蛋白質和低得多的脂肪含量。
一個主要的挑戰是更好地利用由乙醇植物和釀酒商產生的大量生物質。為了降低燃料乙醇的生產成本,迫切需要來自生物精煉方法、新的和改進的DDGS和其它副產物的利用。雖然已經報導了從DDGS中提取蛋白質和生物柴油的嘗試,但是在工業規模上,捕獲DDGS中的許多其它有用組分尚未成功。
技術實現要素:
本發明部分是基於新的改進的技術的發現,該技術允許以有成本效益的商業規模,高效捕獲生物質(例如DDGS)的有價值的活性成分。可以有效捕獲的活性成分包括例如維生素、類黃酮、類胡蘿蔔素、生育酚和親脂性酚類(lipophilic phenolics)、酚酸和核苷酸。本發明的提取物組合物以獨特的比例存在一組活性成分,例如提高的生物利用度。
一方面,本發明一般涉及從生物質中提取一種或多種活性成分的方法。該方法包括:(a)使生物質與溶劑接觸,其接觸的條件和時間足以將一種或多種活性成分從生物質提取到溶劑中,從而產生殘餘生物質以及包含溶劑和提取的一種或多種活性成分的液相;(b)分離所述殘餘生物質和包含所述溶劑和一種或多種活性成分的液相;和(c)從液相中除去溶劑,得到包含一種或多種活性成分的濃縮混合物或基本上純的形式的提取物組合物。
另一方面,本發明一般涉及包含通過本發明的方法提取的一種或多種活性成分的組合物。
再一方面,本發明一般涉及生物質提取物,其包含以重量計的:約0.1%至約10%的維生素;約0.1%至約10%的類黃酮;約0.1%至約10%的類胡蘿蔔素;約0.1%至約10%的生育酚;約0.1%至約30%的親脂酚醛樹脂和約0.1%至約30%的酚酸。
再一方面,本發明一般涉及從生物質中提取核苷酸的方法。該方法包括:(a)使生物質與鹼性水溶液接觸,其接觸的條件和時間足以從生物質提取核酸,從而產生殘餘生物質和包含提取的核酸的鹼性水相;(b)分離殘餘生物質和包含提取的核酸的鹼性水相;(c)處理包含提取的核酸的鹼性水相,以從水相中沉澱核酸;和(d)從水相中分離沉澱的核酸以產生包含核酸的提取物組合物。
再一方面,本發明一般涉及包含通過本發明的方法產生的核酸的組合物。
再一方面,本發明一般涉及包含通過本發明的方法產生的5'-核苷酸單磷酸單體的組合物。
再一方面,本發明一般涉及生物質提取物,其包含按重量計的:約0.1%至約50%的GMP;約0.1%至約50%的UMP;約0.1%至約50%的IMP;和約0.1%至約50%的CMP。
再一方面,本發明一般涉及包含通過本發明公開的方法產生的玉米醇溶蛋白的組合物。在某些實施例中,產生的玉米醇溶蛋白與來自商業來源或從玉米提取的玉米醇溶蛋白相似或基本相同。
附圖說明
圖1A示意性地描述了涉及生物質的提取以獲得提取物組合物的本發明的示例性實施例;
圖1B示意性地描述了涉及生物質的提取以獲得提取物組合物的本發明的示例性實施例;
圖2示意性地描述了涉及生物質的提取以獲得提取物組合物的本發明的示例性實施例;
圖3為DDGS鹽水提取物的UV-VIS光譜;
圖4為用生物活性劑(檢測波長:300nm)對DDGS油進行HPLC分析;
圖5為玉米醇溶蛋白的SDS-PAGE圖像,泳道1:商業玉米醇溶蛋白;2:從DDGS提取的玉米醇溶蛋白樣品;3:來自玉米的玉米醇溶蛋白;濃度:用樣品緩衝液將30mg/mL玉米醇溶蛋白在70%EtOH中稀釋至10mg/mL;
圖6為核苷酸提取物的HPLC色譜圖(檢測波長為254nm);核苷酸的單個濃度為UMP,4.61±0.05mg/g;GMP,2.98±0.04mg/g;AMP,3.02±0.04mg/g;
圖7為小鼠血漿中類胡蘿蔔素的吸收;
圖8為小鼠血漿中γ-和α-生育酚的吸收;
圖9為小鼠血漿中酚類的吸收。
定義
本申請所用的術語「生物質」廣泛地指來自活的、或近期活的生物體的任何生物材料。生物質可以指植物或基於植物的材料,包括木質生物質和農業生物質。生物質的實例包括玉米糖漿、玉米油、糖蜜、青貯飼料、農業殘餘物(玉米秸稈、草、稻草、穀殼、甘蔗渣等)、酒糟溼穀物(DWG)、幹酒糟(DDG),幹酒糟(DDS),濃縮酒精可溶物(CDS),具有可溶物的幹酒糟(DDGS)、改性DDGS、木質材料(木材或樹皮、鋸屑、木材斜紋和磨碎料)、楊樹、柳樹、桉樹、柳枝稷、苜蓿、藍藻、藻類、包括大型藻類等)。穀物澱粉的實例包括:全麥麵粉、全燕麥/燕麥、全穀物玉米/玉米粉、糙米、全黑麥、全穀物大麥、全法蘭、野生稻、蕎麥、小黑麥、粟、藜麥、高粱、澱粉蔬菜包括:歐洲防風草、車前草馬鈴薯、南瓜、橡果南瓜、胡桃樹、青豆。
示例性生物質還包括纖維素材料、木質纖維素材料、半纖維素材料、碳水化合物、果膠、澱粉、菊粉、果聚糖、葡聚糖、玉米、甘蔗、草、柳枝稷、高粱、高生物量高粱、竹、藻類和衍生自這些材料的材料。生物質還包括加工的或廢的生物質,例如,經發酵產生醇或其他發酵產物後的生物質。
本申請所用的術語「發酵」是指使用微生物或微生物群,在適合微生物的培養基之中或之上,將有機分子轉化成另一分子的過程。微生物可以有氧或厭氧生長。例如,「發酵可以指轉化生物質中糖或其它分子以產生醇(例如乙醇、甲醇、丁醇);有機酸(例如檸檬酸、乙酸、衣康酸、乳酸、葡萄糖酸);酮(例如丙酮),胺基酸(例如穀氨酸)。因此,發酵包括酒精發酵。
發酵可以通過適合用於期望的發酵步驟的任何生物來實現,包括但不限於細菌、菌、細菌和原生生物。合適的發酵生物包括那些可以將單糖、二糖和三糖,特別是葡萄糖和麥芽糖或任何其它生物質衍生的分子直接或間接轉化為所需發酵產物(例如乙醇、丁醇等)的生物。合適的發酵生物包括,例如,酵母或絲狀真菌。酵母可以包括來自畢赤酵母屬(Pichia)或酵母屬(Saccharomyces)的菌株。在一些實施例中,酵母可以是釀酒酵母(Saccharomyces cerevisiae)。在一些實施例中,發酵由細菌實現。在一些實施例中,微生物(例如酵母或細菌)可以是經遺傳修飾的微生物。
本申請所用的術語「預處理」是指導致生物質更易於用溶劑如醇或水溶液提取的,任何機械、熱、生物化學或化學過程或其組合。
本申請在營養和營養成分的上下文中使用的術語「生物利用度」,可以定義為能夠被吸收並可用於使用或儲存的施用物質的比例。因此,生物利用度指通過正常途徑消化,吸收和代謝的那部分營養物。(Srinivasan 2001「營養物的生物利用度:體外證明多種維生素-礦物質組合產品中營養物可用性的實用方法」,營養學報131(4Suppl):1349S-50S。)
本申請所用的術語「核酸」是指任何長度的聚合物,例如大於約2個鹼基,大於約10個鹼基,大於約100個鹼基,大於約500個鹼基,大於1,000個鹼基或更多個由核苷酸組成的鹼基,例如脫氧核糖核苷酸或核糖核苷酸。核酸可以以單鏈或雙鏈形式存在。具有兩條核酸互補鏈的雙鏈核酸在本申請中可以稱為「第一」和「第二」鏈或一些其他任意命名。
本申請所用的術語「核苷酸」是指核苷單磷酸,核酸(無論是DNA或RNA或其類似物)的亞單位,其包括磷酸基團、糖基和雜環鹼基,以及這些亞單元的類似物。
具體實施方式
本發明提供了新的、改進的方法,該方法允許在商業規模上,有成本效益地、高效連續地捕獲生物質(例如,DDGS)中的有價值的活性成分。可以有效捕獲的活性成分包括,例如維生素,類黃酮,類胡蘿蔔素,生育酚和親脂性酚類,酚酸,核苷酸和玉米醇溶蛋白。本發明還提供具有獨特性質(例如營養價值和增強的生物利用度)的活性成分的新型組合物。另外,本發明通過生物質的高效和有成本效益的利用,降低了生物燃料生產的成本。
當以大規模(公斤級規模或更大)執行時,從DDGS中高效和有成本效益地回收活性成分遇到了許多挑戰。在100公斤級或更大規模時,這些挑戰可以變得更加顯著。典型的困難包括起泡,固液相的分離,所需組分的低提取產率。例如,起泡是大規模提取中常見的困難,會大大降低提取效率並增加操作的成本。同時,固液分離是另一個常見的問題,其可能導致涉及複雜和耗時的分離程序,導致生產成本的增加。從基於穀物的DDGS中提取活性成分也存在獨特的問題。例如,DDGS中的顯著的油含量可能降低提取產率,並且由於需要重複提取而增加生產成本,因為在大規模提取過程中,非常需要通過提高提取效率來消除重複操作,這可以大大降低生產成本。可以通過選擇最佳提取溫度,時間,提取溶劑,應用酶將核酸分解成可提取單體,選擇最佳固液分離方法來實現。
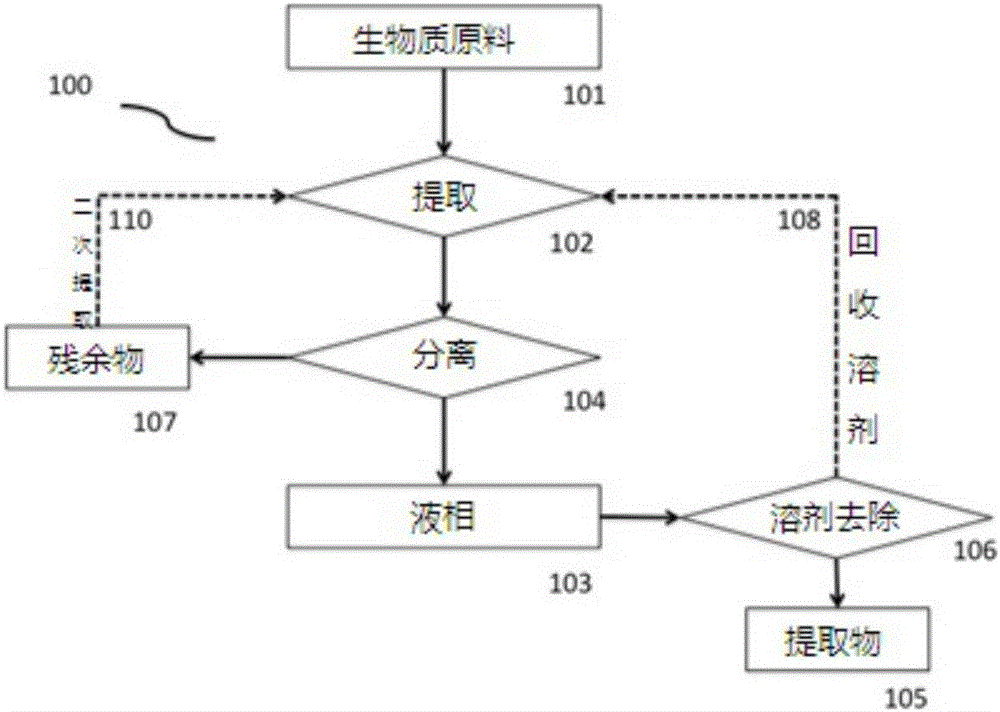
參照圖1A,其描述了用於從生物質中提取活性成分的本發明的示例性實施方案的流程圖(100)。將生物質原料(101)注入到提取容器中,並在溶劑與生物質的選擇比例下,與溶劑(例如水或乙醇)混合。提取容器可以根據需要關閉或打開。提取(102)在設定的溫度,壓力和時間長度條件下進行。一旦認為提取完成,就進行分離步驟(104),由此分離固相和液相。固相或殘餘生物質(107)可以用新鮮溶劑(或多種溶劑)再提取,以進行進一步提取(110)。使液相(103)經歷溶劑去除(106),產生粗提取物(105)。去除的溶劑(108),例如乙醇,可以回收用於提取(102)或其它目的。粗提取物(105)可以原樣使用或可以進行進一步的處理和/或純化程序。在提取核苷酸的情況下,酶被添加到水和DDGS的混合物中,以將核酸解聚成核苷酸,從而提供核苷酸提取物。
參照圖2,其描述了用於從生物質中提取核酸和核苷酸的本發明的另一個示例性實施方案的流程圖(100)。將生物質原料(201)注入到提取容器中,並在溶劑與生物質的選擇比例下,與溶劑(例如鹼性水溶液)混合。提取容器可以根據需要關閉或打開。提取(202)在設定的溫度,壓力和時間長度條件下進行。一旦認為提取完成,就進行分離步驟(204),由此分離固相和液相。固相或殘餘生物質(207)可以用新鮮溶劑(或多種溶劑)再提取,以進行進一步提取(212)。使液相(203)經歷酸化和/或加入其它溶劑,以引起核酸沉澱,然後將其分離,得到粗提取物(205)。
一方面,本發明一般涉及從生物質中提取一種或多種活性成分的方法。該方法包括:使生物質與溶劑A接觸,其接觸條件和時間足以將一種或多種活性成分從生物質提取到溶劑A中,從而產生殘餘生物質I以及包含溶劑A和提取的一種或多種活性成分的液相;分離所述殘餘生物質I和包含溶劑A和提取的一種或多種活性成分的液相;以及從液相中除去溶劑A,得到包含一種或多種活性成分的濃縮混合物或基本上純的形式的提取物組合物。
在某些優選的實施方案中,所述方法還包括:使殘餘生物質I與溶劑B接觸,以將蛋白質提取到溶劑B中,從而產生殘餘生物質II以及包含溶劑B和蛋白質的液相;並分離殘餘生物質II和包含溶劑B和提取的蛋白質的液相;以及從液相中除去溶劑B,得到包含蛋白質的提取物組合物。
在某些優選的實施方案中,所述方法還包括:使殘餘生物質II與溶劑C和5'-磷酸二酯酶接觸,以將核苷酸提取到溶劑中;並分離殘餘生物質II和包含溶劑C和提取的核苷酸的液相;以及從液相中除去溶劑C,得到包含核苷酸的提取物組合物。
再次參照圖1B,本發明的示例性方法可包括以下步驟:(a)使生物質與溶劑(例如乙酸乙酯,乙醇或其組合)接觸,其接觸條件和時間足以將一種或多種活性成分從生物質提取到溶劑,從而產生殘餘生物質I以及包含溶劑和提取的一種或多種活性成分的液相;(b)分離所述殘餘生物質I和包含所述溶劑和一種或多種活性成分的液相;(c)從液相中除去溶劑,以得到包含一種或多種活性成分的濃縮混合物或基本上純的形式的提取物組合物;(d)使殘餘生物質I與70%乙醇接觸,以提取醇可溶性蛋白質(玉米醇溶蛋白);(e)分離殘餘生物質(其被稱為殘餘生物質II)和包含溶劑和玉米醇溶蛋白的液相;(f)從液相中除去溶劑,得到包含玉米醇溶蛋白的提取物;(g)重複步驟(d)至步驟(f),以使玉米醇溶蛋白的產量最大化;(h)使殘餘生物質II與水和5'-磷酸二酯酶接觸,以將核酸水解成可提取核苷酸;(i)分離殘餘生物質(其被稱為廢DDGS)和包含核苷酸和其它水溶性化合物的液相;(j)從液相中除去溶劑,得到富含核苷酸的餾分;以及(k)乾燥廢DDGS以產生廢DDGS粉末。
任何合適的生物質原料都可以被使用。示例性生物質原料包括植物或基於植物的材料的發酵產物。在某些實施方案中,生物質原料是各種穀物(例如玉米、稻、小麥、大麥和黑麥)的發酵產物。在某些優選的實施方案中,生物質原料是DDGS。在某些優選的實施方案中,生物質原料是由基於玉米的乙醇發酵所產生的DDGS。
在某些實施方案中,生物質可以包括來自植物或基於植物材料的發酵產物鹼性水提取的廢生物質材料,例如來自穀物發酵產物鹼性水提取的廢生物質材料,所述穀物選自玉米、稻、小麥、大麥和黑麥。在某些實施方案中,所述生物質可包括由具有可溶物的幹酒糟(DDGS)的鹼性水提取產生的廢生物質材料。
生物質可以是任何合適的形式,例如通常的具體形式的尺寸為約0.5μm至約10mm(例如,約0.5μm至約8mm,約0.5μm至約6mm,約0.5μm至約5mm,約0.5μm至約2mm,約0.5μm至約1mm,約1μm至約10mm,約10μm至約10mm,約50μm至約10mm,約1mm至約10mm)。
任何合適的溶劑(包括溶劑混合物)均可以用於提取。在某些實施方案中,使用醇作為溶劑。在某些優選實施方案中,使用乙醇作為溶劑。
在某些實施方案中,溶劑可以包括兩種或更多種共溶劑,例如第一或主要共溶劑和第二或次要共溶劑。在某些實施方案中,使用乙醇作為主要共溶劑,並且還使用共溶劑(例如,另一種醇、水、丙酮、乙酸乙酯和己烷)。第一、主要共溶劑與第二、次要共溶劑的重量比可以是任何合適的比例,例如約5:1至約20:1(例如,約7:1至約20:1,約10:1至約20:1,約15:1至約20:1,約5:1至約10:1,約5:1至約12:1,約5:1至約15:1,約7:1至約12:1,約7:1至約10:1)。在某些優選的實施方案中,第一共溶劑是乙醇。
在某些實施方案中,溶劑A選自醇,水,丙酮,乙酸乙酯和己烷及其兩種或更多種的組合;溶劑B選自水,乙醇,異丙醇和雜醇及其兩種或更多種的組合;並且溶劑C選自水和鹽水。
溶劑與生物質的重量比可以是任何合適的比例,例如約2:1至約15:1(例如,約2:1至約12:1,約2:1至約10:1,約5:1至約15:1,約5:1至約11:1,約5:1至約9:1,約7:1至約15:1,約7:1至約12:1,約7:1至約10:1,約7:1至約9:1)。
對於殘餘生物質和包含溶劑和一種或多種活性成分的液相的分離步驟,其可以通過任何合適的技術進行,例如通過過濾和/或離心。分離步驟可包括一輪過濾或離心或可包括兩輪或多輪的過濾或離心或其組合。
一旦殘餘生物質從具有溶劑和一種或多種活性成分的液相中分離,從液相中除去溶劑,已得到一種或多種活性成分的粗提取物。
溶劑可以通過多種技術除去,例如通過蒸發、蒸餾、真空轉移和過濾。蒸發可以在升高的溫度和/或減壓下進行。適合於溶劑去除的溫度和壓力可以根據溶劑的性質,生產的規模,所回收的溶劑是否被回收在提取中再利用等來選擇。通常,蒸發可以在以下溫度下有效地進行:約20℃至約100℃(例如,約30℃至約100℃,約40℃至約100℃,約50℃至約100℃,約60℃至約100℃,約20℃約100℃,約20℃至約100℃,約20℃至約100℃,約20℃至約100℃),在約大氣壓至約1mmHg的壓力下進行。在某些實施方案中,從液相除去的溶劑被回收並用於提取步驟。
根據生物質的來源,可以根據本發明公開的方法提取多種化合物。優選地,所述一種或多種活性成分選自維生素、類黃酮、類胡蘿蔔素、生育酚和親脂性酚類以及酚酸。
在某些實施方案中,可通過本發明的方法提取的所述維生素包括以下的一種或多種:維生素E、維生素B(例如維生素B1、B2、B3、B4、B6)、維生素D、維生素A。
在某些實施方案中,可通過本發明的方法提取的所述類黃酮包括以下中的一種或多種:花青素(包括無糖花色素苷糖苷和花青苷糖苷)。
在某些實施方案中,可以通過本發明的方法提取的所述類胡蘿蔔素包括以下中的一種或多種:β-胡蘿蔔素、葉黃素和玉米黃質。
在某些實施方案中,可通過本發明的方法提取的所述生育酚包括以下的一種或多種:α-生育酚、δ-生育酚和γ-生育酚。
在某些實施方案中,可通過本發明的方法提取的所述親脂性酚類包括以下中的一種或多種:阿魏酸及其酯和香豆酸及其酯、咖啡酸及其酯,以及突觸酸及其酯。
根據生物質的來源和特定的提取條件,活性成分的相對產率可能變化,其可以被用於控制所得提取物的組成。例如,基於玉米的DDGS類胡蘿蔔素含量通常高於基於小麥的DDGS。
本發明的方法能夠有效回收活性成分。特定成分的實際回收率取決於諸如生物質來源,溶劑選擇,與生物質的比率,溫度和提取時間等因素。該方法可以設計為適於提取一種或多種特定活性成分或類別的化合物。
在某些實施方案中,維生素的回收產率為1%或更高,例如約20%至95%,優選約50%至95%,更優選約70%至約95%,最優選約90%至約100%。
在某些實施方案中,類胡蘿蔔素的回收產率為1%或更高,例如約20%至95%,優選約50%至95%,更優選約70%至約95%,以及最優選約90%至約100%。
在某些實施方案中,親脂性酚類的回收產率為1%或更高,例如約20%至95%,優選約50%至95%,更優選約70%至約95%和最優選約90%至約100%。
該方法還可以設計為適於提取特定組合的活性成分或化合物類別。在某些實施方案中,例如,該方法實現維生素的回收產率為60%或更高,類胡蘿蔔素的收率為60%或更高,親脂性酚類的收率為60%或更高。在某些實施方案中,該方法實現維生素的回收產率為60%或更高,類胡蘿蔔素的收率為60%或更高,親脂性酚類的收率為60%或更高。在某些實施方案中,例如,該方法實現維生素的回收產率為90%或更高,類胡蘿蔔素的收率為90%或更高,以及親脂酚醛樹脂的收率為90%或更高。
本發明的方法可以包括例如為了使生物質更適合於特定的提取和/或分離技術的預處理步驟。例如,可以將生物質原料(例如DDGS)研磨至期望的顆粒狀態,優選研磨至適合於高效和有效的提取,並適合過濾和/或離心分離的水平。其它預處理技術包括例如切割,研磨,壓制,剪切和切碎。
應注意,對於某些應用,對所需組合物的提取產物進行重複(例如,第二或第三輪)提取、分離和溶劑移除可能是有益的。重複輪可以與前一輪相同。在一個或多個方面,重複輪也可以不同於前一輪,例如溶劑的選擇和量,提取時間,殘餘生物質分離技術和溶劑的去除。
應注意,儘管該方法通常可以通過不同規模(例如,從約5Kg至約20Kg,從約20Kg至約200Kg,每批至少20Kg的生物質,每批至少200Kg生物質,每批至少1,000Kg生物質)的分批法進行,該方法也可以設計為連續法,連續或周期性地補充生物質原料,連續的提取,分離殘餘和/或去除溶劑。
在另一方面,本發明一般涉及一種組合物,該組合物包含通過本發明公開的方法提取的一種或多種活性成分。
根據生物質的來源,提取條件(例如,溶劑選擇,溶劑與生物質的比率,提取溫度和時間長度),分離方法和溶劑去除,生物質提取物的組成可能變化。因此,可以處理生物質提取物,以產生某些活性成分的組合物。
再一方面,本發明一般涉及生物質提取物,其包括以重量計:約0.01%至約20%的維生素;約0.01%至約20%的類黃酮;約0.01%至約20%的類胡蘿蔔素;約0.01%至約20%的生育酚;約0.01%至約30%的親脂性酚類和約0.01%至約30%的酚酸。
在某些實施方案中,生物質提取物包含按重量計約0.01%至約20%(例如約0.01%至約20%,0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的維生素E和維生素B;約0.01%約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的類黃酮花青素;約0.01%至約20%(例如約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的類胡蘿蔔素、β-胡蘿蔔素和葉黃素;約0.01%至約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的生育酚:包括α-、δ-和γ-生育酚;和約0.01%至約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的親脂性酚類:阿魏酸酯和香豆酸酯。
在某些實施方案中,生物質提取物包含按重量計約0.01%至約20%(例如約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的維生素E和維生素B;約0.01%至約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%%至約10%,約1.0%至約5.0%)的花青素;約0.01%至約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的β-胡蘿蔔素和葉黃素;約0.01%至約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的生育酚:包括α-、δ-和γ-生育酚;和約0.01%至約20%(例如,約0.1%至約20%,約1.0%至約20%,約0.01%至約10%,約0.01%至約5.0%,約0.1%至約10%,約1.0%至約5.0%)的阿魏酸酯和香豆酸酯。
在某些實施方案中,生物質提取物包含按重量計約0.5%至約20%(例如約1.0%至約20%,約5.0%至約20%,約0.5%至約10%,約0.5%至約5.0%,約1.0%至約5.0%)的維生素E和維生素B;約0.5%至約20%(例如,約1.0%至約20%,約5.0%至約20%,約0.5%至約10%,約0.5%至約5.0%,約1.0%至約5.0%)的花青素;約0.5%至約20%(例如,約1.0%至約20%,約5.0%至約20%,約0.5%至約10%,約0.5%至約5.0%,約1.0%至約5.0%)的β-胡蘿蔔素和葉黃素;約0.5%至約20%(例如,約1.0%至約20%,約5.0%至約20%,約0.5%至約10%,約0.5%至約5.0%,約1.0%至約5.0%)的生育酚:包括α-、δ-和γ-生育酚;和約0.5%至約20%(例如,約1.0%至約20%,約5.0%至約20%,約0.5%至約10%,約0.5%至約5.0%,約1.0%至約5.0%)的阿魏酸酯和香豆酸酯。
在某些實施方案中,生物質提取物包含按重量計的:約10%至約20%的維生素E和維生素B;約10%至約20%的花青素;約10%至約20%的β-胡蘿蔔素和葉黃素;約10%至約20%的生育酚:包括α-、δ-和γ-生育酚;和約10%至約20%的阿魏酸酯和香豆酸酯。
再一方面,本發明一般涉及從生物質中提取玉米醇溶蛋白的方法。
又一方面,本發明一般涉及包含通過本發明公開的方法產生的玉米醇溶蛋白的組合物。在某些實施方案中,本發明的組合物包含約1%至約90%(例如,約1%至約80%,約10%至約80%,約20%至約80%,約30%至約80%,約40%至約80%,約50%至約90%,約60%至約90%,約70%至約90%,約80%至約90%)的玉米醇溶蛋白。
又一方面,本發明一般涉及從生物質中提取核苷酸的方法。該方法包括:(a)使生物質與鹼性水溶液接觸,其接觸條件和時間足以將核酸從生物質提取出來,從而產生殘餘生物質和包含提取的核酸的鹼性水相;(b)分離所述殘餘生物質和包含提取的核酸的鹼性水相;(c)處理包含提取的核酸的鹼性水相,以從水相中沉澱核酸;和(d)從水相中分離沉澱的核酸,以得到包含核酸的提取物組合物。
可以使用任何合適的生物質原料。示例性生物質原料包括植物或基於植物的材料的發酵產物。在某些實施方案中,生物質原料是各種穀物(例如玉米,稻,小麥,大麥和黑麥)的發酵產物。在某些優選的實施方案中,生物質原料是DDGS。在某些優選的實施方案中,生物質原料是由基於玉米的乙醇發酵所產生的DDGS。
在某些實施方案中,生物質可以包括來自植物或基於植物材料的發酵產物的醇提取的廢生物質材料,例如,來自穀物酒精發酵產物的醇提取的廢生物質材料,所述穀物選自玉米,水稻,小麥,大麥和黑麥。在某些實施方案中,生物質可以包括由具有可溶物的幹酒糟(DDGS)的醇提取所產生的廢生物質材料。
生物質可以是任何合適的形式,例如通常的具體形式的尺寸為約0.5μm至約10mm(例如,約0.5μm至約8mm,約0.5μm至約6mm,約0.5μm至約5mm,約0.5μm至約2mm,約0.5μm至約1mm,約1μm至約10mm,約10μm至約10mm,約50μm至約10mm,約1mm至約10mm)。
鹼性水溶液可以具有任何合適的大於7的pH,例如約8至約11。在某些實施方案中,鹼性水溶液的pH為約8至約9.5(例如,約8.0,8.2,8.4,8.6,8.8,9.0,9.2,9.4)。在某些實施方案中,鹼性水溶液的pH為約9.5至約11(例如,約9.6,9.8,10.0,10.2,10.4,10.6,10.8)。
鹼性水溶液可以包含任何合適的溶質以實現所需的鹼性條件。例如,溶質可以選自鹼,諸如氨,碳酸鈉,氫氧化鈉和氫氧化鉀。
鹼性水溶液與生物質的重量比可以是任何合適的比例,例如約1:1至約20:1(例如,約1:1至約15:1,約1:1至約12:1,約1:1至約10:1,約1:1至約8:1,約2:1至約20:1,約5:1至約20:1,約8:1至約20:1,約10:1至約20:1,約5:1至約15:1,約5:1至約12:1,約5:1至約10:1,約7:1至約15:1,約7:1至約12:1,約7:1至約9:1)。
對於分離殘餘生物質和包含核酸的液相的步驟,其可以通過任何合適的技術進行,例如通過過濾和/或離心。分離步驟可包括一輪過濾或離心或可包括兩輪或多輪的過濾或離心或其組合。
在某些實施方案中,分離殘餘的生物質和包含核酸的液相,是通過一輪或多輪過濾進行的。
在某些實施方案中,分離殘餘的生物質和包含核酸的液相,是通過一輪或多輪離心分離進行的。
隨後處理包含核酸的鹼性液相,使核酸從液相中沉澱,例如通過向鹼性液相中加入一種或多種有機溶劑(例如乙醇,乙酸乙酯和己烷)。在某些實施方案中,將醇(例如乙醇)加入到鹼性液相中以從液相中沉澱核酸。可以同時或依次加入共-有機溶劑(例如,另一種醇,乙酸乙酯和己烷)。
生物質提取物中回收的核酸可以包括RNA分子、DNA分子或兩者,例如酵母RNA和酵母DNA。
本發明的方法能夠從生物質原料中有效的回收核酸。特定核酸(RNA和DNA)的實際回收率取決於諸如生物質來源,溶劑pH,與生物質的比率,溫度和提取時間等因素。該過程可以設計為適於某些核酸分子的提取,例如,優選回收酵母RNA分子。
在某些實施方案中,該方法實現了對提取前的生物質中的核酸的10%或更高的回收產率(例如,約10%或更高,約20%或更高,約30%或更高,約40%或更高,約50%或更高,約60%或更高,約70%或更高,約80%或更高,約90%或更高)。
本發明的方法可以包括預處理步驟,例如,以使生物質更適合於特定的提取和/或分離技術。例如,可以將生物質原料(例如DDGS)研磨至期望的顆粒狀態,優選研磨至適合於高效和有效的提取,並適合過濾和/或離心分離的水平。其它預處理技術包括例如切割、研磨、壓制、剪切和切碎。
在某些實施方案中,生物質在與鹼性水溶液接觸之前,經一種或多種有機溶劑預處理。
此外,通過鹼性水溶液對殘餘生物質進行重複(例如,第二或第三輪)提取,分離和溶劑移除可能是有益的,得到所需組合物的提取產物。重複輪可以與前一輪相同。在一個或多個方面,重複輪也可以不同於前一輪,例如溶劑選擇和量,提取時間,殘餘生物質分離技術和溶劑的去除。
應注意,儘管該方法通常可以通過不同規模(例如,每批至少5Kg的生物質,每批至少50Kg的生物質,每批至少500Kg生物質)的分批法進行,該方法可以設計為連續法,連續或周期性地補充生物質原料,連續的提取,分離殘餘和/或去除溶劑。
又一方面,本發明一般涉及一種組合物,該組合物包含通過本發明公開的方法產生的核酸。
在生物質提取物的某些實施方案中,所述組合物包含按重量計約0.1%至約90%(例如約0.1%至約80%,約10%至約80%,約20%至約80%,約30%至約80%,約40%至約80%,約50%至約90%,約60%至約90%,約70%至約90%,約80%至約90%)的酵母RNA。在生物質提取物的某些實施方案中,所述組合物還包含約0.1%至約60%(例如約10%至約60%,約20%至約60%,約30%至約60%,約40%至約60%,約50%至約60%,約0.1%至約50%,約0.1%至約40%,約0.1%至約30%,約0.1%至約20%,約0.1%至約10%,小於10%,小於5%)的酵母DNA。
在某些實施方案中,酵母RNA與酵母DNA的重量比為約5:1至約20:1(例如,約5:1至約15:1,約5:1至約12:1,約5:1至約10:1,約5:1至約8:1,約8:1至約20:1,約10:1至約20:1,約12:1至約20:1,約15:1至約20:1,約6:1至約12:1,約7:1至約10:1)。
核酸的粗提取物可經進一步處理,使之轉化為核苷酸和/或根據需要進一步轉化。
在某些實施方案中,本發明的方法進一步包括:酶水解分離的核酸以產生5'-核苷酸單磷酸(MP)單體的混合物,所述5'-核苷酸單磷酸(MP)單體選自GMP、UMP、AMP和CMP。
又一方面,本發明一般涉及一種組合物,該組合物包含通過本發明的方法產生的5'-核苷酸單磷酸單體。
又一方面,本發明一般涉及生物質提取物,其包含以重量計的:約0.1%至約50%的GMP;約0.1%至約50%的UMP;和約0.1%至約50%的CMP。
在某些實施方案中,產生的玉米醇溶蛋白與來自商業來源或提取自玉米的玉米醇溶蛋白相似或基本相同。
實施例
實施例1.從DDSG中提取核酸
從DDSG中提取核酸(方法1)
稱量DDGS(100.0g)並將之置於藍色蓋帽瓶中。向固體中加入氯化鈉溶液(8%,300mL),將混合物加熱至90℃,保持2小時。將所得漿液快速冷卻至10℃並過濾。用鹽酸將濾液調節至pH2.5。將溶液在4℃冰箱保存12小時,以沉澱RNA。然後將溶液離心,用無水乙醇(50mL)洗滌沉澱兩次。將殘餘物溶於去離子水(50mL)中並過濾。通過UV-VIS光譜測量濾液。結果顯示於圖3中,根據260nm處的吸光度值估算核酸濃度,並顯示於表1中。
表1.酒糟生物質核酸含量估算
·根據260nm處的吸光度值估算(一個吸光度單位相當於40μg/mL.)
從DDSG中提取核酸(稀釋法)
在燒瓶(250mL)中,加入水(180mL),氫氧化鈉(2.0g)和DDGS(20g)。將所得漿液攪拌30分鐘,用鹽酸(6.0M)將pH調節至中性(7.0)再攪拌10分鐘。然後將混合物加熱至90℃10分鐘,冷卻至室溫,然後在4℃冰箱中過夜。將漿液以3500RPM離心,並傾析上清液。將上清液用鹽酸(6M)酸化至pH 2.50並在4℃下保持過夜。將所得混合物以6000RPM離心,將沉澱物合併,用乙醇(95%,10mL)洗滌三次。將固體(粗核酸)溶解在1升蒸餾水中。測量260nm處的吸光度為0.093。基於該值,DDGS中的RNA的百分比估算為0.020%。
從DDSG中提取RNA(鹽水法)
在燒瓶(250mL)中,加入水(180mL),氯化鈉(20g)和DDGS(20g)。然後將混合物加熱至95℃2小時,冷卻至室溫,然後將其置於4℃過夜。將漿液以3500RPM離心,並傾析上清液。將上清液用鹽酸(6M)酸化至pH 2.50並在4℃下保持過夜。將所得混合物以6000RPM離心,將沉澱物合併,用乙醇(95%,10mL)洗滌三次。將固體(粗核酸)溶解在1升蒸餾水中。測量260nm處的吸光度為0.295。基於該值,DDGS中的RNA的百分比估算為0.059%。
乙醇脫脂後從DDSG中提取RNA
在燒瓶(250mL)中加入乙醇(95%,100mL)和DDGS(20g),攪拌30分鐘。將混合物過濾,將殘餘物置於燒瓶中,並與氯化鈉(20g)和水(180mL)混合。然後將混合物加熱至95℃2小時,冷卻至室溫,然後在4℃下保持過夜。將漿液以3500RPM離心,並傾析上清液。將上清液用鹽酸(6M)酸化至pH 2.50並在4℃下保持過夜。將所得混合物以6000RPM離心,將沉澱物合併,用乙醇(95%,10mL)洗滌三次。將固體(粗核酸)溶解在1升蒸餾水中。測量260nm處的吸光度為0.320。基於該值,DDGS中的RNA的百分比估算為0.064%。
核酸至核苷酸的水解:將來自DDGS的RNA提取物(10mg,獲取自先前工序的00106段)與水(10mL)和來自青黴菌(Penicilliumcitrinum)凍乾粉末(DDGS核酸的重量的0.2%)的核酸酶P1混合。將混合物調節至pH5.0,並在60℃下加熱8小時。將所得溶液在90℃加熱15分鐘以使核酸酶P1失活。將所得溶液進行HPLC分析(核苷酸),結果顯示溶液中的GMP濃度為10mg/L,AMP的濃度為5.5mg/L。
實施例2.DDGS的連續提取(5kg級)至不同級分中(方法1)
在該實施例中,進行5kg級的DDGS的連續提取,包括:油(乙酸乙酯和乙醇1:1混合物)→玉米醇溶蛋白(70%乙醇)→核苷酸(水和5'磷酸二酯酶)->廢DDGS,詳情如本發明記載。
用生物活性物質提取油
向具有加熱夾套的20L反應器中加入無水乙醇(7.5L)和乙酸乙酯(7.5L),並攪拌混合。向混合物中加入DDGS(5Kg)並從室溫加熱至60℃,約需45分鐘。將混合物保持在60℃下,攪拌1小時並冷卻。30分鐘後,溫度達到30℃。將混合物傾析並離心。通過旋轉蒸發器將濾液中的溶劑回收(12.6L,84%),得到729.4克油狀物。將殘餘物置於反應器中,並與乙酸乙酯和乙醇混合物(1:1,15L)混合。45分鐘後將混合物加熱至60℃,並在該溫度下保持攪拌1小時。30分鐘後將混合物冷卻至30℃,傾析漿液並過濾。將來自濾液的溶劑回收(12.7L,85%),得到179.2g油狀物。具有生物活性物質的油的總產率為908.6g(18.2%)。殘餘物將用於進一步提取。
分析:油溶液的HPLC在與光電二極體陣列檢測器(PDA)(Waters 2996)和自動進樣器(Waters 717plus)偶聯的Waters 2695HPLC系統上進行。HPLC柱為250×4.6mm,5μmRP C18柱(Waters,Atlantis T3)。流動相由A(0.04%乙酸的去離子水溶液)和B(0.04%乙酸的甲醇溶液)組成。HPLC分離的梯度程序顯示在表2中。
表2.色譜分離的梯度程序
酚酸(香草酸、咖啡酸、對香豆酸和阿魏酸),葉黃素和α-生育酚的鑑定是基於比較各化合物的保留時間和紫外吸光度。關鍵化合物的濃度為:香草酸8.74mg/100g油);咖啡酸,8.68mg/100g油;對-香豆酸,14.49mg/100g油;阿魏酸,16.38mg/100g油;葉黃素,31.62mg/100g油;α-生育酚,40.12mg/100g油。典型的HPLC指紋圖如圖4所示。
玉米醇溶蛋白
將具有生物活性物質(自上面)的油提取的殘餘物置於20L反應器中,並與70%乙醇(15L)混合併加熱至60℃,需50分鐘將溫度升至60℃。將漿液攪拌1小時,35分鐘後冷卻至30℃。傾析漿液並離心。通過旋轉蒸發器(12.4L,乙醇濃度75%)回收濾液中的溶劑。將殘餘物在真空中乾燥12小時,得到348.4g固體。將殘餘物置於20L反應器中,並與70%乙醇(15L)混合。將混合物在50分鐘內加熱至60℃,並在該溫度下保持攪拌1小時。將混合物在35分鐘內冷卻至30℃,然後傾析並離心。將濾液進行旋轉蒸發以回收溶劑(12.4L,75%乙醇),在60℃真空烘箱中乾燥10小時後得到203.5g固體。玉米醇溶蛋白的總產量為551.7g(11%)。
從DDGS提取的玉米醇溶蛋白與商業玉米醇溶蛋白及來自玉米的玉米醇溶蛋白表達譜的分析方法。玉米醇溶蛋白的電泳採用來自Bio-rad公司(Hercules,California,USA)的電泳儀進行。在Paraman的SDS-PAGE方法(Paraman,I.;Lamsal,B.P.,從玉米發酵副產物中回收和表徵α-玉米醇溶蛋白。農業與食品化學雜誌2011,59,3071.)之後,在SDS-Tris-甘氨酸緩衝液系統中用4%堆積凝膠和12%分離凝膠顯示提取的玉米醇溶蛋白的分子量分布。簡言之,通過樣品緩衝液:pH7.0的125mM Tris-HCl,2%SDS,10%甘油,5%2-巰基乙醇和0.05%溴酚藍將玉米醇溶蛋白溶液稀釋至10g/L。將蛋白質溶液離心以除去沉澱,將15μL溶液加載到凝膠上。在200V下進行電泳60分鐘。凝膠用0.1%考馬斯亮藍溶液染色。使用範圍為10至200kDa的Bio-rad分子量標記(Hercules,California,USA)。玉米醇溶蛋白的選擇性圖像顯示在圖5中。從圖5可以看出,DDGS玉米醇溶蛋白與商業玉米醇溶蛋白及來自玉米的玉米醇溶蛋白相當。
核苷酸
在20L反應器中,將來自玉米醇溶蛋白提取的殘餘物(自上面)與水(15L)混合,並加熱至60℃,然後加入50g 5-磷酸二酯酶(來自青黴菌來源的核酸酶P1,50g)。將混合物在60℃下攪拌24小時,並在30分鐘內冷卻至40℃。將漿液以3000r/min離心5分鐘。將濾液(約13升)再次過濾以除去少量的白色沉澱。將所得澄清濾液噴霧乾燥。乾燥過程約需12小時,得到核苷酸級分,淡黃色粉末288克(5.6%)。
核苷酸含量的分析:HPLC在與光電二極體陣列檢測器(PDA)(Waters 2996)和自動進樣器(Waters 717plus)偶聯的Waters 2695HPLC系統上進行。固定相是HPLC柱,為250×4.6mm,5μmC18柱(Atlantis,Waters)。流動相A(K2HPO4,0.1M,pH=5.6)是通過將13.6g K2HPO4溶解在1000mL去離子水中,並用2M KOH溶液調節pH至5.6而製備。流動相B為100%甲醇。溶劑梯度序列示於表3中。核苷酸提取物的HPLC色譜圖示於圖6中。
表3.核苷酸HPLC分析梯度程序
廢DDGS
用少量水洗滌來自核苷酸提取的殘餘物(自上面)。用於洗滌殘餘物的總水量為1.5L。將殘餘物置於烘箱中並在100℃下乾燥2天,得到3.00Kg的廢DDGS固體(產率60%)。
廢DDGS的胺基酸譜的HPLC定量:胺基酸的HPLC分析遵循Waters的標準方法:AccQ·Tag。AccQ·Tag衍生化試劑盒和AccQ·Tag洗脫液A購自Waters(Milford,Massachusetts,USA)。流動相A由50mL AccQ·Tag洗脫液A濃縮物和500mL去離子水組成,流動相B為乙腈,流動相C為去離子水。水解產物通過0.45μm微過濾器過濾得到。衍生化程序遵循Waters:將70μL緩衝液和20μL衍生化試劑加入到10μL水解產物中。將混合物搖動15秒鐘,然後在55℃下放入加熱器中10分鐘。
表4.胺基酸
總胺基酸:78.8mg/g廢DDGS.
總之,產物產率顯示在下表5中。
表5.DDGS煉油廠5公斤級產品的產量
實施例3.DDGS的提取(5kg級)(方法2)
核苷酸
向夾套反應器(20L)中加入水(17L)並以100rpm攪拌,然後加入DDGS(5kg)。混合物相當粘稠。加入DDGS後,通過熱循環器將反應器加熱至60℃,需要35分鐘。向溶液中加入5'-磷酸二酯酶(來自青黴菌的核酸酶P1,50g),並攪拌24小時。將漿液離心,得到混濁濾液,將其再次離心,得到13.7L液體。對液體進行噴霧乾燥,得到740克褐色粘稠固體,其為核苷酸級分。
玉米醇溶蛋白
向夾套反應器中加入乙醇(70%,15L)和來自上述操作的殘餘物,並在60℃下攪拌1小時。溫度冷卻至30℃後,將混合物從反應器中分出並離心分離殘餘物2和濾液。從濾液中蒸發揮發物後,在70℃下真空乾燥10小時後,得到粘稠的固體,產量為297克玉米醇溶蛋白。重複該步驟,多得到213克固體。玉米醇溶蛋白的總產量為511g。
含生物活性物質的油
向夾套反應器(20L)中加入乙酸乙酯和乙醇(1:1)並攪拌。向混合物中加入殘餘物2並加熱至60℃維持1小時。將反應混合物的溫度冷卻至30℃後,將混合物從反應器中分出並離心。收集濾液,並使用相同量的溶劑(20L),乙酸乙酯和乙醇(1:1)再次提取殘餘物,並過濾,得到殘餘物3和濾液。蒸發溶劑後,所得油級分產率為240g。
廢DDGS
將殘餘物3真空乾燥,得到3174g固體,其為廢DDGS(深棕色)。
總共,提取5Kg DDGS,得到:
·3174克廢DDGS(63.5%)
·240克油(4.8%)
·511g玉米醇溶蛋白(11%)
·740克核苷酸(14.8%)
產品的總重量為:4665克(回收率為93.3%)。
實施例4.從DDGS提取的植物化學成分的生物利用度研究
動物研究。三十六隻雄性CD-1小鼠(22-24g)購自Charles River Labs(Wilmington,MA)。在研究之前,讓小鼠在SPF設施中適應至少3天。在Cephrim Biosciences,Inc.(Woburn,MA)的機構動物護理和使用委員會(IACUC)批准的方案或指南下進行動物的飼養,處理和操作。在每個籠子中飼養三隻小鼠。溫度,溼度和光/黑暗循環良好地維持在68-76°F,40-60%相對溼度,具有12小時光/暗循環。允許小鼠自由獲得水和食物。
在研究的第一天,將小鼠隨機分為兩組,即酒精提取物(AE,DDGS)組和油提取物(OE,DDGS)組。將每組小鼠進一步分成6個亞組,代表6個時間點(即0小時,0.5小時,1.0小時,3.0小時,7.0小時和24小時)。通過口服管飼法給每組小鼠兩個提取物中的每一個,劑量為AE 2mL,OE 2mL。給藥時間設定為零時間。通過心臟穿刺收集血液樣品,並立即轉移到一組肝素化管中。
在給藥前立即收集在時間0小時的血樣。在其餘5個時間點的每個時間點,提取物給藥後的時間-0.5hr,-1.0hr,-3.0hr,-7.0hr和-24hr,從每個亞組(n=3)收集血液樣品。將所有血液樣品在收集後置於冰上,並以14000rpm/min旋轉。將頂部血漿轉移到新的預標記的管中,並將樣品儲存在-70℃直到分析。
血漿中生育酚和類胡蘿蔔素的測定。將小鼠血漿(150μL)與600μL己烷混合,並以200rpm振蕩10分鐘。將混合物在14,000rpm離心6分鐘。將上清液在氮氣下蒸發至幹,並用100μL甲醇替換。然後將提取物在14,000rpm離心5分鐘,並注入HPLC。
生育酚的HPLC條件:在C30反相柱(250×4.6mm,5μm)上以1mL/min的流速分離化合物。使用甲醇作為流動相。將柱保持在6℃。總運行時間為35分鐘。在螢光檢測器中進行檢測,激發波長292nm,發射波長336nm。
類胡蘿蔔素的HPLC條件:在DeveloshR水性C30反相柱(250×4.6mm,5μm)上以1mL/min的流速分離化合物。使用雙溶劑梯度系統完成HPLC分離。流動相由A)甲醇:MTBE:1%乙酸銨(83:15:2,V/V/V)和B)甲醇:MTBE:1%乙酸銨(8:90:2,V/V/V)。將柱保持在16℃。總運行時間為36分鐘(運行後5分鐘)。在450nm檢測。
血漿中酚類物質的測定。將小鼠血漿(200μL)與12μL10%抗壞血酸-40mM KH2PO4-0.1%EDTA,30μl 50mM磷酸鉀(pH 7.4),350單位來自大腸桿菌的X-A型β-d-葡萄糖醛酸酶(Sigma Chemical Co,St.Louis,MO,USA)和6單位來自鮑魚腸內的硫酸酯酶VIII型(Sigma Chemical Co,St.Louis,MO,USA)。將混合物在37℃下孵育45分鐘。通過加入2mL乙酸乙酯,然後劇烈搖動20分鐘並在4℃下以2000×g離心5分鐘來終止反應。將上清液轉移到乾淨的管中,並重複乙酸乙酯提取。將10μL的0.02%抗壞血酸:0.005%EDTA加入到合併的上清液部分中,並充分渦旋混合。然後將上清液在氮氣下在室溫下蒸發至幹。將樣品在100μL甲醇中重構,充分渦旋,超聲處理10分鐘,並離心(14,000rpm,5分鐘)。
酚的HPLC條件:在Phenomenex C18苯基-己基柱(250×4.6mm,5μm)上以1mL/min的流速分離化合物。使用雙溶劑梯度系統完成HPLC分離。流動相由A)水:乙酸:乙腈(89:2:9,v/v/v),加入10mM PBS(pH 3.4)及B)80%乙腈(v/v),加入1mM PBS(pH 5)組成。將柱保持在20℃。總運行時間為50分鐘(運行後5分鐘)。使用具有500和800mV的電位設置的ESA 5600CoulArrray電化學檢測器實現檢測。
生物利用度測試的結果在圖7-9中顯示。圖7顯示在胃輸注7小時後發現小鼠血漿中類胡蘿蔔素的最大吸收。如圖8所示,在胃輸注3小時後發現小鼠血漿中γ-和α-生育酚的最大吸收,而在胃輸注24小時後發現小鼠血漿中δ-生育三烯酚的最大吸收。圖9顯示在胃輸注後0.5小時發現小鼠血漿中酚類物質的最大吸收。如在該小鼠研究中所證明的,DDGS中鑑定的植物化學物質是生物可利用的。
在本說明書和所附權利要求中,除非上下文另有明確規定,否則單數形式「一」,「一個」和「該」包括複數引用。除非另有定義,本文使用的所有技術和科學術語具有與本領域普通技術人員通常理解的相同的含義。除了所公開的特定順序之外,本文所述的方法可以以邏輯上可能的任何順序進行。
通過引用併入
本發明提出了對其他文檔的引用和引證,例如專利,專利申請,專利出版物,期刊,書籍,論文,網頁內容。所有這些文獻為了所有目的通過引用整體併入本文。通過引用併入本文中但與本文中明確闡述的現有定義,陳述或其他公開材料相衝突的任何材料,僅被認為其未與本公開衝突的部分被併入。在衝突的情況下,衝突以有利於作為優選公開的本公開來解決。
等同
代表性實施例旨在幫助說明本發明,而且並非旨在,也不應解釋為限制本發明的範圍。實際上,除了本文所示和所述的那些之外,本發明的各種修改和其許多進一步的實施方案,對於本領域技術人員來說,根據本文獻的全部內容,包括實施例和對科學和專利的參考文獻。實施例包含可以在其各種實施方案及其等同物中適應於本發明的實踐的重要的附加信息、示例和指導。
