一種穩態進動梯度多回波水脂分離成像方法與流程
2023-09-27 06:38:45 1
本發明涉及核磁成像技術領域,尤其涉及一種穩態進動梯度多回波水脂分離成像方法。
背景技術:
化學位移成像是目前最有效的磁共振壓脂成像技術之一,在四肢關節診斷上應用較多,但對於腹部等運動器官,這類壓脂技術的臨床應用常常由於運動偽影幹擾而受到限制。掃描加速技術開發一直是臨床mri學術研究和商業化應用的一個重要方向,這不僅有利於提高mri成像技術的臨床檢查效率也有利於克服運動偽影幹擾。迄今為止,多種通用的掃描加速技術,例如,並行採集、半傅立葉採集和壓縮感知採集,已在臨床上獲得應用,但仍不足以充分滿足腹部和心肺快速成像和實時成像的需要,具有快速和超快速掃描特徵的特殊成像方法(包括序列和算法)的開發一直是磁共振領域前沿研究熱點之一,這類特殊成像方法與通用加速技術的結合有望提高磁共振掃描的時間解析度達到秒級甚至毫秒級。其中,穩態進動成像方法是在保持高信噪比的同時實現快速掃描的一種十分有效的方法,儘管這種方法對序列設計要求和系統質量控制要求明顯偏高。臨床上已實現常規應用的穩態進動序列通常是在一個序列重複周期內每層僅激發並採集一個梯度回波,通過空間編碼和圖像重建得到一幅圖像,主要用於腹部水成像和心臟電影。實際上,穩態進動序列可以在一個序列重複周期內通過序列重複時間(tr)和回波時間(te)參數控制以及相位循環或頻移等方式進行選擇性激發並採集不同的回波組份,人們可以利用這個技術特徵將穩態進動成像方法與化學位移相位編碼技術結合應用以便實現快速水脂分離成像。
在近幾年主要有三個版本的穩態進動水脂分離成像方法在史丹福大學等歐美實驗室環境初步開發成功,其中一個版本是,基於水和脂肪的共振頻率差值δf設置穩態進動序列的回波時間分別為te、te+1/δf/n和te+1/δf/n(n為任意正整數),進行三次獨立的掃描得到三幅圖像,然後通過最小二乘法擬合得到水像和脂肪像,掃描時間比常規穩態進動掃描要延長三倍;第二個版本是,每次掃描採用不同的te和tr參數值並在6次射頻脈衝相位循環條件下逐個檢測每個回波組份,其中第一個回波的實部和虛部的相位差需要精確控制為90度,這種掃描方式對脈衝翻轉角、射頻相位和偏共振效應很敏感,在實際臨床環境下掃描時間較長,並且實現不同回波組份分離的te和tr的合理選擇存在較大難度;第三個版本是,將兩點dixon水脂分離技術與穩態進動技術相結合,基於雙極性頻率編碼梯度在一個序列周期內同時檢測兩個回波,一個為同相水脂信號,另一個為反相水脂信號,然後基於傳統的兩點dixon圖像重建方法進行水脂信號歸屬,但水脂交界處可能存在水脂信號歸屬誤差,主要適用於高場胰膽管水成像。此外,上述方法基本上沒有考慮渦流效應、剩磁效應和回波時間較長可能引起的相位纏繞問題,在各種型號的mri設備上不具有普遍適用性。
技術實現要素:
為了充分滿足快速成像和精準診斷的需要,本發明提供了一種基於一次激發三點直接相位編碼的穩態進動水脂分離成像方法和掃描校準技術。
本發明提供了一種穩態進動梯度多回波水脂分離成像方法,以磁共振成像系統上常規掃描用的穩態進動成像序列為基礎,射頻脈衝每間隔一個10ms量級或更小短周期tr就重複激發成像區域,脈衝翻轉角在第一個序列重複周期內設置為+α/2並取消採樣期,在後續序列重複周期內脈衝翻轉角交替設置為+α和-α,同時通過選層梯度、相位編碼梯度和頻率編碼梯度進行三維空間編碼,每個方位的梯度積分面積之和為零,使得質子磁化矢量進動趨於穩態,在每個tr期間磁化矢量在三個或兩個正負極性交替的頻率編碼梯度作用下形成三個或兩個梯度回波,頻率編碼方向的梯度積分面積之和為零,並基於回波峰間隔時間和水脂化學位移差值對三個或兩個回波進行直接相位編碼。
優選的,直接相位編碼方法的有效回波時間te設置為最小值或水脂同相位時間,序列重複時間設置為tr=2te+2δτ,δτ設置為1/δf/n,n優選為3或4,且tr不小於其最小值,te不小於其最小值,tr最小值和te最小值估算包括射頻脈衝響應延遲、梯度脈衝響應延遲、接收機響應延遲和梯度方位矩陣運算時間以及序列指令執行時間的精確測定值。
優選的,信號調試方法採用下述方案進行回波信號優化:
(1)關閉相位編碼梯度,在實時調試模式下運行成像序列,採集水模的質子
回波信號並顯示幅值;
(2)先在採樣窗第一個讀梯度施加條件下調整序列周期tr和回波時間te
得到一個梯度回波並優化信號幅度和對稱性;
(3)再在第一個至第二個乃至第三個讀梯度施加條件下調整梯度幅度gr1
直到各回波組份分離開且回波峰等距。
優選的,其信號調試方法在掃描模式下採集k空間線,累加多次並保存為一維復矩陣,按採樣數據點數dim1分離為兩個復矩陣k1和k2或三個復矩陣k1,k2和k3,選取k1和k2*信噪比較高的數據點並計算各自的相位均值和及二者差值δφ。
優選的,數據採集處理方法是將人體掃描k空間數據沿選層方向進行一維離散逆傅立葉變換,得到每個層面的k空間矩陣,再沿頻率編碼方向按採樣點數將k空間矩陣分離為兩個復矩陣i0和i1或三個復矩陣i0,i1和i2並將i1進行時間反演和矩陣共軛後乘以e-iδφ進行初級相位校正以消除剩磁和渦流等效應引起的相位誤差。
優選的,數據採集處理方法是在正交接收或多通道接收模式下,信號合成在圖像域且在水脂分離之前按下述方式進行:
這裡表示通道i接收的層面j的k空間數據(i0,i1或i2)的二維逆傅立葉變換,ai和δφi分別是通道i的靈敏度權重因子和相移,這兩個參數通過標定方案測定。
優選的,在不對稱回波相位編碼情況下基於下式
對圖像域複數矩陣採用最小二乘法擬合分析得到水像和脂肪像,這裡上標r和i分別表示複數的實部和虛部;或者,在場強足夠高(一般在1.5t至11.7t)而適用對稱回波相位編碼的情況下,在穩態多回波序列中基於水脂化學位移差(例如3.0t時420hz)設置te=2.4(ms),δτ=1/δf/2=1.2(ms),tr=2·te+2·δτ=7.2(ms),採用常規三點dixon數據處理方式獲得水像和脂肪像。
優選的,最小二乘法擬合分析採用矩陣運算按照式(3)和式(4),即,和進行迭代直到δν<0.5hz,然後對矩陣(νi,j)dim1×dim2的各邊緣擴充k行/列並充零後基於高斯模板進行低通濾波,再用式(3)重新計算水像和脂肪像。
優選的,在中低場mri系統上採用不對稱相位編碼,即π/2和π,通過水模測試基於確定初始相位φ0,然後每幅圖像的像素(i,j)分別乘以以消除人體掃描圖像的初始相位,再從正交相位圖的實部和虛部直接得到水像和脂肪像,同時,通過四象限反正切函數計算反相圖s1'的像素(i,j)的相角φi,j=2πνi,jδτ並基於區域增長法對(φi,j)進行相位解纏,再將s1'的像素(i,j)乘以e-φ(i,j),得到消除了場不均勻效應的反相圖。
有益效果:本發明的成像方法可在保持高信噪比條件下實現秒級時間解析度,並改善水脂分離的精確性,尤其是有助於抑制腹部水脂分離成像的運動偽影,不僅適用於高場成像系統也適用於中低場成像系統。
附圖說明
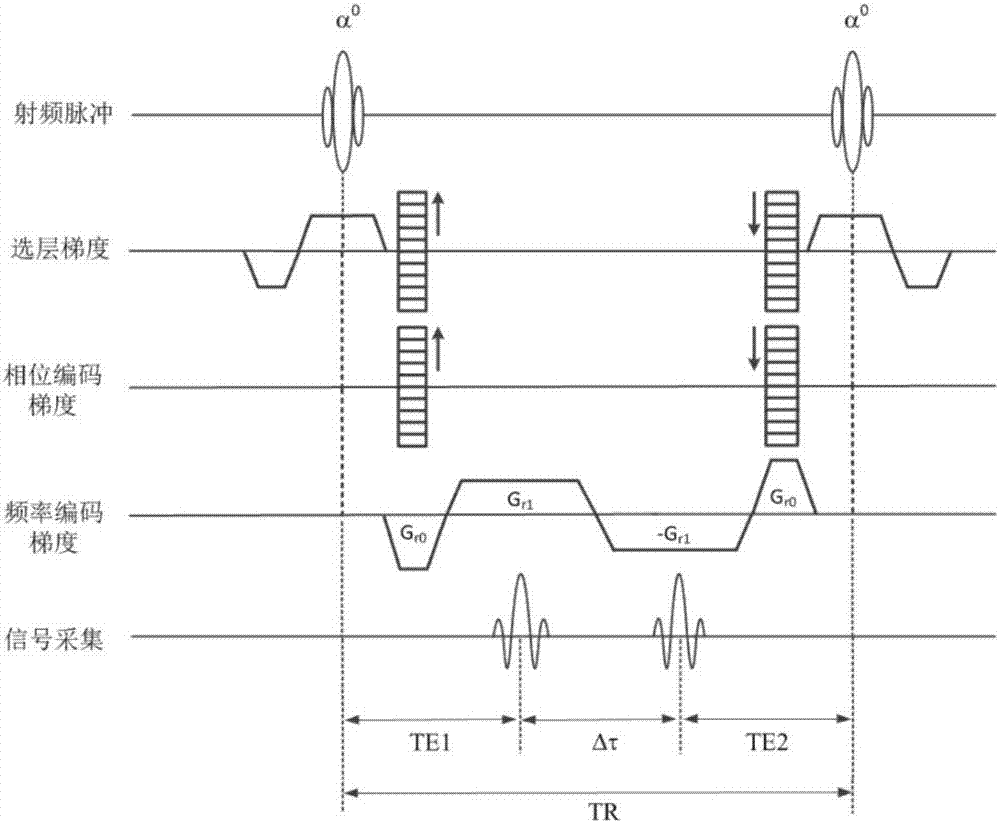
圖1為基於單次激發三點相位編碼的三維穩態進動水脂分離序列。其中,te是回波時間,δτ是相鄰回波的峰值之間的時間間隔,gr0是預備讀梯度,gr1是二維平面頻率編碼梯度。
圖2為基於單次激發兩點相位編碼的三維穩態進動水脂分離序列。其中,te是回波時間,δτ是相鄰回波的峰值之間的時間間隔,gr0是預備讀梯度,gr1是二維平面頻率編碼梯度。
圖3為基於單次激發三點相位編碼的二維穩態進動水脂分離序列。其中,te是回波時間,δτ是相鄰回波的峰值之間的時間間隔,gr0是預備讀梯度,gr1是二維平面頻率編碼梯度。
圖4為基於單次激發兩點相位編碼的二維穩態進動水脂分離序列。
其中,te是回波時間,δτ是相鄰回波的峰值之間的時間間隔,gr0是預備讀梯度,gr1是二維平面頻率編碼梯度。
圖5為本發明成像序列調試方案
圖6為本發明多通道信號合成參數標定方案。
具體實施方式
為使本發明解決的技術問題、採用的技術方案和達到的技術效果更加清楚,下面結合附圖和實施例對本發明作進一步的詳細說明。可以理解的是,此處所描述的具體實施例僅僅用於解釋本發明,而非對本發明的限定。另外還需要說明的是,為了便於描述,附圖中僅示出了與本發明相關的部分而非全部內容。
本發明的一種穩態進動梯度多回波水脂分離成像方法,是由多回波水脂分離序列、信號調試模塊、數據採集處理模塊和水脂分離模塊構成。其中,成像序列以磁共振成像系統上常規掃描的真穩態進動成像序列為基礎,在10ms量級或更短的序列重複周期內射頻脈衝反覆激發成像區的質子磁共振信號,脈衝翻轉角在第一個序列重複周期內設置為+α/2並取消採樣期,在後續序列重複周期內脈衝翻轉角交替設置為+α和-α,同時通過選層梯度、相位編碼梯度和頻率編碼梯度進行三維空間編碼,每個方位的梯度積分面積之和為零,使得質子磁化矢量進動趨於穩態,其特徵在於,採樣期施加三個(或兩個)極性交替的頻率編碼梯度,且頻率編碼方向的梯度總積分面積為零,使得質子磁化矢量進動達到完全穩態後產生三個(或兩個)高信噪比的梯度回波信號,並基於相鄰回波峰的時間間隔δτ和水脂化學位移差δf對梯度回波進行直接相位編碼,在序列參數表中設置δτ為1/δf/n,n優先為3(或4),並設置序列重複時間tr=2·te+2·δτ(或tr=te1+te2+δτ),其中te、te1和te2為回波時間,取最小值或設置為1/δf;並且,為了充分抑制場不均勻性效應,在序列執行過程中精確測試射頻系統和梯度系統的響應延遲時間、接收機採樣延遲時間、梯度矩陣的運算時間和其它序列指令執行時間,然後在序列內精確設置最小回波時間temin和最小序列重複時間trmin,且te≧temin,tr≧trmin,序列重複執行直到磁化矢量進動達到穩態後開始採樣,在每個採樣期內磁化矢量在極性正負交替的多個(這裡優先為三個或兩個)頻率編碼梯度作用下形成多個梯度回波,回波時間依次為t1=te,t2=te+δτ,t3=te+2·δτ(或t1=te1,t2=te1+δτ),採用正交採集或多通道並行採集模式接收信號並數位化;尤其是,為了克服渦流場效應、麥克斯韋場效應和回波時間較長可能引起的相位纏繞問題,成像系統通過一個專用的信號調試模塊在相位編碼梯度關閉條件下調用上述成像序列對標準水模進行參考掃描,先在一個讀梯度施加條件下調整tr和te(或te1、te2)進行單個梯度回波信號幅度和對稱性優化,再在極性交替的三個(或兩個)讀梯度施加條件下調整gr0和gr1梯度幅度直到產生多個梯度回波組份,回波峰兩兩之間等距且δτ=1/δf/n,將參數調試結果保存到參數表,同時保存回波信號以計算雙極性梯度作用下相鄰梯度回波的相位差δφ=-並通過itoh算法進行相位解纏,接著,成像系統通過掃描模塊調用上述成像序列和參數表進行油水混合物標樣或人體掃描並存貯k空間數據,隨後數據採集處理模塊將k空間數據沿選層方向進行一維離散逆傅立葉變換,得到每個層面的k空間矩陣,按化學位移編碼數(一般為3或2)將k空間矩陣在頻率編碼方向一分為三或一分為二,得到三組復矩陣i0、i1和i2(或兩組復矩陣i0和i1),再將i1進行時間反演和矩陣共軛後乘以e-iδφ進行初級相位校正,最後,成像系統通過水脂分離模塊進行二維離散逆傅立葉變換得到三幅圖像s0、s1和s2(或兩幅圖像s0和s1),在單次激發三回波情況下水脂分離模塊基於下式進行最小二乘法迭代擬合,消除場不均勻性導致的相位誤差並得到水像和脂肪像。
這裡,sj其任一像素對應的磁共振信號,sw和sf分別表示人體組織中水和脂肪的質子磁化矢量的初始值,上標r和i分別表示複數的實部和虛部,下標w和f分別表示水和脂肪,ν表示與磁場不均勻性有關的中心頻率偏差,或者在單次激發雙回波情況下水脂分離模塊基於水模掃描的回波信號計算得到初始相位,再通過複數運算消除人體掃描的正交相位圖s0和反相圖s1的初始相位,所得正交相位圖s'0的實部和虛部即為水像和脂肪像,所得反相圖s1'的相位圖(φi,j)dim1×dim2=2πδτ(νi,j)dim1×dim2進行相位展開後產生場圖(νi,j)dim1×dim2,這裡dim1和dim2分別為頻率編碼數和相位編碼數,然後將s1'乘以e-i·φ得到消除了場不均勻效應的反相圖。
上述成像序列的二維版也可按同樣方式基於水脂化學位移差實現梯度回波直接相位編碼,除序列參數表中設置梯度相位編碼數設置為1以外,按類似方式進行信號調試、數據採集處理和水脂分離得到水像和脂肪像。
實施例1:在1.5tmri系統的序列庫中安裝圖1或圖3所示序列,其中射頻脈衝採用最小相位slr波形,脈寬為1ms或更短,梯度上下沿時間為0.1ms或更短,並在序列參數表中設置頻率編碼數設置為dim1=160,相位編碼數設置為dim2=256,選層方向相位編碼數設置為dim3=32,化學位移相位編碼數設置為dim4=3,視野設置為fov=220mm,接收機帶寬設置為bw=125khz,δτ優選為1/δf/3=1.5ms,每組回波的回波時間依次為t1=4.1ms,t2=5.6ms,t3=7.1ms,相應的回波編碼相位依次為-π/6,π/2和7π/6,並設置te=4.5ms,tr=12ms,δf≈220hz,。然後,在臨床操作軟體中安裝並依次執行信號調試模塊、掃描模塊、數據採集處理模塊和水脂分離模塊,各模塊的設計方式和工作流程說明如下:
信號調試模塊按照圖5所示的調試方案進行序列參數校準,該模塊執行時要求使用標準水模,並關閉相位編碼梯度在實時模式下採集和顯示梯度回波信號。參數校準完畢,將標準水模的回波信號保存為復矩陣k作為參考信號供數據採集處理模塊調用,並將優化的參數值保存到序列參數表。其中,油水混合物標樣測試僅在首次運行本發明的成像序列時需要,用於在臨床掃描前驗證參數校準的精確度。
掃描模塊基於上述優化的序列參數值運行圖1或圖3所示的成像序列,對人體檢查部位進行一次掃描獲得化學位移編碼的k空間數據。
數據採集處理模塊調用參考信號復矩陣k並按dim1=256和dim4=3分離為三個復矩陣k1,k2和k3,選取k1和k2*信噪比較大的數據點並計算各自的相位均值和,然後調用人體掃描數據並沿選層方向進行一維離散逆傅立葉變換,得到32個層面的k空間矩陣(480×256),再按dim1=256和dim4=3將每個層面的k空間矩陣沿頻率編碼方向一分為三,保存為三組大小為dim1×dim2(這裡160×256)的復矩陣,即i0,i1和i2,並將i1進行矩陣共軛轉置後乘以進行初級相位校正,消除剩磁和渦流等效應引起的相位誤差。
最後,水脂分離模塊調用初級相位校正後的三組復矩陣(i0,i1和i2)並進行二維離散逆傅立葉變換(2difft),得到三幅圖像,即,s0=2difft{i0},s1=2difft{i1}和s2=2difft{i2},並對這三幅圖像進行數據分析,有關算法設計說明如下:
對於任一層面j所對應的圖像,其任一像素對應的磁共振信號sj可描述為
這裡,sw和sf分別表示人體組織中水和脂肪的質子自旋密度的初始值,後者分別構成水像和脂肪像的複數矩陣,下標w和f分別表示水和脂肪,tn表示三幅圖像(s0、s1和s2)對應的t1、t2和t3,ν表示場不均勻性或渦流效應引起的頻率偏差。在多通道接收或正交接收模式下,採用並行採集重建方式(例如sense和grappa等)或直接信號合成方式,即表示通道i接收的層面j的磁共振信號,ai和δφi分別是通道i的靈敏度權重因子和相移,通過圖6所示的標定方案測定。由於磁場不均勻性效應,質子共振頻率存在一個偏差ν,它在二維成像平面的分布可用場圖矩陣(νi,j)dim1×dim2表示。考慮到偏差ν是一個可測量,式(1)在消除其效應後可寫為
這裡採用線性最小二乘法擬合求解上述線性方程組,具體步驟如下:
(1)設ν的初始值為ν0=0,按照下式進行水脂信號分析
上式中上標t表示復矩陣轉置,
(2)使用下式計算δν
上式中
(3)計算ν=ν0+δν,將和代入式(3)並更新ν值,重新計算
(4)重複上述步驟直到δν<0.5hz;
(5)建立大小為(2k+1)(2k+1)的高斯模板這裡k=5,i=1,2,…,2·k+1,對矩陣(νi,j)dim1×dim2的各邊緣擴充k行/列並充零,基於上述高斯模板進行低通濾波,再用式(3)重新計算水像和脂肪像;
(6)對於其它層面的圖像數據重複上述所有步驟得到水像和脂肪像。
上述不對稱回波相位編碼和數據處理方式不僅有利於減少穩態進動成像的重複時間tr,也有利於避免水和脂肪含量相當的個別像素出現異常的計算誤差。顯然,如果場強足夠高(例如3.0t),對稱回波相位編碼所要求的δτ很短以至於穩態進動條件易於建立,在這樣的情況下圖一和圖三所示的序列中設置te=2.4(ms),δτ=1/δf/2=1.2(ms),tr=2·te+2·δτ=7.2(ms),水脂分離模塊可採用常規三點dixon數據處理方式獲得水像和脂肪像。
實施例2:
在低場強(例如0.35t)情況下,信號調試模塊和掃描模塊調用圖2或圖4所示的成像序列,參數表中設置te=1/δf/4和δτ=1/δf/4,回波峰的化學位移編碼相位分別為π/2和π,然後按照上述類似方式進行掃描和信號處理,得到正交相位圖s0和反相圖s1,最後水脂分離模塊採用下述方式對這兩幅圖像進行數據處理:
首先,基於計算參考掃描所得水模圖像k的相角φ0(i,j);然後,進行人體掃描得到圖像s0和s1,每幅圖像的像素(i,j)分別乘以得到
s'0=sw+i·sf(7)
s1'=(sw-sf)·ei2πνδτ(8)
於是,水像和脂肪像分別計算為sw=re(s'0),sf=im(s'0),這裡re和im分別表示複數的實部和虛部。最後,通過四象限反正切函數計算s1'的像素(i,j)的相角φi,j=2πνi,jδτ並基於區域增長法對(φi,j)進行相位解纏,再將s1'的像素(i,j)乘以e-φ(i,j),得到消除了場不均勻效應的反相圖。
最後應說明的是:以上各實施例僅用以說明本發明的技術方案,而非對其限制;儘管參照前述各實施例對本發明進行了詳細的說明,本領域的普通技術人員應當理解:其對前述各實施例所記載的技術方案進行修改,或者對其中部分或者全部技術特徵進行等同替換,並不使相應技術方案的本質脫離本發明各實施例技術方案的範圍。
