一種豬圓環病毒2型病毒樣顆粒的純化方法與流程
2023-10-04 07:17:59 1
本發明涉及生物製品純化技術領域,具體涉及一種豬圓環病毒2型病毒樣顆粒的純化方法。
背景技術:
豬圓環病毒(PCV)是目前已知的最小的病毒之一,CAP蛋白是PCV2的主要抗原,能誘導中和抗體的產生。目前,流行病學調查顯示,PCV2已經在世界範圍內廣泛分布,規模化養殖場幾乎沒有血清陰性的豬。自PMWS首次在加拿大爆發至今,全世界五大洲均診斷出PMWS的感染,對大多數養豬國造成了極大的威脅。
由於防治PCV2的重要性,有關PCV2疫苗的製備成為生物製品研發的熱點之一。PCV2亞單位基因工程疫苗通過原核或真核表達系統表達PCV2的結構蛋白CAP,再以此來製備PCV2的病毒樣顆粒(Virus like particles,VLP)。該VLP不含有病毒核酸,卻具有與病毒相似的衣殼結構,能夠作為抗原誘導機體免疫應答,進而產生抗體。目前,對於病毒樣顆粒的純化方案通常是沉澱法、離心法和透析法等,但是存在步驟複雜繁瑣,成本較高,純化效率低等問題。
技術實現要素:
本發明旨在針對現有技術的技術缺陷,提供一種豬圓環病毒2型病毒樣顆粒的純化方法,以解決現有技術中針對病毒樣顆粒的純化方法效率較低的技術問題。
本發明要解決的另一技術問題是現有技術中針對病毒樣顆粒的純化方法在達到所需的純度水平時步驟較為繁瑣。
本發明要解決的再一技術問題是現有技術中針對病毒樣顆粒的純化方法對特定結構的病毒樣顆粒藝針對性不強、純化效果不佳、
為實現以上技術目的,本發明採用以下技術方案:
一種豬圓環病毒2型病毒樣顆粒的純化方法,包括以下步驟:
1)取PCV2病毒培養液,裂解細胞,得到細胞裂解液;
2)取步驟1)所得的細胞裂解液澄清處理,得到病毒澄清液;
3)取步驟2)所得的病毒澄清液濃縮8~12倍,得到病毒濃縮液;
4)取步驟3)所得的病毒濃縮液利用Sepharose 4FF分子篩層析純化系統純化,純化過程中,先通過蠕動泵以1.56πr2ml/min的流速利用0.9~1.1mol/L PBS溶液進行柱平衡至紫外蛋白檢測儀OD280基線平穩,而後取步驟3)所得的病毒濃縮液上樣,上樣結束後利用0.9~1.1mol/L PBS溶液洗脫,收集紫外蛋白檢測儀OD280的第一洗脫峰;
其中r是層析柱半徑,單位是釐米。
作為優選,步驟4)純化之前先用無菌的0.5mol/L的NaOH溶液對Sepharose4FF分子篩層析純化系統進行循環衝洗20~30min,再用無菌1mol/L PBS對其進行循環衝洗,至PH為6.8~7.2。
作為優選,步驟1)具體包括以下操作:取PCV2病毒培養液,反覆凍融3次,固液分離取沉澱,利用PBS溶液洗滌3次,棄去上清,加入細胞裂解液裂解,固液分離取沉澱,加入細胞裂解液重懸浮,而後超聲波處理。
作為優選,步驟1)所述的固液分離均是在4℃條件下以9500r/min的轉速離心20min。
作為優選,步驟1)中所述加入細胞裂解液裂解是:加入4℃預冷的細胞裂解液,用槍頭吹吸混勻後,冰浴20min。
作為優選,步驟1)所述超聲處理是以振幅為25%的超聲波每次處理10s,每兩次處理之間的時間間隔30s,超聲處理的總時間為30min。
作為優選,步驟2)所述澄清處理是利用孔徑為0.5~0.8μm的濾板實現的。
作為優選,步驟2)中,先利用0.5mol/L NaOH溶液浸泡濾板5min,而後用1mol/L無菌PBS溶液洗滌至PH為7.0,再澄清處理步驟1)所得的細胞裂解液。
作為優選,步驟3)中對病毒澄清液的濃縮是利用孔徑為100KD的中空纖維濾膜實現的。
作為優選,步驟3)中先利用0.5mol/L NaOH溶液浸泡中空纖維濾膜20~30min,而後用1mol/L無菌PBS溶液洗滌至PH為7.0,再濃縮處理步驟2)所得的病毒澄清液。
作為優選,以上技術方案中所述PCV2病毒培養液是通過中國專利文獻CN105087606A所披露的方法製備的。
本發明提供了一種豬圓環病毒2型病毒樣顆粒的純化方法,該方法圍繞PCV2病毒樣顆粒的自身特性和其表達系統的特點通過實驗手段開發了全新的純化方法,該方法先綜合利用凍融和超聲處理手段實現細胞的裂解,而後利用濾板模塊去除大量細胞碎片和大分子雜質,獲得無菌澄清液,再利用100kD的中空纖維膜系統將澄清液濃縮,獲得濃縮的病毒抗原溶液,最後利用Sepharose 4FF分子篩層析純化系統以優化的操作條件層析純化。本發明方法密切針對豬圓環病毒2型病毒樣顆粒的特徵設計,尤其適用於重組杆狀病毒PCV2病毒樣顆粒的純化。本發明可以更高效的去除雜質,分離獲得目的蛋白,實現目標抗原的有效回收。
附圖說明
圖1是本發明實施例中豬圓環病毒2型CAP蛋白天然表達基因與修飾後的基因核苷酸序列對照圖;圖中,Optimized字樣代表修飾後的基因序列,Original字樣代表豬圓環病毒2型CAP蛋白天然表達基因序列,二者序列存在差異的部分通過陰影表示。
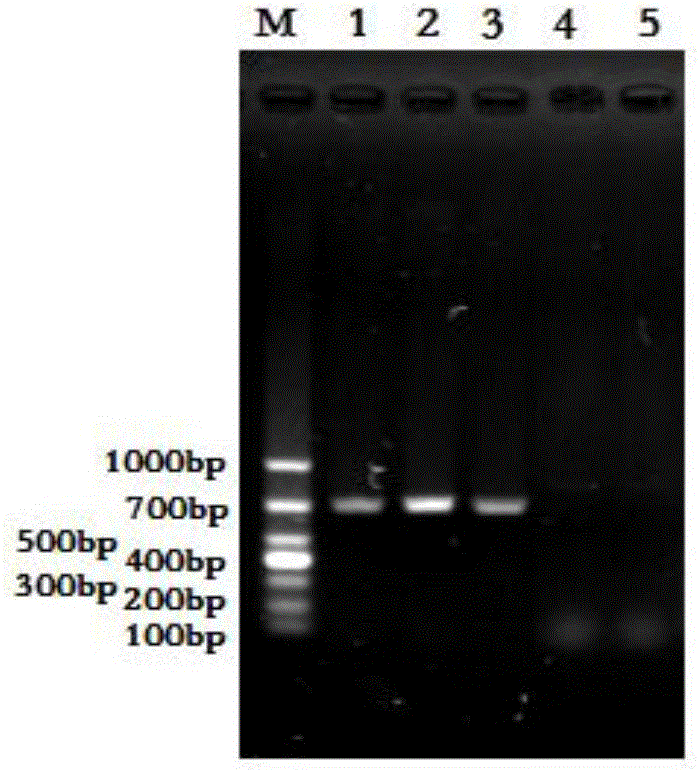
圖2是本發明實施例中重組杆狀病毒pOET3-CAP的PCR結果;圖中,M為DNA分子質量標準,1為PCV2全基因擴增產物,2為重組杆狀病毒pOET3-CAP上清擴增產物,3為重組杆狀病毒pOET3-CAP沉澱擴增產物,4為sf9細胞擴增產物,5為ddH2O擴增產物。
圖3是本發明實施例中表達產物的SDS-PAGE鑑定結果;圖中M為蛋白質分子質量標準,1為重組杆狀病毒上清,2為重組杆狀病毒沉澱。
圖4是本發明實施例中表達產物的Western-Blot鑑定結果;圖中M為蛋白質分子質量標準,1為重組杆狀病毒上清,2為重組杆狀病毒沉澱。
圖5本發明實施例中表達產物的間接免疫螢光鑑定圖;圖中,A為重組杆狀病毒pOET3-CAP感染sf9細胞48h(200×),B為正常sf9細胞培養120h(200×)。
圖6為本發明實施例中表達產物的Capto Core 700層析色譜圖:圖中峰一為目的峰,峰二為雜質峰。
圖7為本發明實施例中表達產物的各純化樣品SDS-PAGE鑑定結果:圖中M為蛋白質分子質量標準,1為PCV2-CAP-P2桿毒(陽性對照),2為PCV2-CAP-P3桿毒70KD過濾液,3為PCV2-CAP-P3桿毒70KD過濾濾膜衝洗液,4為PCV2-CAP-P3桿毒5KD濃縮液,5為PCV2-CAP-P3桿毒5KD過膜包的穿透液。
圖8為本發明實施例中表達產物的各純化樣品Western-Blot鑑定結果:圖中M為蛋白質分子質量標準,1為PCV2-CAP-P2桿毒(陽性對照),2為PCV2-CAP-P3桿毒70KD過濾液,3為PCV2-CAP-P3桿毒70KD過濾濾膜衝洗液,4為PCV2-CAP-P3桿毒5KD濃縮液,5為PCV2-CAP-P3桿毒5KD過膜包的穿透液。
圖9為本發明實施例中表達產物的Sepharose 4FF分子篩層析色譜圖:圖中峰一為目的峰,峰二為雜質峰。
具體實施方式
以下將對本發明的具體實施方式進行詳細描述。為了避免過多不必要的細節,在以下實施例中對屬於公知的結構或功能將不進行詳細描述。
以下實施例中所使用的近似性語言可用於定量表述,表明在不改變基本功能的情況下可允許數量有一定的變動。因此,用「大約」、「左右」等語言所修正的數值不限於該準確數值本身。在一些實施例中,「大約」表示允許其修正的數值在正負百分之十(10%)的範圍內變化,比如,「大約100」表示的可以是90到110之間的任何數值。此外,在「大約第一數值到第二數值」的表述中,大約同時修正第一和第二數值兩個數值。在某些情況下,近似性語言可能與測量儀器的精度有關。
除有定義外,以下實施例中所用的技術和科學術語具有與本發明所屬領域技術人員普遍理解的相同含義。
以下實施例中所用的試驗試劑耗材,如無特殊說明,均為常規生化試劑;所述實驗方法,如無特殊說明,均為常規方法;以下實施例中的定量試驗,均設置三次重複實驗,結果取平均值;以下實施例中的%,如無特別說明,均為質量百分含量。
實施例1人工修飾PCV2CAP基因的重組杆狀病毒的獲得
在保持胺基酸不變的前提下,將密碼子改造為杆狀病毒偏嗜密碼子,提高表達量。進行密碼子優化時,優先選擇昆蟲細胞使用頻率最高的密碼子。以PCV2b分離株CAP基因序列(GenBank No.EU257511.1)為原始模板,根據密碼子的偏愛性人工合成PCV2CAP基因的序列,修飾後的基因序列如SEQ ID NO2所示,修飾前後的基因序列對比情況如附圖1所示。以上修飾前後基因所編碼的胺基酸序列如SEQ ID NO3所示。
人工修飾後的PCV2CAP基因片段克隆至pUC57載體,通過BamHI及XhoI雙酶切,回收大量目的基因,再克隆至杆狀病毒轉移載體pOET3中,構建載體pOET3-PCV2-CAP。將該重組轉移載體轉化至大腸桿菌DH5α感受態細胞,獲得大量pOET3-PCV2-CAP質粒。
按照flashBAC系統操作說明書,在sf9細胞中轉染pOET3-PCV2-CAP質粒,獲得重組杆狀病毒pOET3-PCV2-CAP。
實施例2重組杆狀病毒PCV2的鑑定
1PCR鑑定
提取P1代杆狀病毒DNA(提取步驟按照天根病毒基因組DNA/RNA提取試劑盒說明書進行),用引物PCV2-CAP-S/A經PCR擴增CAP基因,以鑑定外源基因是否整合入重組杆狀病毒基因組中。
2SDS-PAGE檢測Cap蛋白的表達
準備100~200mL的處於對數期的細胞活性良好的sf9細胞,細胞密度2×106cells/mL。無菌接種最多0.5mL的杆狀病毒到細胞中,擴增一般需要4~5天。收穫病毒,3000rmp4℃離心15min,無菌收穫杆毒避光保存於4℃。將收穫的重組杆狀病毒離心,分離上清及沉澱,沉澱用適量體積的PBS重懸,分別上樣。以正常細胞作為空白對照。根據目的蛋白的分子量(目的蛋白大小:27.8KD),配製12%分離膠,進行SDS-PAGE電泳,電泳完成後考馬斯亮藍染色2h~3h,取出,浸入脫色液中脫色至條帶清晰無雜帶。掃圖後分析。
3Western-blot檢測Cap蛋白的表達
將收穫的重組杆狀病毒離心,分離上清及沉澱,沉澱用適量體積的PBS重懸,分別上樣。以正常細胞作為空白對照,然後電泳並轉印。將轉印的硝酸纖維素膜完全浸沒封閉液(5%的脫脂乳)中室溫封閉2h~3h。一抗4℃孵育過夜,PBS洗膜3次。用山羊抗小鼠IgG(H+L)為二抗室溫孵育≤1h。PBST洗膜3次。BSA加到膜上後反應顯影,顯色後觀察結果。
4IFA鑑定
在感染當天,準備細胞密度為5×105cells/ml的細胞懸液,將1mL細胞懸液加入到6孔板中,室溫孵育1h,顯微鏡觀察細胞,sf9細胞應該覆蓋約50%面積。棄去細胞培養上清,將合適稀釋度的病毒液加入6孔板中,孵育1h(或孵育過夜),培養基孵育作為陰性對照。棄去病毒液,每孔中加入2mL培養基,繼續培養。感染後48h(檢測蛋白表達的最佳時段),進行間接免疫螢光。棄去細胞培養上清,每孔加入0.5mL冰甲醇(-20℃)固定10min。棄去固定液,自然乾燥10min,PBS洗三遍,每遍5min。0.1%的Triton室溫孵育10min,PBS洗三遍,每遍5min。5%BSA 37℃封閉30min。棄上清。加入1:1000稀釋的一抗,37℃孵育45min(或4℃孵育過夜),PBS洗三遍,每遍5min。加入1:1000稀釋的二抗(FITC標記的羊抗鼠IgG),37℃孵育≤1h。PBS洗三遍,每遍5min。每孔加入0.5mL PBS,螢光顯微鏡下觀察結果,可以檢測到陽性信號,空白細胞則為陰性。螢光顯微鏡下觀察結果,感染細胞可觀察到強烈的螢光,而正常sf9細胞沒有螢光信號,表明重組杆狀病毒能表達Cap蛋白且具有很好的免疫活性。
實施例3重組杆狀病毒PCV2的純化
一初純
將重組杆狀病毒PCV2毒液9500rpm 4℃離心30min,分離上清,用PBS重懸沉澱,將沉澱反覆凍融3次後用均質機破碎細胞,9500rpm 4℃離心30min,收集上清。調整樣品的PH至7.5,將上清過0.45μm的濾器,濾液用作過柱樣品。
二精細純化
1裝柱:按照說明書推薦比例,在柱高10cm的柱子內裝填10ml Capto Core700填料,約為柱體積一半。
2水洗:用一個柱子體積(1CV)的蒸餾水清洗柱子。流速約為1.6ml/min
3平衡:用至少5CV的緩衝液平衡柱子或等到UV基線、PH和導電性都穩定。
4上樣:裝填不到200ml的樣品過柱。收集每一個流穿峰。
5洗脫:用5到20CV的緩衝液洗柱子。
6清洗:用含有1M NaOH的30%異丙醇或27%丙醇反向清洗柱子。
平衡:用5到20CV的緩衝液平衡柱子或等到UV基線、PH和導電性都達到需要值。
實施例4重組杆狀病毒PCV2的純化
一裂解
將重組杆狀病毒PCV2毒液反覆凍融3次,置於離心管中,9500rpm 4℃離心20min,PBS洗滌3次,棄去上清。在沉澱的細胞泥中加入適量4℃預冷的細胞裂解液,用槍頭吹吸混勻後,冰上作用20min。4℃9500r/min離心20min,棄去上清。加入適量4℃預冷的細胞裂解液,重懸沉澱,然後超聲(振幅25%)處理,每次10s間隔30s,超聲30min。
二澄清
將濾板模塊CH ST110(P)(0.5-0.8μm)裝入簡易裝置中,組裝完畢後用無菌0.5mol/L NaOH溶液對系統進行浸泡處理5min。用無菌1mol/L PBS溶液對系統進行循環衝洗,洗去殘餘的溶液,直至PH為7.0左右。將重組杆狀病毒PCV2CAP毒液通過上述濾板,去除大量細胞碎片和大分子雜質,獲得無菌澄清液。
三濃縮
用無菌0.5mol/L NaOH溶液對100kD中空纖維膜系統進行浸泡處理至少20min。用無菌1mol/L PBS對系統進行循環衝洗,洗去殘餘的溶液,直至PH為7.0左右。取濾板過濾液通過100kD中空纖維膜進行純化處理,將毒液濃縮10倍,分別留存濃縮液及透過液,準備檢測。
四層析純化
用無菌0.5mol/L NaOH溶液對Sepharose 4FF分子篩層析純化系統進行循環衝洗20~30min。用無菌1mol/L PBS對系統進行循環衝洗,洗去殘餘的溶液,直至PH為7.0左右。
將層析柱進液管連接至蠕動泵,出液管連接至紫外蛋白檢測儀(可連接電腦採集數據或記錄儀進行記錄)。開啟蠕動泵設置流速v=1.56πr2ml/min(r表示層析柱半徑),用1mol/L PBS進行柱平衡直至紫外檢測OD280基線平穩,暫停蠕動泵。將蠕動泵進液管插入抗原濃縮液中啟動蠕動泵開始上樣。上樣結束後暫停蠕動泵,將其進液管移入無菌1mol/L PBS中啟動蠕動泵進行洗脫。紫外檢測OD280值增加時開始收集第一洗脫峰,OD280值降至最低時停止收集。繼續洗脫層析柱至抗原液全部流出柱體,進行下一次上樣。
五純化樣品的測定
對各階段純化樣品進行SDS-PAGE、Western-blot檢測。實驗結果可以看出,實施例4的純化工藝經過裂解、澄清、濃縮和層析純化的工藝流程,可以更高效的去除雜質,分離出目的蛋白,達到有效回收目的抗原地目的,提供了一種針對重組杆狀病毒PCV2的純化方法。
實施例5
一種豬圓環病毒2型病毒樣顆粒的純化方法,包括以下步驟:
1)取PCV2病毒培養液,裂解細胞,得到細胞裂解液;
2)取步驟1)所得的細胞裂解液澄清處理,得到病毒澄清液;
3)取步驟2)所得的病毒澄清液濃縮8倍,得到病毒濃縮液;
4)取步驟3)所得的病毒濃縮液利用Sepharose 4FF分子篩層析純化系統純化,純化過程中,先通過蠕動泵以1.56πr2ml/min的流速利用0.9mol/L PBS溶液進行柱平衡至紫外蛋白檢測儀OD280基線平穩,而後取步驟3)所得的病毒濃縮液上樣,上樣結束後利用0.9mol/L PBS溶液洗脫,收集紫外蛋白檢測儀OD280的第一洗脫峰;
其中r是層析柱半徑,單位是釐米。
在以上技術方案的基礎上,滿足以下條件:
步驟4)純化之前先用無菌的0.5mol/L的NaOH溶液對Sepharose 4FF分子篩層析純化系統進行循環衝洗20min,再用無菌1mol/L PBS對其進行循環衝洗,至PH為6.8。
步驟1)具體包括以下操作:取PCV2病毒培養液,反覆凍融3次,固液分離取沉澱,利用PBS溶液洗滌3次,棄去上清,加入細胞裂解液裂解,固液分離取沉澱,加入細胞裂解液重懸浮,而後超聲波處理。
步驟1)所述的固液分離均是在4℃條件下以9500r/min的轉速離心20min。
步驟1)中所述加入細胞裂解液裂解是:加入4℃預冷的細胞裂解液,用槍頭吹吸混勻後,冰浴20min。
步驟1)所述超聲處理是以振幅為25%的超聲波每次處理10s,每兩次處理之間的時間間隔30s,超聲處理的總時間為30min。
步驟2)所述澄清處理是利用孔徑為0.5μm的濾板實現的。
步驟2)中,先利用0.5mol/L NaOH溶液浸泡濾板5min,而後用1mol/L無菌PBS溶液洗滌至PH為7.0,再澄清處理步驟1)所得的細胞裂解液。
步驟3)中對病毒澄清液的濃縮是利用孔徑為100KD的中空纖維濾膜實現的。
步驟3)中先利用0.5mol/L NaOH溶液浸泡中空纖維濾膜20min,而後用1mol/L無菌PBS溶液洗滌至PH為7.0,再濃縮處理步驟2)所得的病毒澄清液。
實施例6
一種豬圓環病毒2型病毒樣顆粒的純化方法,包括以下步驟:
1)取PCV2病毒培養液,裂解細胞,得到細胞裂解液;
2)取步驟1)所得的細胞裂解液澄清處理,得到病毒澄清液;
3)取步驟2)所得的病毒澄清液濃縮12倍,得到病毒濃縮液;
4)取步驟3)所得的病毒濃縮液利用Sepharose 4FF分子篩層析純化系統純化,純化過程中,先通過蠕動泵以1.56πr2ml/min的流速利用1.1mol/L PBS溶液進行柱平衡至紫外蛋白檢測儀OD280基線平穩,而後取步驟3)所得的病毒濃縮液上樣,上樣結束後利用1.1mol/L PBS溶液洗脫,收集紫外蛋白檢測儀OD280的第一洗脫峰;
其中r是層析柱半徑,單位是釐米。
在以上技術方案的基礎上,滿足以下條件:
步驟4)純化之前先用無菌的0.5mol/L的NaOH溶液對Sepharose 4FF分子篩層析純化系統進行循環衝洗30min,再用無菌1mol/L PBS對其進行循環衝洗,至PH為7.2。
步驟1)具體包括以下操作:取PCV2病毒培養液,反覆凍融3次,固液分離取沉澱,利用PBS溶液洗滌3次,棄去上清,加入細胞裂解液裂解,固液分離取沉澱,加入細胞裂解液重懸浮,而後超聲波處理。
步驟1)所述的固液分離均是在4℃條件下以9500r/min的轉速離心20min。
步驟1)中所述加入細胞裂解液裂解是:加入4℃預冷的細胞裂解液,用槍頭吹吸混勻後,冰浴20min。
步驟1)所述超聲處理是以振幅為25%的超聲波每次處理10s,每兩次處理之間的時間間隔30s,超聲處理的總時間為30min。
步驟2)所述澄清處理是利用孔徑為0.8μm的濾板實現的。
步驟2)中,先利用0.5mol/L NaOH溶液浸泡濾板5min,而後用1mol/L無菌PBS溶液洗滌至PH為7.0,再澄清處理步驟1)所得的細胞裂解液。
步驟3)中對病毒澄清液的濃縮是利用孔徑為100KD的中空纖維濾膜實現的。
步驟3)中先利用0.5mol/L NaOH溶液浸泡中空纖維濾膜30min,而後用1mol/L無菌PBS溶液洗滌至PH為7.0,再濃縮處理步驟2)所得的病毒澄清液。
實施例7
一種豬圓環病毒2型病毒樣顆粒的純化方法,包括以下步驟:
1)取PCV2病毒培養液,裂解細胞,得到細胞裂解液;
2)取步驟1)所得的細胞裂解液澄清處理,得到病毒澄清液;
3)取步驟2)所得的病毒澄清液濃縮10倍,得到病毒濃縮液;
4)取步驟3)所得的病毒濃縮液利用Sepharose 4FF分子篩層析純化系統純化,純化過程中,先通過蠕動泵以1.56πr2ml/min的流速利用1mol/L PBS溶液進行柱平衡至紫外蛋白檢測儀OD280基線平穩,而後取步驟3)所得的病毒濃縮液上樣,上樣結束後利用1mol/L PBS溶液洗脫,收集紫外蛋白檢測儀OD280的第一洗脫峰;
其中r是層析柱半徑,單位是釐米。
在以上技術方案的基礎上,滿足以下條件:
步驟4)純化之前先用無菌的0.5mol/L的NaOH溶液對Sepharose 4FF分子篩層析純化系統進行循環衝洗25min,再用無菌1mol/L PBS對其進行循環衝洗,至PH為7。
步驟1)具體包括以下操作:取PCV2病毒培養液,反覆凍融3次,固液分離取沉澱,利用PBS溶液洗滌3次,棄去上清,加入細胞裂解液裂解,固液分離取沉澱,加入細胞裂解液重懸浮,而後超聲波處理。
步驟2)所述澄清處理是利用孔徑為0.6μm的濾板實現的。
步驟3)中對病毒澄清液的濃縮是利用孔徑為100KD的中空纖維濾膜實現的。
實施例8
一種豬圓環病毒2型病毒樣顆粒的純化方法,包括以下步驟:
1)取PCV2病毒培養液,裂解細胞,得到細胞裂解液;
2)取步驟1)所得的細胞裂解液澄清處理,得到病毒澄清液;
3)取步驟2)所得的病毒澄清液濃縮10倍,得到病毒濃縮液;
4)取步驟3)所得的病毒濃縮液利用Sepharose 4FF分子篩層析純化系統純化,純化過程中,先通過蠕動泵以1.56πr2ml/min的流速利用1mol/L PBS溶液進行柱平衡至紫外蛋白檢測儀OD280基線平穩,而後取步驟3)所得的病毒濃縮液上樣,上樣結束後利用1mol/L PBS溶液洗脫,收集紫外蛋白檢測儀OD280的第一洗脫峰;
其中r是層析柱半徑,單位是釐米。
以上對本發明的實施例進行了詳細說明,但所述內容僅為本發明的較佳實施例,並不用以限制本發明。凡在本發明的申請範圍內所做的任何修改、等同替換和改進等,均應包含在本發明的保護範圍之內。
SEQUENCE LISTING
天津瑞普生物技術股份有限公司
一種豬圓環病毒2型病毒樣顆粒的純化方法
2
1
708
DNA
天然序列(豬圓環病毒2型CAP蛋白天然表達基因)
1
ATGACGTATC CAAGGAGGCG TTACCGGAGA AGAAGACACC 40
GCCCCCGCAG CCATCTTGGC CAGATCCTCC GCCGCCGCCC 80
CTGGCTCGTC CACCCCCGCC ACCGTTACCG CTGGAGAAGG 120
AAAAATGGCA TCTTCAACAC CCGCCTCTCC CGCACCTTCG 160
GATATACTAT CAAGCGAACC ACAGTCAAAA CGCCCTCCTG 200
GGCGGTGGAC ATGATGAGAT TCAATATTAA TGACTTTCTT 240
CCCCCAGGAG GGGGCTCAAA CCCCCGCTCT GTGCCCTTTG 280
AATACTACAG AATAAGAAAG GTTAAGGTTG AATTCTGGCC 320
CTGCTCCCCG ATCACCCAGG GTGACAGGGG AGTGGGCTCC 360
AGTGCTGTTA TTCTAGATGA TAACTTTGTA ACAAAGGCCA 400
CAGCCCTCAC CTATGACCCC TATGTAAACT ACTCCTCCCG 440
CCATACCATA ACCCAGCCCT TCTCCTACCA CTCCCGCTAC 480
TTTACCCCCA AACCTGTCCT AGATTCCACT ATTGATTACT 520
TCCAACCAAA CAACAAAAGA AATCAGCTGT GGCTGAGACT 560
ACAAACTGCT GGAAATGTGG ACCACGTAGG CCTCGGCATT 600
GCGTTCGAAA ACAGTATATA CGACCAGGAA TACAATATCC 640
GTGTAACAAT GTATGTACAA TTCAGAGAAT TTAATTTAAA 680
GACCCCCCAC TTAACCCTTA ATGAATAA 708
2
708
DNA
人工序列(修飾後的豬圓環病毒2型CAP蛋白表達基因)
2
ATGACATACC CAAGAAGAAG ATACAGACGC AGAAGACACA 40
GACCCCGTTC GCACCTCGGA CAAATCCTGA GAAGAAGACC 80
GTGGCTCGTG CACCCAAGGC ATAGATACCG CTGGCGCCGT 120
AAGAACGGCA TCTTCAACAC GAGATTGTCT CGCACGTTCG 160
GATACACCAT TAAGCGTACC ACTGTGAAAA CCCCGTCATG 200
GGCTGTCGAC ATGATGAGGT TCAACATCAA CGATTTCCTG 240
CCTCCCGGTG GCGGTTCCAA CCCAAGAAGC GTCCCGTTCG 280
AGTACTACCG TATCAGGAAG GTGAAAGTCG AATTCTGGCC 320
TTGCTCCCCC ATTACTCAGG GTGACCGTGG TGTCGGCTCC 360
AGCGCCGTTA TCCTGGACGA TAACTTCGTT ACCAAGGCTA 400
CTGCCCTCAC ATACGACCCT TACGTGAACT ACTCTTCAAG 440
ACACACAATT ACGCAGCCCT TCAGTTACCA TTCGCGCTAC 480
TTCACTCCAA AGCCGGTCCT CGACAGTACA ATCGATTACT 520
TCCAACCTAA CAACAAACGT AACCAGCTGT GGCTCAGGTT 560
GCAAACTGCA GGCAACGTTG ACCACGTGGG ACTGGGTATC 600
GCGTTCGAGA ACAGCATTTA CGATCAAGAA TACAACATCC 640
GCGTTACAAT GTACGTCCAG TTCAGAGAGT TCAACCTCAA 680
AACCCCCCAC CTCACCCTCA ACGAGTAA 708
