T細胞活化性雙特異性抗原結合分子CD3ABD葉酸受體1(FolR1)和PD‑1軸結合拮抗劑的組合療法的製作方法
2023-05-09 01:55:26 5
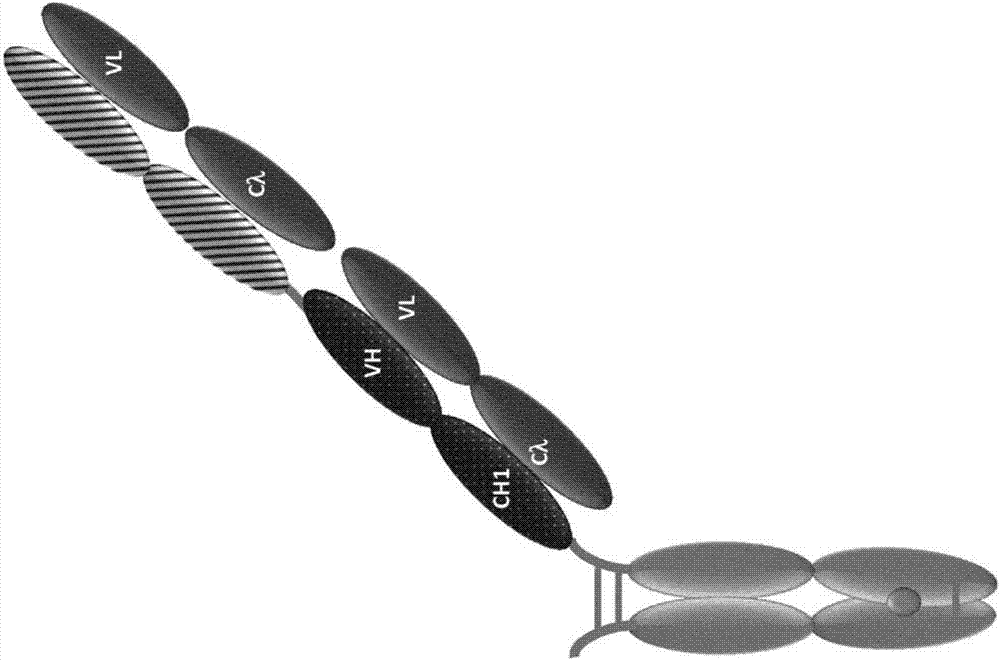
序列表本申請含有序列表,其已經以ascii格式電子提交且據此通過援引完整收錄。2015年11月11日創建的所述ascii拷貝,名稱為32401_sl.txt且大小為527,137位元組。發明領域本發明涉及採用t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑及任選的tim3拮抗劑的組合療法,及這些組合療法用於治療癌症的用途。發明背景單克隆抗體是有力的用於治療癌症的治療劑,選擇性靶向在癌細胞上差異表達的抗原。最近數年對雙特異性抗體變得感興趣,其設計為用一個抗原結合模塊結合靶細胞上的表面抗原,而用第二個抗原結合模塊結合t細胞受體(tcr)複合物的活化性的,不變的構件。此類抗體對其兩種靶物的同時結合會迫使靶細胞和t細胞之間的暫時相互作用,引起任何細胞毒性t細胞活化和隨後的靶細胞裂解。因此,免疫應答重定向於靶細胞,而且不依賴於靶細胞的肽抗原呈遞或t細胞的特異性,其對於ctl的正常mhc限制性活化會是相關的。在此背景中,至關重要的是ctl僅在靶細胞向其呈遞雙特異性抗體時活化,即模擬免疫突觸。特別期望的是不需要淋巴細胞預條件化或共刺激來引發靶細胞有效裂解的雙特異性抗體。關於在某些效應器功能的活化以外tcb如何影響t細胞自身的了解不多。抗原呈遞細胞(apc)對靜息t淋巴細胞或t細胞的活化看來需要兩種信號輸入。laffertyetal.,aust.j.exp.biol.med.scl53:27-42(1975)。在主要組織相容性複合體(mhc)的背景中呈遞的外來抗原肽的識別後,第一或抗原特異性信號經由t細胞受體(tcr)轉導。第二或共刺激信號通過抗原呈遞細胞(apc)上表達的共刺激分子投遞至t細胞,並且促進t細胞克隆擴充,細胞因子分泌和效應器功能。lenschowetal.,ann.rev.immunol.14:233(1996)。在缺乏共刺激的情況中,t細胞能對抗原刺激變得不應,不發起有效的免疫應答,並且可以導致對外來抗原的耐受性或耗竭。t細胞能接受正和負第二共刺激信號二者。正和負信號的平衡對於在維持免疫耐受性和防止自身免疫的同時引發有效的免疫應答是重要的。負第二信號對於誘導t細胞耐受性看來是必需的,而正信號促進t細胞活化。最近,已經發現了t細胞功能障礙或無反應性與抑制性受體(編程性死亡1多肽(pd-1))的誘導的且持續的表達並行發生。它的配體之一,pd-l1在許多癌症中過表達,並且經常與不良預後關聯(okazakitetal.,intern.immun.2007,19(7):813;thompsonrhetal.,cancerres2006,66(7):3381)。令人感興趣地,與正常組織中的t淋巴細胞和外周血t淋巴細胞形成對比,大多數腫瘤浸潤性t淋巴細胞主要表達pd-1,這指示腫瘤反應性t細胞上pd-1的上調可以促成受損的抗腫瘤免疫應答(blood2009114(8):1537)。含有t細胞免疫球蛋白和粘蛋白域的分子3(tim3)在免疫調節中是重要的。這種細胞表面蛋白質優先由1型t輔助細胞表達,而且已經與巨噬細胞活化的調節,炎性狀況和癌症聯繫起來(majetiretal.,pnas,106(2009)3396-3401及wo2009/091547)。tim-3對它的配體之一(例如半乳凝集素-9)的結合能通過誘導編程性細胞死亡而阻抑th1應答,由此支持外周耐受。用tim-3sirna或抗tim-3拮抗劑抗體處理提高來自cd4陽性t細胞的幹擾素α分泌,支持tim-3在人t細胞中的抑制性作用。抗tim-3單克隆抗體的例子包括wo2013/06490及us2012/189617(ngiowetal.,cancerres7:6567(2011))中公開的。folr1表達在多種起源的腫瘤細胞上,例如卵巢和肺癌。已經描述了以治療性抗體,諸如farletuzumab,抗體-藥物綴合物,或過繼性t細胞療法靶向folr1來對腫瘤成像的數種辦法(kandalaftetal.,jtranslmed.2012aug3;10:157.doi:10.1186/1479-5876-10-157;vandametal.,natmed.2011sep18;17(10):1315-9.doi:10.1038/nm.2472;cliftonetal.,humvaccin.2011feb;7(2):183-90.epub2011feb1;kelemenetal.,intjcancer.2006jul15;119(2):243-50;vaitilingametal.,jnuclmed.2012jul;53(7);tengetal.,2012aug;9(8):901-8.doi:10.1517/17425247.2012.694863.epub2012jun5)。已經進行了一些嘗試以靶向葉酸受體和cd3的構建物來靶向葉酸受體陽性腫瘤(kranzetal.,procnatlacadsciusa.sep26,1995;92(20):9057-9061;royetal.,advdrugdelivrev.2004apr29;56(8):1219-31;huitingcuietalbiolchem.aug17,2012;287(34):28206-28214;lamersetal.,int.j.cancer.60(4):450(1995);thompsonetal.,mabs.2009jul-aug;1(4):348-56.epub2009jul19;mezzanzancaetal.,int.j.cancer,41,609-615(1988))。仍然需要用於治療各種癌症,穩定化各種癌症,預防各種癌症,和/或延遲各種癌症形成的此類最佳療法。發明概述寬泛而言,本發明涉及組合葉酸受體1(folr1)靶向性抗原結合位點與靶向cd3的第二抗原結合位點的雙特異性抗體及其與pd-1軸結合拮抗劑組合,例如用於治療癌症的用途。在一個實施方案中,該組合進一步包含tim3拮抗劑。本發明的方法和組合能夠實現增強的免疫療法。勝過常規治療的優勢在於與pd-1軸結合拮抗劑和任選的tim3拮抗劑的組合所致只在folr1表達的部位處誘導t細胞活化的特異性以及低t細胞介導活性(也稱作t細胞耗竭)的減輕和/或逆轉。因而,在一個方面,本發明提供一種用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含能夠特異性結合cd3的第一抗原結合模塊和能夠特異性結合葉酸受體1(folr1)的第二抗原結合模塊。在一個實施方案中,該第一抗原結合模塊包含至少一種選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)胺基酸序列和至少一種選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個實施方案中,該第一抗原結合模塊包含包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子進一步包含能夠特異性結合folr1的第三抗原結合模塊。在一個實施方案中,該能夠特異性結合folr1的第二和第三抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列。在一個實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同。在一個實施方案中,該第一,第二和第三抗原結合模塊中至少一項為fab分子。在一個實施方案中,該能夠特異性結合葉酸受體1(folr1)的抗原結合模塊包含至少一種選自由seqidno:16,seqidno:17和seqidno:18組成的組的重鏈互補決定區(cdr)胺基酸序列和至少一種選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個實施方案中,該能夠特異性結合葉酸受體1(folr1)的抗原結合模塊包含包含seqidno:15的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在一個實施方案中,該能夠特異性結合葉酸受體1(folr1)的抗原結合模塊包含至少一種選自由seqidno:8,seqidno:56和seqidno:57組成的組的重鏈互補決定區(cdr)胺基酸序列和至少一種選自seqidno:59,seqidno:60,seqidno:65的組的輕鏈cdr。在一個實施方案中,該能夠特異性結合葉酸受體1(folr1)的抗原結合模塊包含包含seqidno:55的胺基酸序列的可變重鏈和包含seqidno:64的胺基酸序列的可變輕鏈。在一個實施方案中,該能夠特異性結合葉酸受體1(folr1)的抗原結合模塊包含至少一種選自由seqidno:8,seqidno:9和seqidno:50組成的組的重鏈互補決定區(cdr)胺基酸序列和至少一種選自seqidno:52,seqidno:53,seqidno:54的組的輕鏈cdr。在一個實施方案中,該能夠特異性結合folr1的抗原結合模塊包含:(a)seqidno:8的互補決定區重鏈1(cdr-h1)胺基酸序列;(b)seqidno:9的cdr-h2胺基酸序列;(c)seqidno:50的cdr-h3胺基酸序列;(d)seqidno:52的互補決定區輕鏈1(cdr-l1)胺基酸序列;(e)seqidno:53的cdr-l2胺基酸序列;和(f)seqidno:54的cdr-l3胺基酸序列。在一個此類實施方案中,該能夠特異性結合folr1的抗原結合模塊包含包含seqidno:49的胺基酸序列的可變重鏈和包含seqidno:51的胺基酸序列的可變輕鏈。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子結合人folr1,食蟹猴folr1和鼠folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外誘導人cd3陽性t細胞增殖。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外誘導人外周血單個核細胞介導的對folr1表達性人腫瘤細胞的殺傷。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外誘導t細胞介導的對folr1表達性人腫瘤細胞的殺傷。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外在24小時之後以介於約36pm和約39573pm之間的ec50誘導t細胞介導的對folr1表達性人腫瘤細胞的殺傷。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子誘導t細胞上cd25和cd69中至少一項的細胞表面表達的上調,如通過流式細胞術測量的。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以約5.36pm至約4nm的表觀kd結合人folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以約4nm的表觀kd結合人和食蟹猴folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以約1.5nm的表觀kd結合鼠folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以至少約1000nm的單價結合kd結合人folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子結合人腫瘤細胞上表達的folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子結合人folr1上的構象表位。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子不結合人葉酸受體2(folr2)或人葉酸受體3(folr3)。在一個實施方案中,該抗原結合模塊結合包含人folr1(seqidno:227)的胺基酸25至234的folr1多肽。在一個實施方案中,該folr1抗原結合模塊結合包含seqidno:227,230和231的胺基酸序列的folr1多肽,且其中該folr1抗原結合模塊不結合包含seqidno:228和229的胺基酸序列的folr多肽。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含a)與包含seqidno:49的可變重鏈域(vh)和seqidno:51的可變輕鏈域的參照抗體競爭結合人folr1的第一抗原結合位點;和b)與包含seqidno:36的可變重鏈域(vh)和seqidno:31的可變輕鏈域的參照抗體競爭結合人cd3的第二抗原結合位點,其中結合競爭是使用表面等離振子共振測定法測量的。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含形成第一,第二和第三抗原結合模塊的第一,第二,第三,第四和第五多肽鏈,其中該第一抗原結合模塊能夠結合cd3且該第二和該第三抗原結合模塊均能夠結合葉酸受體1(folr1),其中a)該第一和該第二多肽鏈以氨基(n)端至羧基(c)端方向包含vld1和cld1;b)該第三多肽鏈以n端至c端方向包含vld2和ch1d2;c)該第四多肽鏈以n端至c端方向包含vhd1,ch1d1,ch2d1和ch3d1;d)該第五多肽鏈包含vhd1,ch1d1,vhd2,cld2,ch2d2和ch3d2;其中vld1為第一輕鏈可變域vld2為第二輕鏈可變域cld1為第一輕鏈恆定域cld2為第二輕鏈恆定域vhd1為第一重鏈可變域vhd2為第二重鏈可變域ch1d1為第一重鏈恆定域1ch1d2為第二重鏈恆定域1ch2d1為第一重鏈恆定域2ch2d2為第二重鏈恆定域2ch3d1為第一重鏈恆定域3ch3d2為第二重鏈恆定域3。在一個此類實施方案中,該第三多肽鏈和該第五多肽鏈的vhd2和cld2形成該能夠結合cd3的第一抗原結合模塊;該第一多肽鏈和該第四多肽鏈的vhd1和ch1d1形成該能夠結合folr1的第二結合模塊;且該第二多肽鏈和該第五多肽鏈的vhd1和ch1d1形成該能夠結合folr1的第三結合模塊。在一個此類實施方案中,該第一和第二多肽鏈包含seqidno:399的胺基酸序列。在一個此類實施方案中,該第三多肽鏈包含seqidno:86的胺基酸序列。在一個此類實施方案中,該第四多肽鏈包含seqidno:394的胺基酸序列。在一個此類實施方案中,該第五多肽鏈包含seqidno:397的胺基酸序列。在一個實施方案中,該第一和第二多肽鏈包含seqidno:399的胺基酸序列;該第三多肽鏈包含seqidno:86的胺基酸序列;該第四多肽鏈包含seqidno:394的胺基酸序列;且該第五多肽鏈包含seqidno:397的胺基酸序列。在一些實施方案中,該雙特異性抗體對於folr1和cd3二者均是二價的。一些實施方案中,該雙特異性抗體包含一個或多個包含對cd3特異性的抗原結合位點的fab片段,其中重和輕鏈的可變區或恆定區是交換的。在一些實施方案中,該雙特異性抗體包含fc域,至少一個包含對folr1特異性的抗原結合位點的fab片段,和至少一個包含對cd3特異性的抗原結合位點的fab片段,其中至少一個fab片段的重和輕鏈的可變區或恆定區任一是交換的。在一些實施方案中,該雙特異性抗體包含:a)fc域,b)均包含對folr1特異性的抗原結合位點的第一和第二fab片段,c)包含對cd3特異性的抗原結合位點的第三fab片段,其中該第三fab片段在可變重鏈(vh)的c端處連接至該fc域的第二亞基,且其中該第三fab片段在可變重鏈的n端處連接至該第二fab片段的c端。在一個實施方案中,所述fab片段中至少一項經肽接頭連接至該fc域。在一個實施方案中,所述雙特異性抗體包含fc域,其包含一處或多處降低對fc受體的結合和/或效應器功能的胺基酸替代。在一個實施方案中,所述一處或多處胺基酸替代在一個或多個選自l234,l235,和p329的組的位置處。在一個實施方案中,該fc域的每個亞基包含三處消除對活化性或抑制性fc受體的結合和/或效應器功能的胺基酸替代,其中所述胺基酸替代為l234a,l235a和p329g。在一些實施方案中,該pd-1軸結合拮抗劑選自由pd-1結合拮抗劑,pdl1結合拮抗劑和pdl2結合拮抗劑組成的組。在一些實施方案中,該pd-1軸結合拮抗劑為pd-1結合拮抗劑。在一些實施方案中,該pd-1結合拮抗劑抑制pd-1結合它的配體結合配偶。在一些實施方案中,該pd-1結合拮抗劑抑制pd-1結合pdl1。在一些實施方案中,該pd-1結合拮抗劑抑制pd-1結合pdl2。在一些實施方案中,該pd-1結合拮抗劑抑制pd-1結合pdl1和pdl2二者。在一些實施方案中,該pd-1結合拮抗劑為抗體。在一些實施方案中,該抗pd-1抗體為單克隆抗體。在一些實施方案中,該抗pd-1抗體為選自由fab,fab』-sh,fv,scfv,和(fab』)2片段組成的組的抗體片段。在一些實施方案中,該pd-1結合拮抗劑為nivolumab,pembrolizumab,ct-011,或amp-224。在一些實施方案中,該pd-1軸結合拮抗劑為pdl1結合拮抗劑。在一些實施方案中,該pdl1結合拮抗劑抑制pdl1結合pd-1。在一些實施方案中,該pdl1結合拮抗劑抑制pdl1結合b7-1。在一些實施方案中,該pdl1結合拮抗劑抑制pdl1結合pd-1和b7-1二者。在一些實施方案中,該pdl1結合拮抗劑為抗pdl1抗體。在一些實施方案中,該抗pdl1抗體為單克隆抗體。在一些實施方案中,該抗pdl1抗體為選自由fab,fab』-sh,fv,scfv,和(fab』)2片段組成的組的抗體片段。在一些實施方案中,該抗pdl1抗體為人源化抗體或人抗體。在一些實施方案中,該pdl1結合拮抗劑選自由yw243.55.s70,mpdl3280a,mdx-1105,和medi4736組成的組。在一些實施方案中,該抗pdl1抗體包含包含seqidno:289的hvr-h1序列,seqidno:290的hvr-h2序列,和seqidno:291的hvr-h3序列的重鏈;和包含seqidno:292的hvr-l1序列,seqidno:293的hvr-l2序列,和seqidno:294的hvr-l3序列的輕鏈。在一些實施方案中,該抗pdl1抗體包含包含seqidno:280或seqidno:281的胺基酸序列的重鏈可變區和包含seqidno:383的胺基酸序列的輕鏈可變區。在一些實施方案中,該抗pdl1抗體包含包含seqidno:278的胺基酸序列的重鏈和/或包含seqidno:279的胺基酸序列的輕鏈。在一些實施方案中,該pd-1軸結合拮抗劑為pdl2結合拮抗劑。在一些實施方案中,該pdl2結合拮抗劑為抗體。在一些實施方案中,該抗pdl2抗體為單克隆抗體。在一些實施方案中,該抗pdl2抗體為選自由fab,fab』-sh,fv,scfv,和(fab』)2片段組成的組的抗體片段。在一些實施方案中,該pdl2結合拮抗劑為免疫粘附素。在一個實施方案中,上述實施方案中任一項的方法進一步包括對該個體施用t細胞免疫球蛋白粘蛋白3(tim3)拮抗劑。在一個實施方案中,該tim3拮抗劑為抗tim3抗體。在一個實施方案中,該抗tim3抗體於37℃120分鐘後誘導至少45%的tim3表達性細胞上tim3的內在化,其中內在化是通過facs分析測量的。在一個實施方案中,該抗tim3抗體具有下述特性中的一項或多項:a)與包含seqidno:7的vh和seqidno:8的vl的抗tim3抗體競爭結合tim3b)結合人和食蟹猴tim3c)作為免疫綴合物對tim3表達性細胞顯示細胞毒性活性d)誘導幹擾素-γ釋放。在一個實施方案中,該抗tim3抗體具有下述特性中的一項或多項:a.與包含seqidno:7的vh和seqidno:8的vl的抗tim3抗體競爭結合tim3b.結合人和食蟹猴tim3c.作為免疫綴合物對tim3表達性細胞顯示細胞毒性活性d.誘導幹擾素-γ釋放。在一個實施方案中,該抗tim3抗體為單克隆抗體。在一個實施方案中,該抗tim3抗體為人,人源化,或嵌合抗體。在一個實施方案中,該抗tim3抗體為結合tim3的抗體片段。在一個實施方案中,該抗tim3抗體為fab片段。在一個實施方案中,該抗tim3抗體包含:a)(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:307的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3;或b)(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:314的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3;或c)(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:315的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3;或d)(a)如下的vh域,該vh域包含(i)包含seqidno:316的胺基酸序列的hvr-h1,(ii)包含seqidno:317的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:318的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:319的胺基酸序列的hvr-l1,(ii)包含seqidno:320的胺基酸序列的hvr-l2,和(iii)包含seqidno:321的胺基酸序列的hvr-l3;或e)(a)如下的vh域,該vh域包含(i)包含seqidno:324的胺基酸序列的hvr-h1,(ii)包含seqidno:325的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:326的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:327的胺基酸序列的hvr-l1,(ii)包含seqidno:328的胺基酸序列的hvr-l2,和(iii)包含seqidno:329的胺基酸序列的hvr-l3;或。f)(a)如下的vh域,該vh域包含(i)包含seqidno:332的胺基酸序列的hvr-h1,(ii)包含seqidno:333的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:334的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:335的胺基酸序列的hvr-l1,(ii)包含seqidno:336的胺基酸序列的hvr-l2,和(iii)包含seqidno:337的胺基酸序列的hvr-l3;或g)(a)如下的vh域,該vh域包含(i)包含seqidno:340的胺基酸序列的hvr-h1,(ii)包含seqidno:341的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:342的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:343的胺基酸序列的hvr-l1,(ii)包含seqidno:344的胺基酸序列的hvr-l2,和(iii)包含seqidno:345的胺基酸序列的hvr-l3;或h)(a)如下的vh域,該vh域包含(i)包含seqidno:348的胺基酸序列的hvr-h1,(ii)包含seqidno:349的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:350的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:351的胺基酸序列的hvr-l1,(ii)包含seqidno:352的胺基酸序列的hvr-l2,和(iii)包含seqidno:353的胺基酸序列的hvr-l3;或i)(a)如下的vh域,該vh域包含(i)包含seqidno:356的胺基酸序列的hvr-h1,(ii)包含seqidno:357的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:358的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:359的胺基酸序列的hvr-l1,(ii)包含seqidno:360的胺基酸序列的hvr-l2,和(iii)包含seqidno:361的胺基酸序列的hvr-l3;或j)(a)如下的vh域,該vh域包含(i)包含seqidno:364的胺基酸序列的hvr-h1,(ii)包含seqidno:365的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:366的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:367的胺基酸序列的hvr-l1,(ii)包含seqidno:368的胺基酸序列的hvr-l2,和(iii)包含seqidno:369的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體為具有突變s228p,l235e和p329g的全長igg1抗體,依照kabat編號方式的eu索引。在一個實施方案中,該抗tim3抗體為wo2011/155607,wo2013/006490,wo03/063792,wo2009/097394,和wo2011/159877中描述的抗體中任一項。在一個實施方案中,該抗tim3抗體為f38-2e2。在一個實施方案中,該癌症含有akras野生型。在一個實施方案中,該癌症含有活化性kras突變。在一個實施方案中,該治療在該治療停止後在該個體中導致持久響應。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子和該pd-1軸結合拮抗劑中至少一項是連續施用的。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子和該pd-1軸結合拮抗劑中至少一項是間歇施用的。在一個實施方案中,該pd-1軸結合拮抗劑在該folr1tcb之前施用。在一個實施方案中,該pd-1軸結合拮抗劑與該folr1tcb同時施用。在一個實施方案中,該pd-1軸結合拮抗劑在該folr1tcb之後施用。在一個實施方案中,該癌症選自由卵巢癌,肺癌,乳腺癌,腎癌,結直腸癌,子宮內膜癌組成的組。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子和該pd-1軸結合拮抗劑中至少一項是靜脈內,肌肉內,皮下,表面,口服,經皮,腹膜內,眶內,通過植入,通過吸入,鞘內,室內,或鼻內施用的。在一個實施方案中,該個體中的t細胞具有相對於施用該組合之前增強的活化,增殖和/或效應器功能。在一個實施方案中,該個體中的t細胞具有相對於單獨施用該t細胞活化性雙特異性抗原結合分子增強的活化,增殖和/或效應器功能。在一個實施方案中,t細胞效應器功能為分泌il-2,ifn-γ和tnf-α中至少一項。在一個實施方案中,該個體包含少於約15%的pd-1高表達性腫瘤浸潤性t細胞。在一個方面,本發明提供一種在具有folr1陽性癌症的個體中增強免疫功能的方法,其包括對該個體施用有效量對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑的組合。在一個實施方案中,該個體中的t細胞具有相對於施用該組合之前增強的活化,增殖和/或效應器功能。在一個實施方案中,該個體中的t細胞具有相對於單獨施用該t細胞活化性雙特異性抗原結合分子增強的活化,增殖和/或效應器功能。在一個實施方案中,t細胞效應器功能為分泌il-2,ifn-γ和tnf-α中至少一項。在一個實施方案中,該個體包含少於約15%的pd-1高表達性腫瘤浸潤性t細胞。在另一個方面,本發明提供一種用於為對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑的組合治療選擇患者的方法,其包括測量pd-1表達的水平,其中為該組合治療選擇具有少於約15%的pd-1高表達性t細胞的患者。在另一個方面,本發明提供一種試劑盒,其包含對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子及包裝插頁,該包裝插頁包含關於與pd-1軸結合拮抗劑一起使用該t細胞活化性雙特異性抗原結合分子在個體中治療癌症或延遲癌症進展的用法說明書。在一個實施方案中,該試劑盒進一步包含關於與tim3拮抗劑一起使用該t細胞活化性雙特異性抗原結合分子的用法說明書。在另一個方面,本發明提供一種試劑盒,其包含對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑及包裝插頁,該包裝插頁包含關於使用該t細胞活化性雙特異性抗原結合分子和該pd-1軸結合拮抗劑在個體中治療癌症或延遲癌症進展的用法說明書。在一個實施方案中,該試劑盒進一步包含tim3拮抗劑。在一個實施方案中,該pd-1軸結合拮抗劑為抗pd-1抗體或抗pdl-1抗體。在一個實施方案中,該pd-1軸結合拮抗劑為抗pd-1免疫粘附素。在另一個方面,本發明提供一種藥物組合物,其包含對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子,pd-1軸結合拮抗劑和藥學可接受載劑。在一個實施方案中,該藥物組合物進一步包含tim3拮抗劑。在另一個方面,本發明提供對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑的組合在製造用於治療癌症的藥物中的用途。在一個實施方案中,該藥物用於治療卵巢癌,肺癌,乳腺癌,腎癌,結直腸癌,子宮內膜癌。在本發明的所有方面的某些實施方案中,有利的是,所述t細胞活化性雙特異性抗原結合分子和/或pd-1軸結合拮抗劑是人的或人源化的。在一些實施方案中,該雙特異性抗體包含fc域,至少一個包含對folr1特異性的抗原結合位點的fab片段,和至少一個包含對cd3特異性的抗原結合位點的fab片段。在一個方面,本發明提供一種用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子和tim3拮抗劑。在一些實施方案中,該t細胞活化性雙特異性抗原結合分子包含fc域,兩個均包含對folr1特異性的抗原結合位點的fab片段,和一個包含對cd3特異性的抗原結合位點的fab片段。在又一個方面,本發明提供結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑的組合在製造用於治療癌症的藥物中的用途。在又一個方面,本發明提供結合folr1和cd3的t細胞活化性雙特異性抗原結合分子,pd-1軸結合拮抗劑和tim3拮抗劑的組合在製造用於治療癌症的藥物中的用途。現在會參考附圖通過舉例而非限制的方式描述本發明的實施方案。然而,鑑於本公開文本,本發明的各種別的方面和實施方案對於本領域技術人員會是顯而易見的。「和/或」在本文中使用時要視為具體公開兩個規定特徵或組件的每一個,具有或沒有另一個。例如,「a和/或b」要視為具體公開(i)a,(ii)b和(iii)a和b中的每一個,就像在本文中單獨列出每一個一樣。除非上下文另有規定,上文列出的特徵的描述和定義不限於本發明的任何特定方面或實施方案,而且同等地應用於所描述的所有方面和實施方案。附圖簡述圖1a-i圖示本發明的t細胞活化性雙特異性抗原結合分子(tcb)的例示性構造。除(圖1i)中的κ-λ型式以外的所有構建物均具有p329glala突變且包含具有節入穴修飾的節入穴fc片段。(圖1a)「folr1tcb2+1倒轉的(共同輕鏈)」的圖示。folr1結合物在fab重鏈的c端融合至包含節修飾的fc域的第一亞基的n端。這些構建物不是交叉的且具有三份相同的vlcl輕鏈。(圖1b)「folr1tcb1+1頭至尾(共同輕鏈)」的圖示。這些構建物不是交叉的且具有兩份相同的vlcl輕鏈。(圖1c)「folr1tcb1+1經典的(共同輕鏈)」的圖示。這些構建物不是交叉的且具有兩份相同的vlcl輕鏈。(圖1d)「folr1tcb2+1經典的(共同輕鏈)」的圖示。cd3結合物在fab重鏈的c端融合至包含節修飾的fc域的第一亞基的n端。這些構建物不是交叉的且具有三份相同的vlcl輕鏈。(圖1e)「folr1tcb2+1crossfab經典的」的圖示。這些構建物對於cd3結合物包含ck-vh鏈代替常規的ch1-vh鏈。cd3結合物在fab重鏈的c端融合至包含節修飾的fc域的第一亞基的n端。(圖1f)「folr1tcb2+1crossfab倒轉的」的圖示。這些構建物對於cd3結合物包含ck-vh鏈代替常規的ch1-vh鏈。folr1結合物在fab重鏈的c端融合至包含節修飾的fc域的第一亞基的n端。(圖1g)「folr1tcb1+1crossfab頭至尾」的圖示。這些構建物對於cd3結合物包含ck-vh鏈代替常規的ch1-vh鏈。(圖1h)「folr1tcb1+1crossfab經典的」的圖示。這些構建物對於cd3結合物包含ck-vh鏈代替常規的ch1-vh鏈。圖1i圖示cd3/folr1κ-λ抗體型式。這些構建物包含交叉的共同輕鏈vlch1和一個對cd3特異性的交叉的vhcl鏈和一個對folr1特異性的交叉的vhcl鏈。圖2a-c描繪匯總folr1igg結合物對hela細胞的結合的圖。通過流式細胞術測定新生成的folr1結合物對hela細胞上表達的folr1的結合。用螢光標記的抗人二抗檢測結合的抗體。圖3a-b描繪匯總folr1結合物對folr1的特異性的圖。通過流式細胞術分析folr1igg對用folr1或folr2任一瞬時轉染的hek細胞的結合以鑑定特異性結合folr1且不結合folr2的克隆。用螢光標記的抗人二抗檢測抗體。圖4a-b描繪匯總folr1結合物對cyfolr1的交叉反應性的圖。通過流式細胞術在用cyfolr1瞬時轉染的hek細胞上解析folr1抗體對食蟹猴folr1的交叉反應性。用螢光標記的抗人二抗檢測抗體。圖5描繪圖示結合後folr1tcb的內在化的圖。在hela細胞上測試結合folr1後四種folr1tcb的內在化。在於37℃溫育指定時間點之後用螢光標記的抗人二抗檢測表面上的剩餘folr1tcb。計算內在化的百分比。圖6a-e描繪匯總folr1igg對具有不同folr1表達水平的細胞的結合的圖。通過流式細胞術分析9d11,16d5和mov19igg對具有不同folr1表達水平的腫瘤細胞的結合。包括dp47igg作為同種型對照,且包括mkn-45作為folr1陰性細胞系。用螢光標記的抗人二抗檢測抗體。圖7a-l描繪匯總t細胞介導的對ht-29和skov3細胞的殺傷的圖。使用folr1tcb來測試t細胞介導的對ht-29和skov3腫瘤細胞的殺傷和殺傷後t細胞上活化標誌物的上調。(圖7a-d)在24小時和48小時之後通過ldh釋放測量在9d11folr1tcb和16d5folr1tcb存在下t細胞介導的對ht-29和skov3細胞的殺傷。包括dp47tcb作為陰性對照。在48小時溫育之後通過流式細胞術評估skov3(圖7e-h)或ht-29(圖7i-l)腫瘤細胞殺傷後cd8t細胞和cd4t細胞上活化標誌物cd25和cd69的上調。圖8描繪顯示對紅細胞的抗folr1結合的缺失的圖。紅細胞作為cd235a陽性群體設定門,並通過流式細胞術測定9d11igg,16d5igg,mov19igg和dp47igg對這個群體的結合。用螢光標記的抗人二抗檢測抗體。圖9a-d描繪匯總全血中的活化標誌物上調的圖。通過流式細胞術分析在添加9d11folr1tcb,16d5folr1tcb,mov19folr1tcb和dp47tcb之後24小時cd4t細胞和cd8t細胞的cd25和cd69活化標誌物上調。圖10a-c顯示由36f2tcb,16d5tcb,16d5tcb經典的,16d5tcb1+1和16d5tcbht誘導的對hela(高folr1)(圖24a),skov-3(中等folr1)(圖24b)和ht-29(低folr1)(圖24c)人腫瘤細胞的t細胞殺傷(e:t=10:1,效應人pbmc,溫育時間24小時)。包括dp47tcb作為非結合對照。圖11a-b顯示腫瘤浸潤性t細胞上抑制性受體的表達。通過流式細胞術對腫瘤樣品中的cd8+和cd4+t細胞表徵它們的抑制性受體表達。圖12a-o顯示暴露於folr1-tcb後腫瘤消化物和惡性滲出液中cd8+t細胞的活化。將腫瘤消化物或惡性滲出液在folr1-tcb或對照tcbdp-47存在或缺失下培養24小時。通過流式細胞術測定cd8+t細胞上活化標誌物或t細胞功能標誌物的表達(圖12a-m)。圖12j-k顯示代表性facs圖,顯示高響應(bs-269)或低響應(bs-212)患者中folr1-tcb誘導的t細胞活化。圖12l描繪facs圖,顯示來自一名代表性患者的t細胞中folr1-tcb誘導的活化標誌物表達。圖12m中的圖以均值和標準偏差描繪folr1-tcb處理後標誌物表達的升高。作為比較,將來自健康供體的pbmc與skov3腫瘤細胞系一起共培養,並用folr1-tcb刺激。圖12n描繪細胞培養物上清液中的ifn-γ,il-2,tnf和穿孔素,是通過細胞術珠陣列或elisa測定並針對培養物中1x105個cd3+t細胞(ifn-γ,tnf,il-2)或cd3+cd8+t細胞(穿孔素)的量標準化的。圖12o顯示腫瘤消化物和惡性滲出液中folr1-tcb誘導的腫瘤細胞殺傷大大變化。folr1陽性和陰性腫瘤消化物,惡性滲出液或來自健康供體的pbmc與外源添加的螢光標記的folr1+skov3細胞一起以e:t比1:1在folr1-tcb存在或缺失下共培養24小時。通過測量活化的胱天蛋白酶3和活/死標誌物-近ir,通過流式細胞術測定folr1-tcb誘導的對skov3細胞的特異性殺傷。如下計算folr1-tcb介導的殺傷:%特異性殺傷=100–[(%folr1-tcb處理樣品中的skov3活細胞/%未處理樣品中的skov3活細胞)x100]。facs圖顯示一名代表性患者中的folr1-tcb誘導的殺傷。p值是使用不配對mann-whitney檢驗計算的。圖13a-c顯示folr1-tcb誘導的t細胞活化顯示與e:t比(圖13a)或folr1+腫瘤細胞的量(圖13b)沒有關聯。將腫瘤消化物或惡性滲出液在folr1-tcb存在或缺失下培養24小時。folr1-tcb誘導的cd25表達與e:t比或靶細胞的量關聯起來。mfi:均值螢光強度。圖14a-l顯示folr1-tcb誘導的t細胞活化與pd-1和tim-3的表達逆相關。將腫瘤消化物或惡性滲出液在folr1-tcb存在或缺失下培養24小時。通過流式細胞術測定cd8+t細胞上活化標誌物或t細胞功能標誌物的表達。將folr1-tcb誘導的cd25(圖4a-c),cd137(圖14d-f),icos(圖14g-i)和粒酶b(圖14j-l)表達與抑制性受體pd-1和tim-3的基線單一或共表達關聯起來。圖15a-c顯示folr1-tcb誘導的il-2分泌與pd-1和tim-3的共表達逆相關。將腫瘤消化物或惡性滲出液在folr1tcb存在或缺失下培養24小時。通過elisa測定細胞培養物上清液中的il-2,並針對t細胞的量標準化。將folr1tcb誘導的il-2分泌與抑制性受體pd-1和tim-3的基線單一或共表達關聯起來。圖16a-f顯示folr1-tcb誘導的腫瘤細胞殺傷與pd-1和tim-3的共表達逆相關。將腫瘤消化物或惡性滲出液與外源添加的螢光標記的skov3細胞一起以t細胞對靶細胞比1:1在folr1tcb存在或缺失下共培養24小時。通過測量活化的胱天蛋白酶3和活/死標誌物live/dead-近ir,通過流式細胞術測定folr1-tcb對skov3細胞的特異性殺傷。將特異性殺傷與抑制性受體pd-1,tim-3和ctla-4的基線單一或共表達關聯起來。圖17a-h顯示暴露於catumaxomab後腫瘤浸潤性cd8+t細胞的活化。將腫瘤消化物或惡性滲出液在catumaxomab存在或缺失下培養24小時。(圖17a-d)通過流式細胞術測定cd8+t細胞上活化標誌物或t細胞功能標誌物的表達。(圖17e-h)顯示抑制性受體的基線表達的圖。圖18a-r顯示catumaxomab誘導的t細胞活化與抑制性受體的共表達逆相關。將腫瘤消化物或惡性滲出液在catumaxomab存在或缺失下培養24小時。將t細胞活化和效應器功能與pd-1(圖18a-f),tim-3(圖18g-l)或pd-1和tim-3的組合(圖18m-r)的表達關聯起來。圖19a-h顯示非小細胞肺癌患者中的腫瘤浸潤性t細胞上抑制性受體的表達。通過流式細胞術對腫瘤樣品中的cd8+和cd4+t細胞表徵它們的抑制性受體表達(圖19a-f)。圖19g顯示用於一名代表性供體的設門策略。圖19h顯示指定細胞子集基於表達百分比的分析結果和熱圖繪製,使用excel條件格式程序進行。圖20a-e顯示cd3/cd28抗體的多克隆刺激後t細胞活化和效應器功能。分析用激動性cd3和cd28抗體刺激整個腫瘤消化物後來自經過消化的腫瘤樣品的t細胞中分別作為t細胞活化和效應器功能的標誌物的cd25和粒酶b(圖20a-b)以及il-2,ifn-γ和tnf-α(圖20c-e)的表達。圖21a-n顯示抑制性受體的表達和t細胞功能障礙。抗cd3/抗-cd28抗體的多克隆刺激後cd25和粒酶b(圖21a-b)以及il-2,ifn-γ和tnf-α(圖21c-e)的表達與通過ir得分指示的抑制性受體的累積表達有關。圖21f顯示ir得分的一種例示性計算。分析所有nsclc樣品中pd-1,tim-3,ctla-4,lag-3和btla表達的百分比,並確定中值以及四分位間範圍。對於ir得分的計算,每名患者得到每種所測定抑制性受體的表達的點,該點基於表達所佔的四分位。最多能達到15個點;將每份樣品的計算得分針對這個最大點量標準化。圖21g-k顯示抑制性受體的表達隨腫瘤階段而升高。將cd8+腫瘤浸潤性t細胞上抑制性受體的表達與tnm階段關聯起來。圖21l-n顯示升高的抑制性受體累積表達及腫瘤進展。將以ir得分代表的抑制性受體pd-1,tim-3,ctla-4,lag-3和btla的累積表達與節結狀態和tnm階段關聯起來。圖22a-i顯示pd-1和tim-3的表達與t細胞功能障礙有關。cd3/cd28的多克隆刺激後cd25和粒酶b(圖22a-c)以及il-2,ifn-γ和tnf-α(圖22d-f)的表達與腫瘤浸潤性t細胞上pd-1(圖22a-c),tim-3(圖22d-f)或pd-1/tim-3(圖22g-i)的表達有關。圖23a-e顯示pd-1或組合pd-1/tim-3阻斷的影響在患者之間變化。用激動性抗cd3/抗cd28抗體刺激消化物,將阻斷性抗體添加至單獨的或與tim-3組合的pd-1。通過elisa測定ifn-γ,tnf-α和il-2的分泌,並針對1x106個t細胞標準化。圖23a-c顯示來自t細胞功能能通過添加阻斷性抗體(bs-268)來挽救的一名患者的t細胞和來自對pd-1或pd-1/tim-3阻斷沒有響應的一名患者的t細胞。顯示了表達差異([%表達抗體處理的]-[%表達未處理的])。圖23d顯示pd-1高和pd-1中子集各自的流式細胞術圖。圖23e顯示來自六名患者的t細胞的il-2,tnf-α和ifn-γ分泌的匯總,如通過elisa測定並針對1x106個cd3+t細胞標準化的。圖24a-f顯示pd-1或組合pd-1/tim-3阻斷的影響在pd-1高和pd-1中子集中不同。pd-1或組合pd-1/tim-3阻斷引起的細胞因子生成的升高與pd-1高和pd-1中子集的關聯以pd-1高/pd-1中比指示。圖25a-i顯示暴露於folr1-tcb後腫瘤消化物和惡性滲出液中cd4+t細胞的活化。將腫瘤消化物或惡性滲出液在folr1-tcb或對照tcbdp-47存在或缺失下培養24小時。通過流式細胞術測定cd8+t細胞上活化標誌物或t細胞功能標誌物的表達。圖26a-c顯示folr1-tcb誘導的t細胞活化不依賴於ctla-4,lag-3和btla表達。將腫瘤消化物或惡性滲出液在folr1-tcb存在或缺失下培養24小時。通過流式細胞術測定cd8+t細胞上cd25的表達。將folr1-tcb誘導的cd25表達與ctla-4,lag-3和btla的基線表達關聯起來。圖27a-c顯示folr1-tcb僅僅在具有低百分比的pd-1高表達性cd8+t細胞的患者中誘導細胞因子分泌。將腫瘤消化物或惡性滲出液在folr1-tcb存在或缺失下培養24小時。測定細胞培養物上清液中的ifn-γ,tnf和il-2,並針對培養物中1x105個t細胞的量標準化。將folr1-tcb誘導的細胞因子分泌與基線pd-1高表達關聯起來。圖28a-f顯示pd-1阻斷性抗體的處理未能在來自具有pd-1高表達性細胞百分比低的肺和卵巢癌的患者的腫瘤消化物或惡性滲出液中誘導細胞因子分泌。將腫瘤消化物或惡性滲出液與folr1-tcb一起在pd-1阻斷性抗體(圖28a-c)或pd-1和tim-3阻斷性抗體的組合(圖28d-f)存在或缺失下培養24小時。測定細胞培養物上清液中的ifn-γ,tnf和il-2,並針對培養物中1x105個t細胞的量標準化。將與單獨的folr1-tcb處理相比由阻斷性抗體誘導的細胞因子分泌與基線pd-1高表達聯繫起來。圖29a-b顯示來自基於facs的內在化測定法的結果。數據顯示於37℃溫育後抗tim3抗體tim3_0022(縮寫為ab(022))的fab片段(fab)以與完整igg格式的抗體相似的動力學內在化入表達hutim-3的重組chok1細胞。圖30a-b顯示抗tim3抗體對rpmi-8226細胞的結合(抗體名稱克隆0016指抗體tim3_0016,克隆0016指抗體tim3_0016變體(抗體tim3_0018),克隆0022指抗體tim3_00122,等)。圖30b顯示抗tim3抗體對pfeiffer細胞的結合(抗體名稱克隆0016指抗體tim3_0016,克隆0016指抗體tim3_0016變體(抗體tim3_0018),克隆0022指抗體tim3_00122,等)。圖31顯示不同患者aml細胞樣品上tim-3的表達水平,根據使用抗tim-3單抗的facs。圖32顯示nsclc上與til有關的抑制性受體表達的熱圖。對指定免疫檢查點呈陽性的腫瘤浸潤性cd8+t細胞上抑制性受體的共表達以熱圖顯示,展示另外的受體的表達的百分比。圖33顯示nsclc上與til有關的抑制性受體表達的雷達圖。對指定免疫檢查點呈陽性的腫瘤浸潤性cd8+t細胞上抑制性受體的共表達以雷達圖顯示,指示四種其它受體的均值表達和標準偏差。圖34a-d顯示表達另外的免疫檢查點的pd-1高或pd-1中cd8+t細胞的百分比。每個點代表一份患者樣品。p值是使用wilcoxon秩和檢驗計算的。圖35a-f顯示腫瘤內t細胞抑制性受體表達和t細胞功能。圖35a顯示用於鑑定來自兩名代表性患者的t細胞的pd-1高,pd-1中,和pd-1陰性cd8+子集的設門策略。圖35b顯示所分析的腫瘤樣品中指定t細胞子集的分布。圖35c顯示通過抗cd3/cd28刺激誘導的t細胞功能取決於cd8+t細胞的pd-1表達水平。將腫瘤消化物和惡性滲出液在激動性抗cd3/cd28抗體存在或缺失下培養24小時。測定pd-1高貧乏和豐富腫瘤中cd8+t細胞上cd25表達的升高(圖35c)和效應器細胞因子ifn-γ,il-2,和tnf的升高(圖35d)。p值是使用不配對mann-whitney檢驗計算的。腫瘤樣品依照pd-1高表達性cd8+細胞的百分比分成分別具有pd-1高貧乏和豐富表達的兩組(圖35e)。通過流式細胞術測定來自腫瘤消化物或惡性滲出液的cd8+t細胞上抑制性受體pd-1,tim-3,ctla-4,lag-3,和btla的表達水平(圖35f)。圖36a-e顯示貧乏和豐富cd8+t細胞的抑制性受體表達樣式和百分比。圖36a-d顯示pd-1高,pd-1中,和pd-1陰性cd8+t細胞上tim-3,ctla-4,lag-3,和btla的共表達。p值是使用單因素anova及bonferroni事後檢驗計算的。圖36e:folr1+腫瘤樣品依照pd-1高表達cd8+細胞的百分比分成分別具有pd-1高貧乏和豐富表達的兩組。圖37a-h顯示folr1-tcb誘導的t細胞功能取決於cd8+t細胞的pd-1表達水平。將folr1+腫瘤消化物和惡性滲出液在folr1-tcb存在或缺失下培養24小時。在pd-1高貧乏和豐富的腫瘤中測定cd8+t細胞上活化標誌物表達的升高(圖37a-c)和效應器細胞因子ifn-γ,il-2,tnf,和穿孔素的升高(圖37d-g)。圖37h顯示靶細胞殺傷。通過添加folr1+skov3細胞系至e:t比1:1來調整folr1陽性和陰性腫瘤樣品二者,並比較pd-1高貧乏和豐富腫瘤中的殺傷。p值是使用不配對mann-whitney檢驗計算的。圖38a-e顯示pd-1阻斷僅僅提高來自pd-1高貧乏腫瘤的t細胞中的細胞因子生成而非它們的溶胞功能。圖38a-d:將folr1+腫瘤消化物或惡性滲出液與folr1-tcb一起在pd-1阻斷性抗體存在或缺失下培養24小時。通過細胞術珠陣列(cytometricbeadarray)或elisa測定細胞培養物上清液中的ifn-γ,il-2,tnf,和穿孔素,並針對1x105個cd3+t細胞(ifn-γ,il-2,tnf,圖38a-c)或cd3+cd8+t細胞(穿孔素,圖38d)的量標準化。測定pd-1高貧乏和豐富腫瘤中組合folr1-tcb和抗pd-1處理後細胞因子分泌與單獨的folr1-tcb相比的升高。圖38e:將腫瘤消化物或惡性滲出液與外源添加的螢光標記的skov3細胞一起以e:t比1:1在pd-1阻斷性抗體和folr1-tcb存在或缺失下共培養24小時。比較pd-1高貧乏和豐富腫瘤中抗pd-1抗體所致特異性殺傷的升高。p值是使用不配對mann-whitney檢驗計算的。圖39顯示詳細的患者特徵。圖40a-c顯示暴露於漸增濃度的folr1-tcb後cd8+t細胞的活化。將pbmc與skov3細胞一起在folr1-tcb或非特異性對照dp-47-tcb存在或缺失下共培養24小時。圖40a顯示skov3上folr1的表達。陰影柱狀圖:同種型對照;空心柱狀圖:抗folr1抗體。圖40b:通過流式細胞術測定cd8+t細胞上活化標誌物cd25,cd137,和icos的表達。圖40c:通過elisa測定細胞培養物上清液中的ifn-γ,il-2,和tnf,並針對1x105個cd3+t細胞的量標準化。發明詳述i.定義出於本文中的目的,「受體人框架」指包含自人免疫球蛋白框架或如下文定義的人共有框架衍生的輕鏈可變域(vl)框架或重鏈可變域(vh)框架的胺基酸序列的框架。自人免疫球蛋白框架或人共有框架「衍生」的受體人框架可以包含其相同的胺基酸序列,或者它可以含有胺基酸序列變化。在一些實施方案中,胺基酸變化的數目是10或更少,9或更少,8或更少,7或更少,6或更少,5或更少,4或更少,3或更少,或2或更少。在一些實施方案中,vl受體人框架與vl人免疫球蛋白框架序列或人共有框架序列在序列上相同。「親和力」指分子(例如抗體)的單一結合位點與其結合配偶體(例如抗原)之間全部非共價相互作用總和的強度。除非另有指示,如本文中使用的,「結合親和力」指反映結合對的成員(例如抗體和抗原)之間1:1相互作用的內在結合親和力。分子x對其配偶體y的親和力通常可以用解離常數(kd)來表述。親和力可以通過本領域知道的常用方法來測量,包括本文中所描述的方法。下文描述了用於測量結合親和力的具體的說明性和例示性的實施方案。「親和力成熟的」抗體指在一個或多個高變區(hvr)中具有一處或多處改變的抗體,與不擁有此類改變的親本抗體相比,此類改變導致該抗體對抗原的親和力改善。術語「特異性結合葉酸受體1(folr1)和cd3的雙特異性抗體」,「對folr1和cd3特異性的t細胞活化性雙特異性抗原結合分子」和「folr1tcb」在本文中可互換使用,而且指如下的雙特異性抗體,其能夠以足夠親和力結合folr1和cd3,使得該抗體可用作將cd3+t細胞靶向folr2+靶細胞的治療劑和/或診斷劑。術語「抗tim3抗體」和「tim3抗體」在本文中同義地用來指特異性結合tim3的抗體。本文中描述的抗tim3抗體指如下的抗體,其能夠以足夠親和力結合tim3,尤其是在細胞表面上表達的tim3多肽,使得該抗體可用作診斷劑和/或治療劑。在一個實施方案中,特異性結合tim3的抗體結合無關非tim3蛋白質的程度小於該抗體對tim3的結合的約10%,如例如通過放射免疫測定法(ria)或流式細胞術(facs)測量的。在某些實施方案中,特異性結合tim3的抗體具有≤1μm,≤100nm,≤10nm,≤1nm,≤0.1nm,≤0.01nm,或≤0.001nm(例如10-8m或更少,例如10-8m至10-13m,例如,10-9m至10-13m)的解離常數(kd)。在某些實施方案中,特異性結合tim3的抗體結合在來自不同物種的dr5間保守的tim3表位。優選地,所述抗體結合人和獼猴tim3。術語「特異性結合tim3的抗體」還涵蓋能夠結合tim3和第二抗原的雙特異性抗體。本文中的術語「抗體」以最廣義使用,並且涵蓋各種抗體結構,包括但不限於單克隆抗體,多克隆抗體,多特異性抗體(例如雙特異性抗體),和抗體片段,只要它們展現出期望的抗原結合活性。「抗體片段」指與完整抗體不同的分子,其包含完整抗體中的如下部分,該部分結合完整抗體所結合的抗原。抗體片段的例子包括但不限於fv,fab,fab』,fab』-sh,f(ab』)2;雙抗體;cross-fab片段;線性抗體;單鏈抗體分子(例如scfv);和由抗體片段形成的多特異性抗體。例如,scfv抗體記載於huston,j.s.,methodsinenzymol.203(1991)46-96。另外,抗體片段包含具有vh域或vl域的特徵(即能夠與vl域或vh域一起裝配成功能性抗原結合位點,並且由此提供全長抗體的抗原結合特性)的單鏈多肽。如本文中使用的,「fab片段」指包含輕鏈片段(其包含vl域和輕鏈恆定域(cl))及vh域和重鏈第一恆定域(ch1)的抗體片段。在一個實施方案中,本發明的雙特異性抗體包含至少一個fab片段,其中重和輕鏈的可變區或恆定區任一是交換的。由於可變區或恆定區任一的交換,所述fab片段也稱作「cross-fab」片段或「xfab」片段或「交換fab」片段。交換fab分子的兩種不同鏈組成是可能的且包含在本發明的雙特異性抗體中:一方面,fab重和輕鏈的可變區是交換的,即交換fab分子包含由輕鏈可變區(vl)和重鏈恆定區(ch1)構成的一條肽鏈及由重鏈可變區(vh)和輕鏈恆定區(cl)構成的一條肽鏈。這種交換fab分子也稱作crossfab(vlvh)。另一方面,當fab重和輕鏈的恆定區交換時,交換fab分子包含由重鏈可變區(vh)和輕鏈恆定區(cl)構成的一條肽鏈及由輕鏈可變區(vl)和重鏈恆定區(ch1)構成的一條肽鏈。這種交換fab分子也稱作crossfab(clch1)。包含交換fab片段的雙特異性抗體型式已有描述,例如在wo2009/080252,wo2009/080253,wo2009/080251,wo2009/080254,wo2010/136172,wo2010/145792和wo2013/026831中。「單鏈fab片段」或「scfab」是由抗體重鏈可變域(vh),抗體恆定域1(ch1),抗體輕鏈可變域(vl),抗體輕鏈恆定域(cl)和接頭組成的多肽,其中所述抗體域和所述接頭n端至c端方向具有下述次序之一:a)vh-ch1-接頭-vl-cl,b)vl-cl-接頭-vh-ch1,c)vh-cl-接頭-vl-ch1或d)vl-ch1-接頭-vh-cl;且其中所述接頭是至少30個胺基酸,優選介於32和50個胺基酸之間的多肽。所述單鏈fab片段a)vh-ch1-接頭-vl-cl,b)vl-cl-接頭-vh-ch1,c)vh-cl-接頭-vl-ch1和d)vl-ch1-接頭-vh-cl經cl域和ch1域之間的天然二硫鍵穩定化。另外,通過經插入半胱氨酸殘基(例如可變重鏈中的位置44和可變輕鏈中的位置100,依照kabat編號方式)生成鏈間二硫鍵可以進一步穩定化這些單鏈fab分子。術語「n端」表示n端最後一個胺基酸,術語「c端」表示c端最後一個胺基酸。「融合」或「連接」表示各成分(例如fab分子和fc域亞基)是通過肽鍵相連接的,或是直接的或是經由一個或多個肽接頭。如本文中使用的,術語「接頭」指肽接頭且優選是具有長度為至少5個胺基酸,優選長度為5-100個,更優選10-50個胺基酸的胺基酸序列的肽。在一個實施方案中,所述肽接頭是(gxs)n(seqidno:384和385)或(gxs)ngm(seqidno:429和430),其中g=甘氨酸,s=絲氨酸,且(x=3,n=3,4,5或6且m=0,1,2或3)或(x=4且n=2,3,4或5且m=0,1,2或3),優選地x=4且n=2或3,更優選地x=4且n=2。在一個實施方案中,所述肽接頭是(g4s)2(seqidno:386)。術語「免疫球蛋白分子」指具有天然存在的抗體結構的蛋白質。例如,igg類的免疫球蛋白是約150,000道爾頓的異四聚體糖蛋白,其由二硫鍵連接的兩條輕鏈和兩條重鏈構成。從n端至c端,每條重鏈具有可變區(vh),也稱為可變重域或重鏈可變域,接著是3個恆定域(ch1,ch2和ch3),也稱為重鏈恆定區。類似地,從n端至c端,每條輕鏈具有可變區(vl),也稱為可變輕域或輕鏈可變域,接著是恆定輕(cl)域(也稱為輕鏈恆定區)。免疫球蛋白的重鏈可以歸入稱為α(iga),δ(igd),ε(ige),γ(igg)或μ(igm)的5類之一,其中一些可以進一步分成亞類,例如γ1(igg1),γ2(igg2),γ3(igg3),γ4(igg4),α1(iga1)和α2(iga2)。基於其恆定域的胺基酸序列,免疫球蛋白的輕鏈可以歸入稱為卡帕(κ)和拉姆達(λ)的兩類之一。免疫球蛋白基本由經由免疫球蛋白鉸鏈區連接的兩個fab分子和fc域組成。與參照抗體「結合相同表位的抗體」指在競爭測定法中將參照抗體對其抗原的結合阻斷50%或更多的抗體,且相反,參照抗體在競爭測定法中將該抗體對其抗原的結合阻斷50%或更多。本文中提供了例示性的競爭測定法。術語「抗原結合域」指抗原結合分子中包含特異性結合部分或整個抗原並與部分或整個抗原互補的區域的部分。在抗原較大的情況中,抗原結合分子可以僅結合抗原的特定部分,該部分稱作表位。抗原結合域可以由例如一個或多個抗體可變域(也稱作抗體可變區)提供。優選地,抗原結合域包含抗體輕鏈可變區(vl)和抗體重鏈可變區(vh)。術語「嵌合」抗體指其中重和/或輕鏈的一部分自特定的來源或物種衍生,而重和/或輕鏈的剩餘部分自不同來源或物種衍生的抗體,其通常通過重組dna技術來製備。包含家兔可變區和人恆定區的嵌合抗體是優選的。本發明涵蓋的「嵌合抗體」的其它優選形式是那些其中恆定區已經自初始抗體的恆定區修飾或改變以生成依照本發明的特性(特別地關於c1q結合/或fc受體(fcr)結合)的。此類嵌合抗體又稱為「類轉換抗體」。嵌合抗體是包含編碼免疫球蛋白可變區的dna區段和編碼免疫球蛋白恆定區的dna區段的免疫球蛋白基因的表達產物。用於生成嵌合抗體的方法牽涉常規的重組dna和基因轉染技術,其是本領域中公知的。參見例如morrison,s.l.等,proc.natl.acad.sci.usa81(1984)6851-6855;美國專利no.5,202,238和5,204,244。在用於本文時,術語「細胞毒劑」指抑制或阻止細胞功能和/或引起細胞死亡或破壞的物質。細胞毒劑包括但不限於:放射性同位素(例如at211,i131,i125,y90,re186,re188,sm153,bi212,p32,pb212和lu的放射性同位素);化學治療劑或藥物(例如甲氨蝶呤(methotrexate),阿黴素(adriamicin),長春花生物鹼類(vincaalkaloids)(長春新鹼(vincristine),長春鹼(vinblastine),依託泊苷(etoposide)),多柔比星(doxorubicin),美法侖(melphalan),絲裂黴素(mitomycin)c,苯丁酸氮芥(chlorambucil),柔紅黴素(daunorubicin)或其它嵌入劑);生長抑制劑;酶及其片段,諸如溶核酶;抗生素;毒素,諸如小分子毒素或者細菌,真菌,植物或動物起源的酶活性毒素,包括其片段和/或變體;及下文公開的各種抗腫瘤或抗癌劑。「效應器功能」指那些可歸於抗體fc區且隨抗體同種型而變化的生物學活性。抗體效應器功能的例子包括:c1q結合和補體依賴性細胞毒性(cdc),fc受體結合,抗體依賴性細胞介導的細胞毒性(adcc),抗體依賴性細胞吞噬作用(adcp),細胞因子分泌,免疫複合物介導的抗原呈遞細胞的抗原攝取,細胞表面受體(例如b細胞受體)下調和b細胞活化。如本文中使用的,術語「工程化」視為包括對肽主鏈的任何操作或對天然存在或重組的多肽或其片段的翻譯後修飾。工程化包括對胺基酸序列,糖基化模式或各胺基酸側鏈基團的修飾,以及這些辦法的組合。如本文中使用的,術語「胺基酸突變」意為涵蓋胺基酸替代,缺失,插入和修飾。可以進行取代,缺失,插入和修飾的任意組合來實現最終構建體,只要最終構建體擁有期望的特性,例如降低的對fc受體的結合,或與另一種肽的增加的聯合。胺基酸序列缺失和插入包括氨基和/或羧基端缺失和胺基酸插入。具體的胺基酸突變是胺基酸替代。為了改變例如fc區的結合特徵,特別優選非保守性的胺基酸替代,即將一個胺基酸用具有不同結構和/或化學特性的另一種胺基酸替換。胺基酸替代包括由非天然存在的胺基酸或由20種標準胺基酸的天然存在的胺基酸衍生物(例如4-羥脯氨酸,3-甲基組氨酸,鳥氨酸,高絲氨酸,5-羥賴氨酸)替換。可以使用本領域中公知的遺傳或化學方法生成胺基酸突變。遺傳方法可以包括定點誘變,pcr,基因合成等。通過與遺傳工程化不同的方法如化學修飾來改變胺基酸側鏈基團的方法也可能可用。本文中可使用各種名稱來指示同一胺基酸突變。例如,從fc域第329位脯氨酸到甘氨酸的取代可指示為329g,g329,g329,p329g或pro329gly。藥劑(例如藥物配製劑)的「有效量」指在必需的劑量和時段上有效實現期望的治療或預防結果的量。本文中術語「fc域」或「fc區」用於定義免疫球蛋白重鏈中至少含有恆定區的一部分的c端區域。該術語包括天然序列fc區和變體fc區。雖然igg重鏈的fc區的邊界可以略微變化,但是人igg重鏈fc區通常定義為自cys226或pro230延伸至重鏈的羧基端。然而,可以存在或不存在fc區的c端賴氨酸(lys447)。除非本文中另外指定,fc區或恆定區中胺基酸殘基的編號方式依照eu編號系統,也稱為eu索引,如記載於kabat等,sequencesofproteinsofimmunologicalinterest,第5版publichealthservice,nationalinstitutesofhealth,bethesda,md,1991的。如本文中使用的,fc域的「亞基」指形成二聚體fc域的兩個多肽之一,即包含免疫球蛋白重鏈中能夠穩定自身聯合的c端恆定區的多肽。例如,iggfc域的亞基包含iggch2和iggch3恆定域。「促進fc域的第一和第二亞基聯合的修飾」是降低或防止包含fc域亞基的多肽與相同多肽聯合以形成同二聚體的肽主鏈操作或fc域亞基的翻譯後修飾。如本文中使用的,具體地,促進聯合的修飾包括對期望聯合的兩個fc域亞基(即fc域的第一和第二亞基)中的每一個進行的分開的修飾,其中所述修飾彼此互補,從而促進兩個fc域亞基的聯合。例如,促進聯合的修飾可以改變一種或兩種fc域亞基的結構或電荷,從而在立體或靜電上分別促進它們的聯合。如此,異二聚化在包含第一fc域亞基的多肽和包含第二fc域亞基的多肽之間發生,其在融合至每個亞基的別的組分(例如抗原結合模塊)不同這一意義上講可能是不相同的。在一些實施方案中,促進聯合的修飾包含在fc域中的胺基酸突變,具體為胺基酸替代。在一個具體的實施方案中,促進聯合的修飾包含fc域的兩個亞基的每一個中分開的胺基酸突變,具體為胺基酸替代。「框架」或「fr」指除高變區(hvr)殘基外的可變域殘基。一般地,可變域的fr由4個fr域組成:fr1,fr2,fr3,和fr4。因而,hvr和fr序列在vh(或vl)中一般以如下的順序出現:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。術語「全長抗體」,「完整抗體」,和「全抗體」在本文中可互換使用,指與天然抗體結構具有基本上類似的結構或者具有含有如本文中所限定的fc區的重鏈的抗體。術語「宿主細胞」,「宿主細胞系」,和「宿主細胞培養物」可互換使用,並且指已經導入外源核酸的細胞,包括此類細胞的後代。宿主細胞包括「轉化體」和「經轉化的細胞」,其包括原代的經轉化的細胞及自其衍生的後代而不考慮傳代的次數。後代在核酸內容物上可以與親本細胞不完全相同,而是可以含有突變。本文中包括具有與在初始轉化細胞中篩選或選擇的相同功能或生物學活性的突變體後代。「人抗體」指擁有與由人或人細胞生成的或利用人抗體全集或其它人抗體編碼序列自非人來源衍生的抗體的胺基酸序列對應的胺基酸序列的抗體。人抗體的此定義明確排除包含非人抗原結合殘基的人源化抗體。正如關於依照本發明的嵌合和人源化抗體也提及的,如本文中使用的,術語「人抗體」也包含恆定區中經過修飾以生成依照本發明的特性的此類抗體,尤其在c1q結合和/或fcr結合方面,例如通過「類轉換」即fc部分的改變或突變(例如自igg1至igg4和/或igg1/igg4突變)。如本文中所使用的,術語「重組人抗體」意圖包括通過重組手段製備,表達,創建或分離的所有人抗體,諸如自宿主細胞諸如ns0或cho細胞或者自對於使用轉染入宿主細胞中的重組表達載體表達的人免疫球蛋白基因或抗體而言轉基因的動物(例如小鼠)分離的抗體。此類重組人抗體具有重排形式的可變和恆定區。依照本發明的重組人抗體已經進行過體內體細胞超突變。如此,重組抗體的vh和vl區的胺基酸序列是雖然自人種系vh和vl序列衍生及與其相關,但可以不天然存在於體內的人抗體種系全集內的序列。「人共有框架」指代表人免疫球蛋白vl或vh框架序列選集中最常存在的胺基酸殘基的框架。通常,人免疫球蛋白vl或vh序列選集來自可變域序列亞組。通常,序列亞組是如kabat等,sequencesofproteinsofimmunologicalinterest,第五版,nihpublication91-3242,bethesdamd(1991),第1-3卷中的亞組。在一個實施方案中,對於vl,亞組是如kabat等,見上文中的亞組κi。在一個實施方案中,對於vh,亞組是如kabat等,見上文中的亞組iii。「人源化」抗體指包含來自非人hvr的胺基酸殘基和來自人fr的胺基酸殘基的嵌合抗體。在某些實施方案中,人源化抗體會包含至少一個,通常兩個基本上整個可變域,其中所有或基本上所有hvr(例如,cdr)對應於非人抗體的那些,且所有或基本上所有fr對應於人抗體的那些。任選地,人源化抗體可以至少包含自人抗體衍生的抗體恆定區的一部分。抗體(例如非人抗體)的「人源化形式」指已經經歷人源化的抗體。本發明涵蓋的「人源化抗體」的其它形式是那些其中的恆定區已經另外自初始抗體的恆定區進行過修飾或改變以生成依照本發明的特性(特別地關於c1q結合/或fc受體(fcr)結合)的。在用於本文時,術語「高變區」或「hvr」指抗體可變域中在序列上高變的和/或形成結構上限定的環(「高變環」)的每個區。一般地,天然的4鏈抗體包含6個hvr;三個在vh中(h1,h2,h3),且三個在vl中(l1,l2,l3)。hvr一般包含來自高變環和/或來自「互補決定區」(cdr)的胺基酸殘基,後一種是最高序列變異性的和/或牽涉抗原識別。例示性高變環存在於胺基酸殘基26-32(l1),50-52(l2),91-96(l3),26-32(h1),53-55(h2),和96-101(h3)(chothiaandlesk,j.mol.biol.196:901-917(1987))。例示性cdr(cdr-l1,cdr-l2,cdr-l3,cdr-h1,cdr-h2和cdr-h3)存在於胺基酸殘基24-34(l1),50-56(l2),89-97(l3),31-35b(h1),50-65(h2),和95-102(h3)(kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md(1991))。高變區(hvr)也稱作互補決定區(cdr),而且這些術語在述及形成抗原結合區的可變區部分時在本文中可交換使用。此特定區域已由kabat等,u.s.dept.ofhealthandhumanservices,sequencesofproteinsofimmunologicalinterest(1983)及由chothia等,jmolbiol196:901-917(1987)描述,其中定義包括在彼此比較時胺基酸殘基的重疊或子集。然而,應用任一種定義來指抗體或其變體的cdr意圖在如本文中定義和使用的術語的範圍內。涵蓋如由上文引用的每篇參考文獻定義的cdr的適宜的胺基酸殘基在下表a中列出作為比較。涵蓋特定cdr的確切殘基編號將隨著cdr的序列和大小而變化。鑑於抗體的可變區胺基酸序列,本領域技術人員可以常規確定哪些殘基構成特定cdr。表a:cdr定義11表a中所有cdr定義的編號方式依照由kabat等(見下文)提出的編號慣例。2如表a中使用的具有小寫字母「b」的「abm」指由oxfordmolecular的「abm」抗體建模軟體定義的cdr。kabat等還定義針對可變區序列的編號系統,其可應用於任何抗體。本領域的普通技術人員可以明確地將此「kabat編號」系統用於任何可變區序列,不依賴於序列本身外的任何實驗數據。如本文中使用的,「kabat編號方式」指由kabat等,u.s.dept.ofhealthandhumanservices,「sequenceofproteinsofimmunologicalinterest」(1983)提出的編號系統。除非另外說明,提及抗體可變區中特定胺基酸殘基位置的編號方式依照kabat編號系統。除了vh中的cdr1外,cdr一般包含形成高變環的胺基酸殘基。cdr還包含「特異性決定殘基」,或「sdr」,其是接觸抗原的殘基。sdr包含在稱作縮短的-cdr,或a-cdr的cdr區內。例示性的a-cdr(a-cdr-l1,a-cdr-l2,a-cdr-l3,a-cdr-h1,a-cdr-h2,和a-cdr-h3)存在於l1的胺基酸殘基31-34,l2的50-55,l3的89-96,h1的31-35b,h2的50-58,和h3的95-102(見almagro和fransson,front.biosci.13:1619-1633(2008))。除非另有指示,可變域中的hvr殘基和其它殘基(例如,fr殘基)在本文中依照kabat等,見上文編號。「免疫綴合物」指與一種或多種異源分子(包括但不限於細胞毒劑)綴合的抗體。「個體」或「受試者」是哺乳動物。哺乳動物包括但不限於馴養的動物(例如,牛,綿羊,貓,犬,和馬),靈長類(例如,人和非人靈長類諸如猴),家兔,和嚙齒類(例如,小鼠和大鼠)。在某些實施方案中,個體或受試者是人。「分離的」抗體指已經與其天然環境的組分分開的抗體。在一些實施方案中,抗體純化至大於95%或99%的純度,如通過例如電泳(例如,sds-page,等電聚焦(ief),毛細管電泳)或層析(例如,離子交換或反相hplc)測定的。關於用於評估抗體純度的方法的綜述,見例如flatman等,j.chromatogr.b848:79-87(2007)。「分離的」的核酸指已經與其天然環境的組分分開的核酸分子。分離的核酸包括通常含有核酸分子的細胞中含有的核酸分子,但是核酸分子在染色體外或在與其天然染色體位置不同的染色體位置處存在。「編碼特異性結合dr5和fap的雙特異性抗體的分離的核酸」指編碼抗體重和輕鏈(或其片段)的一種或多種核酸分子,包括單一載體或分開的載體中的此類核酸分子,和存在於宿主細胞中的一個或多個位置的此類核酸分子。如本文中使用的,術語「單克隆抗體」指從一群基本上同質的抗體獲得的抗體,即構成群體的各個抗體是相同的和/或結合相同表位,除了例如含有天然存在的突變或在單克隆抗體製備物的生成期間發生的可能的變體抗體外,此類變體一般以極小量存在。與通常包含針對不同決定簇(表位)的不同抗體的多克隆抗體製備物不同,單克隆抗體製備物的每個單克隆抗體針對抗原上的單一決定簇。如此,修飾語「單克隆」指示抗體自一群基本上同質的抗體獲得的特性,而不應解釋為要求通過任何特定方法來生成抗體。例如,可以通過多種技術來生成要依照本發明使用的單克隆抗體,包括但不限於雜交瘤方法,重組dna方法,噬菌體展示方法,和利用含有所有或部分人免疫球蛋白基因座的轉基因動物的方法,本文中描述了用於生成單克隆抗體的此類方法和其它例示性方法。「裸抗體」指未與異源模塊(例如細胞毒性模塊)或放射性標記物綴合的抗體。裸抗體可以存在於藥物配製劑中。「天然抗體」指具有不同結構的天然存在的免疫球蛋白分子。例如,天然igg抗體是約150,000道爾頓的異四聚糖蛋白,由二硫化物鍵合的兩條相同輕鏈和兩條相同重鏈構成。從n至c端,每條重鏈具有一個可變區(vh),又稱作可變重域或重鏈可變域,接著是三個恆定域(ch1,ch2,和ch3)。類似地,從n至c端,每條輕鏈具有一個可變區(vl),又稱作可變輕域或輕鏈可變域,接著是一個恆定輕(cl)域。根據其恆定域胺基酸序列,抗體輕鏈可歸入兩種類型中的一種,稱作卡帕(κ)和拉姆達(λ)。「阻斷性」抗體或「拮抗性」抗體是抑制或降低其結合的抗原的生物學活性的抗體。在一些實施方案中,阻斷性抗體或拮抗性抗體實質性或完全抑制抗原的生物學活性。例如,本發明的抗pd-l1抗體阻斷經由pd-1的信號傳導,使得將t細胞的功能性應答(例如增殖,細胞因子生成,靶細胞殺傷)從功能障礙狀態恢復至抗原刺激。「激動性」或活化性抗體是通過與其結合的抗原增強或啟動信號傳導的抗體。在一些實施方案中,激動性抗體在不存在天然配體的情況中引起或激活信號傳導。術語「包裝插頁」用於指治療產品的商業包裝中通常包含的用法說明書,其含有關於涉及此類治療產品應用的適應症,用法,劑量,施用,聯合療法,禁忌症和/或警告的信息。「沒有實質性交叉反應性」意指分子(例如,抗體)不識別或特異性結合與該分子的實際靶抗原不同的抗原(例如與靶抗原密切相關的抗原),特別地在與該靶抗原相比時。例如,抗體可以結合少於約10%至少於約5%的與實際靶抗原不同的抗原,或者可以以由少於約10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%,0.2%,或0.1%組成的量結合所述與實際靶抗原不同的抗原,優選地少於約2%,1%,或0.5%,且最優選地少於約0.2%或0.1%與實際靶抗原不同的抗原。關於參照多肽序列的「百分比(%)胺基酸序列同一性」定義為比對序列並在必要時引入缺口以獲取最大百分比序列同一性後,且不將任何保守替代視為序列同一性的一部分時,候選序列中與參照多肽序列中的胺基酸殘基相同的胺基酸殘基的百分率。為測定百分比胺基酸序列同一性目的的對比可以以本領域技術範圍內的多種方式進行,例如使用公眾可得到的計算機軟體,諸如blast,blast-2,align或megalign(dnastar)軟體。本領域技術人員能決定用於比對序列的合適參數,包括對所比較序列全長獲得最大對比所需的任何算法。然而,為了本發明的目的,%胺基酸序列同一性值是使用序列比較電腦程式align-2產生的。align-2序列比較電腦程式由genentech,inc.編寫,並且原始碼已經連同用戶文檔一起提交給美國版權局(uscopyrightoffice,washingtond.c.,20559),在那裡其以美國版權註冊號txu510087註冊。公眾自genentech,inc.,southsanfrancisco,california可獲得align-2程序,或者可以從原始碼編譯。align-2程序應當編譯成在unix作業系統,包括數碼unixv4.0d上使用。所有序列比較參數由align-2程序設定且不變。在採用align-2來比較胺基酸序列的情況中,給定胺基酸序列a相對於(to),與(with),或針對(against)給定胺基酸序列b的%胺基酸序列同一性(或者可表述為具有或包含相對於,與,或針對給定胺基酸序列b的某一%胺基酸序列同一性的給定胺基酸序列a)如下計算:分數x/y乘100其中x是由序列比對程序align-2在該程序的a和b比對中評分為相同匹配的胺基酸殘基數,且其中y是b中的胺基酸殘基總數。應當領會,若胺基酸序列a的長度與胺基酸序列b的長度不相等,則a相對於b的%胺基酸序列同一性將不等於b相對於a的%胺基酸序列同一性。除非另有明確說明,本文中所使用的所有%胺基酸序列同一性值都是依照上一段所述,使用align-2電腦程式獲得的。術語「藥物配製劑」指處於如下的製劑,其形式使得容許其中含有的活性成分的生物學活性是有效的,且不含對會接受配製劑施用的受試者具有不可接受的毒性的別的組分。「藥學可接受載體」指藥物配製劑中與活性成分不同的,且對受試者無毒的成分。藥學可接受載體包括但不限於緩衝劑,賦形劑,穩定劑,或防腐劑。術語「pd-1軸結合拮抗劑」指一種抑制pd-1軸結合配偶與一種或多種其結合配偶的相互作用,使得消除源自pd-1信號傳導軸上的信號傳導的t細胞功能障礙(結果是恢復或增強t細胞功能(例如增殖,細胞因子生成,靶細胞殺傷))的分子。如本文中使用的,pd-1軸結合拮抗劑包括pd-1結合拮抗劑,pd-l1結合拮抗劑和pd-l2結合拮抗劑。術語「pd-1結合拮抗劑」指一種降低,阻斷,抑制,消除或幹擾源自pd-1與一種或多種其結合配偶,諸如pd-l1,pd-l2的相互作用的信號轉導的分子。在一些實施方案中,pd-1結合拮抗劑是一種抑制pd-1與其結合配偶結合的分子。在一個具體的方面,pd-1結合拮抗劑抑制pd-1與pd-l1和/或pd-l2的結合。例如,pd-1結合拮抗劑包括降低,阻斷,抑制,消除或幹擾源自pd-1與pd-l1和/或pd-l2相互作用的信號轉導的抗pd-1抗體,其抗原結合片段,免疫粘附素,融合蛋白,寡肽和其它分子。在一個實施方案中,pd-1結合拮抗劑降低負共刺激信號,從而使功能障礙t細胞不太有功能障礙(例如增強對抗原識別的效應器應答),所述負共刺激信號經由pd-1由或經由t淋巴細胞上表達的細胞表面蛋白介導的信號傳導介導。在一些實施方案中,pd-1結合拮抗劑是抗pd-1抗體。在一個具體的方面,pd-1結合拮抗劑是本文中描述的mdx-1106。在另一個具體的方面,pd-1結合拮抗劑是本文中描述的merck3745。在另一個具體的方面,pd-1結合拮抗劑是本文中描述的ct-011。術語「pd-l1結合拮抗劑」指一種降低,阻斷,抑制,消除或幹擾源自pd-l1與一種或多種其結合配偶,諸如pd-1,b7-1的相互作用的信號轉導的分子。在一些實施方案中,pd-l1結合拮抗劑是抑制pd-l1與其結合配偶結合的分子。在一個具體的方面,pd-l1結合拮抗劑抑制pd-l1與pd-1和/或b7-1的結合。在一些實施方案中,pd-l1結合拮抗劑包括降低,阻斷,抑制,消除或幹擾源自pd-l1與一種或多種其結合配偶,諸如pd-1,b7-1的相互作用的信號轉導的抗pdl1抗體,其抗原結合片段,免疫粘附素,融合蛋白,寡肽和其它分子。在一個實施方案中,pd-l1結合拮抗劑降低負共刺激信號,從而使功能障礙t細胞不太有功能障礙(例如增強對抗原識別的效應器應答),所述負共刺激信號經由pd-l1由或經由t淋巴細胞上表達的細胞表面蛋白介導的信號傳導介導。在一些實施方案中,pd-l1結合拮抗劑是抗pd-l1抗體。在一個具體的方面,抗pd-l1抗體是本文中描述的yw243.55.s70。在另一個具體的方面,抗pd-l1抗體是本文中描述的mdx-1105。在仍有另一個具體的方面,抗pdl1抗體是本文中描述的mpdl3280a。如本文中使用的,術語「pd-l2結合拮抗劑」指一種降低,阻斷,抑制,消除或幹擾源自pd-l2與一種或多種其結合配偶,諸如pd-1的相互作用的信號轉導的分子。在一些實施方案中,pd-l2結合拮抗劑是抑制pd-l2與其結合配偶結合的分子。在一個具體的方面,pd-l2結合拮抗劑抑制pd-l2與pd-1的結合。在一些實施方案中,pd-l2拮抗劑包括降低,阻斷,抑制,消除或幹擾源自pd-l2與一種或多種其結合配偶,諸如pd-1的相互作用的信號轉導的抗pdl2抗體,其抗原結合片段,免疫粘附素,融合蛋白,寡肽和其它分子。在一個實施方案中,pd-l2結合拮抗劑降低負共刺激信號,從而使功能障礙t細胞不太有功能障礙(例如增強對抗原識別的效應器應答),所述負共刺激信號經由pd-l2由或經由t淋巴細胞上表達的細胞表面蛋白介導的信號傳導介導。在一些實施方案中,pd-l2結合拮抗劑是免疫粘附素。「pd-1寡肽」,「pd-l1寡肽」,或「pd-l2寡肽」是分別結合(優選特異性結合)pd-1,pd-l1或pd-l2負共刺激多肽的寡肽,分別包括受體,配體或信號傳導組分,如本文中描述的。此類寡肽可以使用已知的寡肽合成技術化學合成或者可以使用重組技術製備並純化。此類寡肽的長度通常是至少約5個胺基酸,或者長度為至少約6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,或100個胺基酸或更多。可以使用公知的技術鑑定此類寡肽。在這點上,注意到用於對寡肽文庫篩選能夠特異性結合多肽靶物的寡肽的技術是本領域中公知的(見例如美國專利no.5,556,762,5,750,373,4,708,871,4,833,092,5,223,409,5,403,484,5,571,689,5,663,143;pct公開文本no.wo84/03506和wo84/03564;geysen等,proc.natl.acad.sci.u.s.a.,81:3998-4002(1984);geysen等,proc.natl.acad.sci.u.s.a.,82:178-182(1985);geysen等,於syntheticpeptidesasantigens,130-149(1986);geysen等,j.immunol.meth.,102:259-274(1987);schoofs等,j.immunol.,140:611-616(1988),cwirla,s.e.等,proc.natl.acad.sci.usa,87:6378(1990);lowman,h.b.等,biochemistry,30:10832(1991);clackson,t.等,nature,352:624(1991);marks,j.d.等,j.mol.biol.,222:581(1991);kang,a.s.等,proc.natl.acad.sci.usa,88:8363(1991),及smith,g.p.,currentopin.biotechnol.,2:668(1991)。術語「無反應性」指源自經由t細胞受體投遞的不完全或不充分信號(例如在缺乏ras活化的情況中胞內ca+2增加)的對抗原刺激的無響應性狀態。t細胞無反應性也可以在缺乏共刺激的情況中在用抗原刺激後發生,生成即使在共刺激的背景中對抗原的隨後活化變得不感受的細胞。無響應性狀態經常可以被白介素-2的存在超越。無反應性t細胞不經歷克隆擴充和/或獲得效應器功能。術語「耗竭」指作為源自在許多慢性感染和癌症期間發生的持續tcr信號傳導的t細胞功能障礙狀態的t細胞耗竭。它與無反應性的區別在於它不經由不完全或缺乏的信號傳導,而是由於持續信號傳導而發生。它以較差的效應器功能,持續的抑制性受體表達和與功能性效應或記憶t細胞的轉錄狀態不同的轉錄狀態限定。耗竭阻止感染和腫瘤的最佳控制。耗竭可以源自外在負調節途徑(例如免疫調節細胞因子)及細胞內在負調節(共刺激)途徑(pd-1,b7-h3,b7-h4,等)二者。「增強t細胞功能」意指誘導,引起或刺激t細胞具有持續或放大的生物學功能,或者恢復或再活化耗竭的或無活性的t細胞。增強t細胞功能的例子包括:相對於幹預前的此類水平,升高的來自cd8+t細胞的γ-幹擾素分泌,升高的增殖,升高的抗原響應性(例如病毒,病原體,或腫瘤清除)。在一個實施方案中,增強的水平是至少50%,或者60%,70%,80%,90%,100%,120%,150%,200%。測量此增強的方式是本領域普通技術人員已知的。「腫瘤免疫」指腫瘤逃避免疫識別和清除的過程。如此,作為治療概念,腫瘤免疫在此類逃避減弱時得到「治療」,並且腫瘤被免疫系統識別並攻擊。腫瘤識別的例子包括腫瘤結合,腫瘤收縮和腫瘤清除。「免疫原性」指特定物質引發免疫應答的能力。腫瘤是免疫原性的,並且增強腫瘤免疫原性有助於通過免疫應答清除腫瘤細胞。增強腫瘤免疫原性的例子包括用抗pdl抗體和me抑制劑處理。「持續應答」指在停止處理後對降低腫瘤生長的持續影響。例如,與施用階段開始時的大小相比,腫瘤大小可以保持為相同或更小。在一些實施方案中,持續應答具有與處理持續時間至少相同的持續時間,處理持續時間的至少1.5倍,2.0倍,2.5倍,或3.0倍長度。如本文中使用的,術語「成纖維細胞活化蛋白(fap)」指來自任何脊椎動物來源,包括哺乳動物諸如靈長類(例如人)和嚙齒類(例如小鼠和大鼠)的任何天然fap,除非另外指明。該術語涵蓋「全長」,未加工的fap以及fap因細胞中的加工所致的任何形式。該術語還涵蓋fap的天然存在變體,例如剪接變體或等位變體。優選地,本發明的抗fap抗體結合fap的胞外域。例示性fap多肽序列的胺基酸序列,包括人fap的序列披露於wo2012/020006。在用於本文時,「治療/處理」(及其語法變型)指試圖改變所治療個體的天然過程的臨床幹預,並且可以為了預防或者在臨床病理學的過程期間實施。治療的期望效果包括但不限於預防疾病的發生或再發生,減輕症狀,減輕/減少疾病的任何直接或間接病理後果,預防轉移,降低疾病進展速率,改善或減輕疾病狀態,和消退或改善的預後。在一些實施方案中,使用本發明的抗體來延遲疾病的形成或減緩疾病的進展。如本文中使用的,術語癌症指增殖性疾病,諸如癌症為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌症,非小細胞肺癌,小細胞肺癌和間皮瘤,包括任何上述癌症的頑固性型式,或一種或多種上述癌症的組合。在一個實施方案中,癌症為結直腸癌症,而且,任選的是,化療劑為伊立替康。在癌症為肉瘤的實施方案中,任選的是,肉瘤為軟骨肉瘤,平滑肌肉瘤,胃腸基質腫瘤,纖維肉瘤,骨肉瘤,脂肪肉瘤或惡性纖維組織細胞瘤。術語「可變區」或「可變域」指抗體重或輕鏈中牽涉抗體結合抗原的域。天然抗體的重鏈和輕鏈可變域(分別為vh和vl)一般具有類似的結構,其中每個域包含4個保守的框架區(fr)和3個高變區(hvr)(見例如kindt等kubyimmunology,第6版,w.h.freemanandco.,第91頁(2007))。單個vh或vl域可以足以賦予抗原結合特異性。此外,可以分別使用來自結合抗原的抗體的vh或vl域篩選互補vl或vh域的文庫來分離結合特定抗原的抗體。見例如,portolano等,j.immunol.150:880-887(1993);clarkson等,nature352:624-628(1991)。如本文中使用的,術語「抗原結合分子」在其最廣義上指特異性結合抗原性決定簇的分子。抗原結合分子的例子是免疫球蛋白及其衍生物,例如片段。術語「抗體的抗原結合位點」在用於本文時指抗體中負責抗原結合的胺基酸殘基。抗體的抗原結合部分包含來自「互補決定區」或「cdr」的胺基酸殘基。「框架」或「fr」區是可變域中那些與本文中定義的高變區殘基不同的區。因此,抗體的輕和重鏈可變域自n至c端包含域fr1,cdr1,fr2,cdr2,fr3,cdr3,和fr4。尤其地,重鏈的cdr3是對抗原結合貢獻最大且限定抗體特性的區。cdr和fr區依照kabatetal.,sequencesofproteinsofimmunologicalinterest,5thed.,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991)的標準定義和/或那些來自「高變環」的殘基來確定。抗體特異性指抗體對抗原的特定表位的選擇性識別。例如,天然抗體是單特異性的。依照本發明的「雙特異性抗體」是具有兩種不同抗原結合特異性的抗體。本發明的抗體是對兩種不同抗原特異性,即作為第一抗原的dr5和作為第二抗原的fap。如本文中使用的,術語「單特異性」抗體表示抗體具有一個或多個結合位點,每個結合相同抗原的相同表位。術語「雙特異性」意指抗原結合分子能夠特異性結合至少兩種不同的抗原性決定簇。通常,雙特異性抗原結合分子包含至少兩種抗原結合位點,其中每種特異於不同的抗原性決定簇。在某些實施方案中,所述雙特異性抗原結合分子能夠同時結合兩種抗原性決定簇,特別是在兩種不同的細胞上表達的兩種抗原性決定簇。本文中提供的抗體是多特異性抗體,例如雙特異性抗體。多特異性抗體指對至少兩種不同位點具有結合特異性的單克隆抗體。本文中提供雙特異性抗體,其具有針對fap和dr5的結合特異性。在某些實施方案中,雙特異性抗體可以結合dr5的兩種不同表位。雙特異性抗體也可以用於將細胞毒劑定位於表達dr5的細胞。可以作為全長抗體或抗體片段製備雙特異性抗體。用於生成多特異性抗體的技術包括但不限於具有不同特異性的兩對免疫球蛋白重鏈-輕鏈對的重組共表達(見milstein和cuello,nature305:537(1983)),wo93/08829,和traunecker等,emboj.10:3655(1991)),和「突起-入-空穴」工程化(見例如美國專利no.5,731,168)。也可以通過用於生成抗體fc-異二聚體分子的工程化靜電操縱效應(wo2009/089004);交聯兩個或更多個抗體或片段(見例如美國專利no.4,676,980,及brennan等,science,229:81(1985));使用亮氨酸拉鏈來生成雙特異性抗體(見例如kostelny等,j.immunol.,148(5):1547-1553(1992));使用用於生成雙特異性抗體片段的「雙抗體」技術(見例如hollinger等,proc.natl.acad.sci.usa,90:6444-6448(1993));及使用單鏈fv(sfv)二聚體(見例如gruber等,j.immunol.,152:5368(1994));及如例如tutt等j.immunol.147:60(1991)中所描述的,製備三特異性抗體來生成多特異性抗體。本文中還包括具有三個或更多個功能性抗原結合位點的工程化改造抗體,包括「章魚抗體」(見例如us2006/0025576a1)。本文中的抗體或片段還包括包含至少一個結合fap或dr5以及另一種不同抗原的抗原結合位點的「雙重作用fab」或「daf」(參見例如us2008/0069820)。如本申請內使用的,術語「效價」或「價」表示抗體分子中存在指定數目的結合位點。如此,術語「二價」,「四價」,和「六價」分別表示抗體分子中存在兩個結合位點,四個結合位點,和六個結合位點。依照本發明的雙特異性抗體至少是「二價」的,而且可以是「三價」的或「多價」的(例如「四價」或「六價」)。本發明的抗體具有兩個或更多個結合位點且是雙特異性的。就是說,該抗體可以是雙特異性的,即使在有超過兩個結合位點的情況中(即該抗體是三價或多價的)。本發明的雙特異性抗體包括例如多價單鏈抗體,雙抗體和三抗體,以及如下的抗體,該抗體具有全長抗體的恆定域結構,對其經一個或多個肽接頭連接別的抗原結合位點(例如單鏈fv,vh域和/或vl域,fab,或(fab)2)。所述抗體可以是來自單一物種的全長,或者是嵌合化的或人源化的。在用於本文時,術語「載體」指能夠增殖與其連接的另一種核酸的核酸分子。該術語包括作為自身複製型核酸結構的載體及併入接受其導入的宿主細胞的基因組中的載體。某些載體能夠指導與其可操作連接的核酸的表達。此類載體在本文中稱為「表達載體」。如本本申請內使用的,術語「胺基酸」表示天然存在的羧基α-胺基酸組,包括丙氨酸(三字母代碼:ala,單字母代碼:a),精氨酸(arg,r),天冬醯胺(asn,n),天冬氨酸(asp,d),半胱氨酸(cys,c),穀氨醯胺(gln,q),穀氨酸(glu,e),甘氨酸(gly,g),組氨酸(his,h),異亮氨酸(ile,i),亮氨酸(leu,l),賴氨酸(lys,k),甲硫氨酸(met,m),苯丙氨酸(phe,f),脯氨酸(pro,p),絲氨酸(ser,s),蘇氨酸(thr,t),色氨酸(trp,w),酪氨酸(tyr,y),和纈氨酸(val,v)。如本文中所使用的,表述「細胞」,「細胞系」,和「細胞培養物」可互換使用,並且所有此類名稱包括後代。如此,詞語「轉化體」和「經轉化的細胞」包括原代主題細胞和自其衍生的培養物,而不管傳代的次數。還應當理解,由於有意或無意的突變,所有後代在dna內容上可能不是正好相同的。包括具有如在初始轉化細胞中篩選的相同功能或生物學活性的變體後代。「親和力」指分子(例如抗體)的單一結合位點與其結合配偶體(例如抗原)之間全部非共價相互作用總和的強度。除非另有指示,如本文中使用的,「結合親和力」指反映結合對的成員(例如抗體和抗原)之間1:1相互作用的內在結合親和力。分子x對其配偶體y的親和力通常可以用解離常數(kd)來表述。親和力可以通過本領域知道的常用方法來測量,包括本文中所描述的方法。下文描述了用於測量結合親和力的具體的說明性和例示性的實施方案。如本文中所使用的,術語「結合」或「特異性結合」指在體外測定法中,優選地在表面等離振子共振測定法(spr,biacore,ge-healthcareuppsala,sweden)中抗體對抗原的表位的結合。結合親和力通過術語ka(來自抗體/抗原複合物的抗體的結合速率常數),kd(解離常數),和kd(kd/ka)限定。結合或特異性結合意指10-8mol/l或更小,優選10-9m至10-13m的結合親和力(kd)。抗體對死亡受體的結合可以通過biacore測定法(ge-healthcareuppsala,sweden)來調查。結合親和力通過術語ka(來自抗體/抗原複合物的抗體的結合速率常數),kd(解離常數),和kd(kd/ka)限定。「降低的結合」,例如降低的對fc受體的結合,指相應相互作用的親和力降低,如例如通過spr測量的。為了清楚,該術語還包括親和力降低至0(或低於分析方法的檢測限),即完全消除相互作用。相反,「升高的結合」指相應相互作用的結合親和力升高。如本文中使用的,「t細胞活化」指t淋巴細胞,特別是細胞毒性t淋巴細胞的一種或多種細胞應答,其選自:增殖,分化,細胞因子分泌,細胞毒性效應分子釋放,細胞毒性活性,和活化標誌物的表達。本發明的t細胞活化性雙特異性抗原結合分子能夠誘導t細胞活化。合適的測量t細胞活化的測定法是本文中所述
技術領域:
中已知的。如本文中使用的,「靶細胞抗原」指靶細胞表面上呈現的抗原性決定簇,所述靶細胞例如腫瘤中的細胞諸如癌細胞或腫瘤基質的細胞。特別地,「靶細胞抗原」指葉酸受體1。如本文中使用的,術語「第一」和「第二」就抗原結合模塊等而言為了在有超過一個每類模塊時便於區分而使用。除非明確如此陳述,這些術語的使用不意圖賦予t細胞活化性雙特異性抗原結合分子的特定次序或取向。術語「表位」包括能夠與抗體特異性結合的任何多肽決定簇。在某些實施方案中,表位決定簇包括分子的化學活性表面聚組,諸如胺基酸,糖側鏈,磷醯基,或磺醯基,並且在某些實施方案中可以具有特定的三維結構特徵,和/或特定的電荷特徵。表位是抗原中被抗體結合的區域。如本文中使用的,術語「抗原性決定簇」與「抗原」和「表位」同義,並且指多肽大分子上與抗原結合模塊結合,從而形成抗原結合模塊-抗原複合物的位點(例如胺基酸的連續區段或由不連續胺基酸的不同區構成的構象性構造)。可用的抗原性決定簇可以在例如腫瘤細胞表面上,病毒感染的細胞的表面上,其它患病細胞的表面上,免疫細胞的表面上,游離在血液血清中和/或在胞外基質(ecm)中找到。除非另外指示,本文中稱為抗原的蛋白質(例如folr1和cd3)可以是來自任何脊椎動物來源,包括哺乳動物如靈長類(例如人)和嚙齒類(例如小鼠和大鼠)的任何天然形式蛋白質。在一個具體的實施方案中,抗原是人蛋白。在對本文中的特定蛋白質進行提述的情況下,該術語涵蓋「全長」,未加工的蛋白質以及起因於細胞中加工的蛋白質的任何形式。該術語還涵蓋蛋白質的天然存在變體,例如剪接變體或等位變體。可用作抗原的例示性人蛋白包括但不限於:folr1(葉酸受體α(fra);葉酸結合蛋白(fbp);人folr1uniprotno.:p15328;鼠folr1uniprotno.:p35846;食蟹猴folr1uniprotno.:g7pr14),和cd3,特別是cd3的ε亞基(對於人序列,參見uniprotno.p07766(版本130),ncbirefseqno.np_000724.1,seqidno:150;或對於食蟹猴[macacafascicularis]序列,參見uniprotno.q95li5(版本49),ncbigenbankno.bab71849.1)。本發明的t細胞活化性雙特異性抗原結合分子結合在來自不同物種的cd3或靶抗原間保守的cd3或靶細胞抗原的表位。在某些實施方案中,本發明的t細胞活化性雙特異性抗原結合分子結合cd3和folr1,但是不結合folr2(葉酸受體β;frb;人folr2uniprotno.:p14207)或folr3(葉酸受體γ;人folr3uniprotno.:p41439)。如本文中所使用的,認為特別地具有前綴「糖」的術語「工程化」或「工程化改造」及術語「糖基化工程」包括對天然存在的或重組的多肽或其片段的糖基化樣式的任何操作。糖基化工程包括細胞的糖基化機制的代謝工程,包括對寡糖合成途徑的遺傳操作以實現細胞中表達的糖蛋白的改變的糖基化。此外,糖基化工程包括突變和細胞環境對糖基化的影響。在一個實施方案中,糖基化工程是糖基轉移酶活性的變化。在一個具體的實施方案中,工程化改造導致改變的葡糖胺基轉移酶活性和/或巖藻糖基轉移酶活性。ii.組合物和方法在一個方面,本發明基於t細胞活化性雙特異性抗原結合分子(例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子)和pd-1軸結合拮抗劑的治療劑組合的用途,例如用於治療癌症。在一些實施方案中,該治療劑組合進一步包括tim3拮抗劑。a.t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑的組合療法寬泛而言,本發明涉及t細胞活化性雙特異性抗原結合分子及其與pd-1軸結合拮抗劑組合的用途。該組合勝過單一療法的優勢在於本發明中使用的t細胞活化性雙特異性抗原結合分子能夠實現t細胞對靶定細胞的重新定向和活化,同時pd-1軸結合拮抗劑通過減輕t細胞耗竭增強t細胞功能。在一個方面,本文中提供的是一種用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子,例如folr1-tcb,和pd-1軸結合拮抗劑。在一些實施方案中,該治療在該治療停止後在該個體中導致持久響應。本發明的方法可以在治療期望增強的免疫原性(諸如提高腫瘤免疫原性以治療癌症)的狀況中得到應用。可以治療多種癌症,或者可以延遲其進展,所述癌症包括但不限於可以含有brafv600e突變的癌症,可以含有braf野生型的癌症,可以含有kras野生型的癌症,或可以含有活化性kras突變的癌症。在一些實施方案中,該個體具有子宮內膜癌症。該子宮內膜癌症可以處於早期或晚期。在一些實施方案中,該個體具有黑素瘤。該黑素瘤可以處於早期或處於晚期。在一些實施方案中,該個體具有結直腸癌。該結直腸癌可以處於早期或處於晚期。在一些實施方案中,該個體具有肺癌,例如非小細胞肺癌。該非小細胞肺癌可以處於早期或處於晚期。在一些實施方案中,該個體具有胰腺癌。該胰腺癌可以處於早期或晚期。在一些實施方案中,該個體具有血液學惡性。該血液學惡性可以是早期或晚期的。在一些實施方案中,該個體具有卵巢癌。該卵巢癌可以處於早期或處於晚期。在一些實施方案中,該個體具有乳腺癌。該乳腺癌可以處於早期或處於晚期。在一些實施方案中,該個體具有腎細胞癌。該腎細胞癌可以處於早期或處於晚期。在一些實施方案中,該個體是哺乳動物,諸如馴養動物(例如牛,綿羊,貓,犬,和馬),靈長類(例如人和非人靈長類諸如猴),兔,和嚙齒類(例如小鼠和大鼠)。在一些實施方案中,治療的個體是人。在另一個方面,本文中提供的是一種在具有癌症的個體中增強免疫功能的方法,其包括施用有效量的t細胞活化性雙特異性抗原結合分子(特別是folr1-tcb)和pd-1軸結合拮抗劑。在一些實施方案中,相對於施用該t細胞活化性雙特異性抗原結合分子和該pd-1途徑拮抗劑之前,該個體中的t細胞具有增強的引發,活化,增殖和/或效應器功能。在一些實施方案中,該t細胞效應器功能為分泌il-2,ifn-γ和tnf-α中至少一項。在一個實施方案中,施用folr1-tcb和抗pdl-1抗體導致t細胞升高的il-2,ifn-γ和tnf-α分泌。在一些實施方案中,該t細胞為cd8+t細胞。在一些實施方案中,該t細胞引發以cd8t細胞中升高的cd44表達和/或增強的細胞裂解活性為特徵。在一些實施方案中,該cd8t細胞活化以升高的γ-ift^tcd8t細胞頻率為特徵。在一些實施方案中,該cd8t細胞為抗原特異性t-細胞。在一些實施方案中,抑制通過經由pd-l1表面表達的信號傳導實現的免疫逃避。在一些實施方案中,該癌症具有升高水平的t細胞浸潤。在一些實施方案中,本發明的組合療法包括施用folr1-tcb和pd-1軸結合拮抗劑。可以以本領域中已知的任何合適的方式施用該folr1-tcb和pd-1軸結合拮抗劑。例如,可以序貫(在不同時間)或並行(在相同時間)施用folr1-tcb和pd-1軸結合拮抗劑。在一些實施方案中,連續施用該folr1-tcb。在一些實施方案中,間歇施用該folr1-tcb。在一些實施方案中,在施用該pd-1軸結合拮抗劑之前施用該folr1-tcb。在一些實施方案中,與施用該pd-1軸結合拮抗劑同時施用該folr1-tcb。在一些實施方案中,在施用該pd-1軸結合拮抗劑之後施用該folr1-tcb。在一些實施方案中,提供的是一種用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子(例如folr1-tcb)和pd-1軸結合拮抗劑,進一步包括施用另外的療法。具體涵蓋的是如下的一個實施方案,其中該另外的療法包含tim-3拮抗劑。因而,在一個方面,本文中提供的是一種用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子(特別是folr1-tcb),pd-1軸結合拮抗劑,和tim-3拮抗劑。可以使用任何tim3拮抗劑,例如本文中描述的那些。該另外的療法可以是放射療法,手術(例如乳房腫瘤切除術和乳房切除術),化學療法,基因療法,dna療法,病毒療法,rna療法,免疫療法,骨髓移植,納米療法(nanotherapy),單克隆抗體療法,或前述療法的組合。該另外的療法可以是輔助或新輔助療法形式。在一些實施方案中,該另外的療法是施用小分子酶促抑制劑或抗轉移劑。在一些實施方案中,該另外的療法是施用副作用限制劑(例如意圖減輕治療副作用的發生和/或嚴重性的藥劑,諸如抗噁心劑等)。在一些實施方案中,該另外的療法是放射療法。在一些實施方案中,該另外的療法是手術。在一些實施方案中,該另外的療法是放射療法和手術的組合。在一些實施方案中,該另外的療法是γ照射。在一些實施方案中,該另外的療法是靶向pi3k/akt/mtor途徑的療法,hsp90抑制劑,微管蛋白抑制劑,凋亡抑制劑,和/或化學預防劑。該另外的療法可以是上文描述的化療劑中一項或多項。可以通過相同施用路徑或者通過不同施用路徑施用t細胞活化性雙特異性抗原結合分子(例如folr1-tcb)和pd-1軸結合拮抗劑。在一些實施方案中,靜脈內,肌肉內,皮下,表面,口服,經皮,腹膜內,眶內,通過植入,通過吸入,鞘內,室內,或鼻內施用t細胞活化性雙特異性抗原結合分子(例如folr1-tcb)。在一些實施方案中,靜脈內,肌肉內,皮下,表面,口服,經皮,腹膜內,眶內,通過植入,通過吸入,鞘內,室內,或鼻內施用pd-1軸結合拮抗劑。可以施用有效量的該t細胞活化性雙特異性抗原結合分子和該pd-1軸結合拮抗劑以預防或治療疾病。該t細胞活化性雙特異性抗原結合分子和/或該pd-1軸結合拮抗劑的適宜劑量可以基於要治療的疾病的類型,t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑的類型,疾病的嚴重性和過程,個體的臨床狀況,個體的臨床史和對治療的響應,和主治內科醫生的判斷來確定。可以在方法中使用本領域中已知或下文描述的任何t細胞活化性雙特異性抗原結合分子,pd-1軸結合拮抗劑和tim-3拮抗劑。在又一個方面,本發明提供一種藥物組合物,其包含本文中描述的t細胞活化性雙特異性抗原結合分子,本文中描述的pd-1軸結合拮抗劑和藥學可接受載劑。在一些實施方案中,該藥物組合物進一步包含tim3拮抗劑。在又一個方面,本發明提供一種試劑盒,其包含對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子及包裝插頁,該包裝插頁包含關於與pd-1軸結合拮抗劑一起使用該t細胞活化性雙特異性抗原結合分子在個體中治療癌症或延遲癌症進展的用法說明書。在一些實施方案中,該試劑盒進一步包含關於與tim3拮抗劑一起使用該t細胞活化性雙特異性抗原結合分子的用法說明書。在又一個方面,本發明提供一種試劑盒,其包含對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑及包裝插頁,該包裝插頁包含關於使用該t細胞活化性雙特異性抗原結合分子和該pd-1軸結合拮抗劑在個體中治療癌症或延遲癌症進展的用法說明書。在一個實施方案中,該試劑盒進一步包含tim3拮抗劑。在該實施方案之一中,該pd-1軸結合拮抗劑為抗pd-1抗體或抗pdl-1抗體。在一個實施方案中,該pd-1軸結合拮抗劑為抗pd-1免疫粘附素。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,其中裝有包含本文中描述的對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子的組合物;和(ii)第二容器,其中裝有包含pd-1軸結合拮抗劑的組合物。在又一個方面,本發明提供一種試劑盒,其包含:(i)第一容器,其裝有包含本文中描述的對葉酸受體1(folr1)和cd3特異性的t細胞活化性雙特異性抗原結合分子的組合物;(ii)第二容器,其裝有包含pd-1軸結合拮抗劑的組合物;和(iii)第三容器,其裝有包含tim3拮抗劑的組合物。b.供本發明中使用的例示性t細胞活化性雙特異性抗原結合分子本發明的t細胞活化性雙特異性抗原結合分子是雙特異性的,即它包含能夠特異性結合兩種不同抗原決定簇,即cd3和folr1的至少兩種抗原結合模塊。依照本發明,該抗原結合模塊是fab分子(即由各自包含一個可變區和一個恆定區的一條重鏈和一條輕鏈構成的抗原結合域)。在一個實施方案中,所述fab分子是人的。在另一個實施方案中,所述fab分子是人源化的。在還有另一個實施方案中,所述fab分子包含人重和輕鏈恆定區。本發明的t細胞活化性雙特異性抗原結合分子能夠同時結合該靶細胞抗原folr1和cd3。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子能夠通過同時結合靶細胞抗原folr1和cd3而交聯t細胞和folr1表達性靶細胞。在一個甚至更加特定的實施方案中,此類同時結合導致folr1表達性靶細胞,特別是folr1表達性腫瘤細胞裂解。在一個實施方案中,此類同時結合導致t細胞活化。在其它實施方案中,此類同時結合導致t淋巴細胞,特別是細胞毒性t淋巴細胞的選自下組的細胞應答:增殖,分化,細胞因子分泌,細胞毒性效應分子釋放,細胞毒性活性,和活化標誌物表達。在一個實施方案中,在沒有同時結合靶細胞抗原folr1的情況下該t細胞活化性雙特異性抗原結合分子對cd3的結合不導致t細胞活化。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子能夠將t細胞的細胞毒性活性重定向至folr1表達性靶細胞。在一個特定的實施方案中,所述重定向不依賴於靶細胞的mhc介導的肽抗原呈遞和/或t細胞的特異性。特別是,依照本發明的一些實施方案的t細胞為細胞毒性t細胞。在一些實施方案中,該t細胞為cd4+或cd8+t細胞,特別是cd8+t細胞。本發明的t細胞活化性雙特異性抗原結合分子包含至少一個能夠結合cd3的抗原結合模塊(在本文中也稱作「cd3抗原結合模塊」或「第一抗原結合模塊」)。在一個特定的實施方案中,該t細胞活化性雙特異性抗原結合分子包含不超過一個能夠特異性結合cd3的抗原結合模塊。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子提供對cd3的單價結合。在一個特定的實施方案中,cd3為人cd3或食蟹猴cd3,最特別為人cd3。在一個特定的實施方案中,該cd3抗原結合模塊是對人和食蟹猴cd3交叉反應性的(即特異性結合)。在一些實施方案中,該第一抗原結合模塊能夠特異性結合cd3的ε亞基(參見uniprotno.p07766(版本130),ncbirefseqno.np_000724.1,seqidno:150,人序列;uniprotno.q95li5(版本49),ncbigenbankno.bab71849.1,食蟹猴[macacafascicularis]序列)。在一些實施方案中,該cd3抗原結合模塊包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3。在一個實施方案中,該cd3抗原結合模塊包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在一個實施方案中,該cd3抗原結合模塊包含與seqidno:36至少約95%,96%,97%,98%,99%或100%相同的重鏈可變區序列和與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的輕鏈可變區序列。本發明的t細胞活化性雙特異性抗原結合分子包含至少一個能夠結合靶細胞抗原folr1的抗原結合模塊(在本文中也稱作「folr1結合模塊」或「第二」或「第三」抗原結合模塊)。在一個實施方案中,該能夠結合靶細胞抗原folr1的抗原結合模塊不結合folr2或folr3。在一個特定的實施方案中,該folr1抗原結合模塊是對人和食蟹猴folr1交叉反應性的(即特異性結合)。在某些實施方案中,該t細胞活化性雙特異性抗原結合分子包含兩個能夠結合靶細胞抗原folr1的抗原結合模塊。在一個特定的此類實施方案中,這些抗原結合模塊中的每個特異結合相同抗原決定簇。在一個甚至更加特定的實施方案中,所有這些抗原結合模塊是相同的。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含不超過兩個能夠結合folr1的抗原結合模塊。該folr1結合模塊通常是特異結合folr1且能夠將t細胞活化性雙特異性抗原結合分子定向至它所連接的靶位點,例如表達folr1的特定類型的腫瘤細胞的fab分子。一方面,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,且包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;和(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子。在一個實施方案中,該為能夠特異性結合cd3的fab分子的第一抗原結合模塊包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子另外包含(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合folr1的fab分子。在一個此類實施方案中,該第二和第三能夠特異性結合folr1的抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列。在一個此類實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同。在一個實施方案中,上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子另外包含由能夠穩定聯合的第一和第二亞基構成的fc域。在一個實施方案中,該第一抗原結合模塊和該第二抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一或第二亞基的n端。在一個實施方案中,該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端,任選經由肽接頭。在又一個特定的實施方案中,該t細胞活化性雙特異性抗原結合分子中存在不超過一個能夠特異性結合cd3的抗原結合模塊(即該t細胞活化性雙特異性抗原結合分子提供對cd3的單價結合)。具有共同輕鏈的t細胞活化性雙特異性抗原結合分子本發明的發明人生成了一種雙特異性抗體,其中結合模塊共享共同輕鏈,其保留針對cd3的親本單特異性抗體的特異性和功效且能使用相同輕鏈結合第二抗原(例如folr1)。保留親本抗體的結合特性的具有共同輕鏈的雙特異性分子的生成不是直截了當的,因為雜合輕鏈的共同cdr不得不實現針對兩種靶的結合特異性。一方面,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含第一和第二抗原結合模塊,其中之一為能夠特異性結合cd3的fab分子且其中另一為能夠特異性結合folr1的fab分子,其中該第一和該第二fab分子具有相同vlcl輕鏈。在一個實施方案中,所述相同輕鏈(vlcl)包含seqidno:32,seqidno:33和seqidno:34的輕鏈cdr。在一個實施方案中,所述相同輕鏈(vlcl)包含seqidno:35。在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,且包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,且包含至少一個選自由seqidno:16,seqidno:17和seqidno:18組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:16的重鏈cdr1,seqidno:17的重鏈cdr2,seqidno:18的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3。在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:15的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在又一個實施方案中,對folr1特異性的抗原結合模塊包含與seqidno:15至少約95%,96%,97%,98%,99%或100%相同的重鏈可變區序列和與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的輕鏈可變區序列或其保留功能性的變體。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含與seqidno:36至少約95%,96%,97%,98%,99%或100%相同的多肽序列,與seqidno:15至少約95%,96%,97%,98%,99%或100%相同的多肽序列,和與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的多肽序列。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子另外包含(iii)能夠特異性結合folr1的第三抗原結合模塊(其為fab分子)。在一個此類實施方案中,該能夠特異性結合folr1的第二和第三抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列。在一個此類實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同。因而,在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,且包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,且包含至少一個選自由seqidno:16,seqidno:17和seqidno:18組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,且包含至少一個選自由seqidno:16,seqidno:17和seqidno:18組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:16的重鏈cdr1,seqidno:17的重鏈cdr2,seqidno:18的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3。在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:15的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:15的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,且包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,且包含至少一個選自由seqidno:16,seqidno:402和seqidno:400組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:16的重鏈cdr1,seqidno:402的重鏈cdr2,seqidno:400的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3。在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:401的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。在又一個實施方案中,對folr1特異性的抗原結合模塊包含與seqidno:401至少約95%,96%,97%,98%,99%或100%相同的重鏈可變區序列和與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的輕鏈可變區序列或其保留功能性的變體。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含與seqidno:36至少約95%,96%,97%,98%,99%或100%相同的多肽序列,與seqidno:401至少約95%,96%,97%,98%,99%或100%相同的多肽序列,和與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的多肽序列。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子另外包含(iii)能夠特異性結合folr1的第三抗原結合模塊(其為fab分子)。在一個此類實施方案中,該能夠特異性結合folr1的第二和第三抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列。在一個此類實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同。因而,在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,且包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,且包含至少一個選自由seqidno:16,seqidno:402和seqidno:400組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,且包含至少一個選自由seqidno:16,seqidno:402和seqidno:400組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:16的重鏈cdr1,seqidno:402的重鏈cdr2,seqidno:400的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3。在一個實施方案中,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:401的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:401的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。如此,在一個實施方案中,本發明涉及雙特異性分子,其中至少兩個結合模塊具有相同輕鏈和相應的分別賦予針對t細胞活化性抗原cd3和靶細胞抗原folr1的特異性結合的重建的重鏈。這種所謂的『共同輕鏈』原理,即組合共享一種輕鏈但是仍然具有分開的特異性的兩種結合物的使用阻止輕鏈錯配。如此,生產期間的副產物更少,推動t細胞活化性雙特異性抗原結合分子的同質製備。t細胞活化性雙特異性抗原結合分子的各構件可以以多種構造彼此融合。例示性的構造描繪於圖1a-i中且在下文中進一步描述。在一些實施方案中,所述t細胞活化性雙特異性抗原結合分子進一步包含由能夠穩定聯合的第一和第二亞基構成的fc域。下文描述包含fc域的t細胞活化性雙特異性抗原結合分子的例示性實施方案。具有交換fab片段的t細胞活化性雙特異性抗原結合分子本發明的發明人生成了第二種雙特異性抗體型式,其中結合模塊之一為交換fab片段。在本發明的一個方面中,提供單價雙特異性抗體,其中igg分子的fab片段之一用交換fab片段替換。交換fab片段是如下的fab片段,其中重和輕鏈的可變區或恆定區任一是交換的。包含交換fab片段的雙特異性抗體型式已有記載,例如wo2009080252,wo2009080253,wo2009080251,wo2009080254,wo2010/136172,wo2010/145792和wo2013/026831。在一個特定的實施方案中,第一抗原結合模塊為交換fab分子,其中fab輕鏈和fab重鏈的可變或恆定區任一是交換的。此類修飾阻止來自不同fab分子的重和輕鏈的錯配,由此改進重組生產中本發明的t細胞活化性雙特異性抗原結合分子的產量和純度。在一種特定的對本發明的t細胞活化性雙特異性抗原結合分子有用的交換fab分子中,fab輕鏈和fab重鏈的可變區是交換的。在另一種對本發明的t細胞活化性雙特異性抗原結合分子有用的交換fab分子中,fab輕鏈和fab重鏈的恆定區是交換的。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊能夠特異性結合葉酸受體1(folr1),包含至少一個選自由seqidno:8,seqidno:56和seqidno:57組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:59,seqidno:60,seqidno:65的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:8的重鏈cdr1,seqidno:56的重鏈cdr2,seqidno:57的重鏈cdr3,seqidno:59的輕鏈cdr1,seqidno:60的輕鏈cdr2,和seqidno:65的輕鏈cdr3。在一個實施方案中,該第二抗原結合模塊為常規fab分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:55的胺基酸序列的可變重鏈和包含seqidno:64的胺基酸序列的可變輕鏈。在一個實施方案中,該第二抗原結合模塊為常規fab分子。在又一個實施方案中,對folr1特異性的抗原結合模塊包含與seqidno:55至少約95%,96%,97%,98%,99%或100%相同的重鏈可變區序列和與seqidno:64至少約95%,96%,97%,98%,99%或100%相同的輕鏈可變區序列或其保留功能性的變體。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含與seqidno:36至少約95%,96%,97%,98%,99%或100%相同的多肽序列,與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的多肽序列,與seqidno:55至少約95%,96%,97%,98%,99%或100%相同的多肽序列,和與seqidno:64至少約95%,96%,97%,98%,99%或100%相同的多肽序列。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子另外包含(iii)能夠特異性結合folr1的第三抗原結合模塊。在一個實施方案中,該第三抗原結合模塊為常規fab分子。在一個實施方案中,該第三抗原結合模塊為交換fab分子。在一個此類實施方案中,該能夠特異性結合folr1的第二和第三抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列。在一個此類實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊能夠特異性結合葉酸受體1(folr1),包含至少一個選自由seqidno:8,seqidno:56和seqidno:57組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:59,seqidno:60,seqidno:65的組的輕鏈cdr。(iii)第三抗原結合模塊,該第三抗原結合模塊夠特異性結合葉酸受體1(folr1),包含至少一個選自由seqidno:8,seqidno:56和seqidno:57組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:59,seqidno:60,seqidno:65的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:8的重鏈cdr1,seqidno:56的重鏈cdr2,seqidno:57的重鏈cdr3,seqidno:59的輕鏈cdr1,seqidno:60的輕鏈cdr2,和seqidno:65的輕鏈cdr3。在一個實施方案中,該第二抗原結合模塊和該第三抗原結合模塊均為常規fab分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:55的胺基酸序列的可變重鏈和包含seqidno:64的胺基酸序列的可變輕鏈。(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:55的胺基酸序列的可變重鏈和包含seqidno:64的胺基酸序列的可變輕鏈。在一個實施方案中,該第二抗原結合模塊和該第三抗原結合模塊均為常規fab分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊能夠特異性結合葉酸受體1(folr1),包含至少一個選自由seqidno:8,seqidno:9和seqidno:50組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:52,seqidno:53,seqidno:54的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3。在一個實施方案中,該第二抗原結合模塊為常規fab分子。在一個實施方案中,該第二抗原結合模塊為交換fab分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:49的胺基酸序列的可變重鏈和包含seqidno:51的胺基酸序列的可變輕鏈。在一個實施方案中,該第二抗原結合模塊為常規fab分子。在一個實施方案中,該第二抗原結合模塊為交換fab分子。在又一個實施方案中,對folr1特異性的抗原結合模塊包含與seqidno:49至少約95%,96%,97%,98%,99%或100%相同的重鏈可變區序列和與seqidno:51至少約95%,96%,97%,98%,99%或100%相同的輕鏈可變區序列或其保留功能性的變體。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含與seqidno:36至少約95%,96%,97%,98%,99%或100%相同的多肽序列,與seqidno:31至少約95%,96%,97%,98%,99%或100%相同的多肽序列,與seqidno:49至少約95%,96%,97%,98%,99%或100%相同的多肽序列,和與seqidno:51至少約95%,96%,97%,98%,99%或100%相同的多肽序列。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子另外包含(iii)能夠特異性結合folr1的第三抗原結合模塊。在一個實施方案中,該第三抗原結合模塊為常規fab分子。在一個實施方案中,該第二抗原結合模塊為交換fab分子。在一個此類實施方案中,該能夠特異性結合folr1的第二和第三抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列。在一個此類實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33,seqidno:34的組的輕鏈cdr;(ii)第二抗原結合模塊,該第二抗原結合模塊能夠特異性結合葉酸受體1(folr1),包含至少一個選自由seqidno:8,seqidno:9和seqidno:49組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:52,seqidno:53,seqidno:54的組的輕鏈cdr。(iii)第三抗原結合模塊,該第三抗原結合模塊能夠特異性結合葉酸受體1(folr1),包含至少一個選自由seqidno:8,seqidno:9和seqidno:50組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:52,seqidno:53,seqidno:54的組的輕鏈cdr。在一個此類實施方案中,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3,且該folr1抗原結合模塊包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3。在一個實施方案中,該第二抗原結合模塊和該第三抗原結合模塊均為常規fab分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含(i)第一抗原結合模塊,該第一抗原結合模塊為能夠特異性結合cd3的交換fab分子,包含:包含seqidno:36的胺基酸序列的可變重鏈和包含seqidno:31的胺基酸序列的可變輕鏈。(ii)第二抗原結合模塊,該第二抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:49的胺基酸序列的可變重鏈和包含seqidno:51的胺基酸序列的可變輕鏈。(iii)第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合葉酸受體1(folr1)的fab分子,包含:包含seqidno:49的胺基酸序列的可變重鏈和包含seqidno:51的胺基酸序列的可變輕鏈。在一個實施方案中,該第二抗原結合模塊和該第三抗原結合模塊均為常規fab分子。如此,在一個實施方案中,本發明涉及雙特異性分子,其中兩個結合模塊賦予針對folr1的特異性結合且一個結合模塊賦予針對t細胞活化性抗原cd3的特異性。修飾重鏈之一以確保重和輕鏈的正確配對,如此消除對共同輕鏈辦法的需要。兩個folr1結合位點的存在使得能夠實現適宜的靶抗原folr1接合和t細胞活化。t細胞活化性雙特異性抗原結合分子的各構件可以以多種構造彼此融合。例示性的構造描繪於圖1a-i中且在下文中進一步描述。在一些實施方案中,所述t細胞活化性雙特異性抗原結合分子進一步包含由能夠穩定聯合的第一和第二亞基構成的fc域。下文描述包含fc域的t細胞活化性雙特異性抗原結合分子的例示性實施方案。t細胞活化性雙特異性抗原結合分子型式如上文和圖1a-i中描繪的,在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含具有相同輕鏈(vlcl)且具有賦予針對兩種不同抗原的特異性的不同重鏈(vhcl)的至少兩個fab片段,即一個fab片段能夠特異性結合t細胞活化性抗原cd3且另一個fab片段能夠特異性結合該靶細胞抗原folr1。在另一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含至少兩個抗原結合模塊(fab分子),其中之一為交換fab分子且其中另一為常規fab分子。在一個此類實施方案中,該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子且該能夠特異性結合folr的第二抗原結合模塊為常規fab分子。t細胞活化性雙特異性抗原結合分子的這些構件可以以多種構造彼此融合。例示性的構造描繪於圖1a-i中。在一些實施方案中,該第一和第二抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一或第二亞基的n端。在一個具體的此類實施方案中,該t細胞活化性雙特異性抗原結合分子基本上由第一和第二抗原結合模塊,由第一和第二亞基構成的fc域,和任選的一個或多個肽接頭組成,其中該第一和第二抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一或第二亞基的n端。在一個此類實施方案中,該第一和第二抗原結合模塊均為fab片段且具有相同輕鏈(vlcl)。在另一個此類實施方案中,該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子且該能夠特異性結合folr的第二抗原結合模塊為常規fab分子。在一個實施方案中,該第二抗原結合模塊在fab重鏈的c端融合至該fc域的第一或第二亞基的n端且該第一抗原結合模塊在fab重鏈的c端融合至該第二抗原結合模塊的fab重鏈的n端。在一個具體的此類實施方案中,該t細胞活化性雙特異性抗原結合分子基本上由第一和第二抗原結合模塊,由第一和第二亞基的構成的fc域,和任選的一個或多個肽接頭組成,其中該第一抗原結合模塊在fab重鏈的c端融合至該第二抗原結合模塊的fab重鏈的n端,且該第二抗原結合模塊在fab重鏈的c端融合至該fc域的第一或第二亞基的n端。在一個此類實施方案中,該第一和第二抗原結合模塊均為fab片段且具有相同輕鏈(vlcl)。在另一個此類實施方案中,該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子和該能夠特異性結合folr的第二抗原結合模塊為常規fab分子。任選地,該第一抗原結合模塊的fab輕鏈和該第二抗原結合模塊的fab輕鏈可以另外彼此融合。在其它實施方案中,該第一抗原結合模塊在fab重鏈的c端融合至該fc域的第一或第二亞基的n端。在一個特定的此類實施方案中,該第二抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端。在一個具體的此類實施方案中,該t細胞活化性雙特異性抗原結合分子基本上由第一和第二抗原結合模塊,由第一和第二亞基構成的fc域,和任選的一個或多個肽接頭組成,其中該第二抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端,且該第一抗原結合模塊在fab重鏈的c端融合至該fc域的第一或第二亞基的n端。在一個此類實施方案中,該第一和第二抗原結合模塊均為fab片段且具有相同輕鏈(vlcl)。在另一個此類實施方案中,該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子且該能夠特異性結合folr的第二抗原結合模塊為常規fab分子。任選地,該第一抗原結合模塊的fab輕鏈和該第二抗原結合模塊的fab輕鏈可以另外彼此融合。抗原結合模塊可以直接地或經由肽接頭融合至fc域或彼此融合,所述肽接頭包含一個或多個胺基酸,通常約2-20個胺基酸。肽接頭是本領域中已知且本文中記載的。合適的,非免疫原性的肽接頭包括例如(g4s)n(seqidno:387),(sg4)n(seqidno:388),(g4s)n(seqidno:387)或g4(sg4)n(seqidno:389)肽接頭。「n」一般是介於1和10之間,通常介於2和4之間的數目。一種特別適合於將第一和第二抗原結合模塊的fab輕鏈彼此融合的肽接頭是(g4s)2(seqidno:386)。一種適合於連接第一和第二抗原結合模塊的fab重鏈的例示性肽接頭是epksc(d)-(g4s)2(seqidno390和391)。另外,接頭可包含免疫球蛋白鉸鏈區(的一部分)。特別地,當抗原結合模塊融合至fc域亞基的n端時,其可以在有或無另外的肽接頭的情況下經由免疫球蛋白鉸鏈區或其部分融合。本發明的發明人已經發現,包含兩個對靶細胞抗原folr特異性的結合模塊的t細胞活化性雙特異性抗原結合分子具有與只包含一個對靶細胞抗原folr特異性的結合模塊的t細胞活化性雙特異性抗原結合分子相比卓越的特徵。因而,在某些實施方案中,本發明的t細胞活化性雙特異性抗原結合分子進一步包含第三抗原結合模塊,該第三抗原結合模塊為能夠特異性結合folr的fab分子。在一個此類實施方案中,該能夠特異性結合folr1的第二和第三抗原結合模塊包含相同的重鏈互補決定區(cdr)和輕鏈cdr序列,即該第二抗原結合模塊的重鏈cdr序列與該第三抗原結合模塊的重鏈cdr序列相同,且該第二抗原結合模塊的輕鏈cdr序列與該第三抗原結合模塊的輕鏈cdr序列相同。在一個此類實施方案中,該第三抗原結合模塊與該第二抗原結合模塊相同(即它們包含相同的胺基酸序列)。在一個實施方案中,該第一和第二抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一或第二亞基的n端且該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端。在一個具體的此類實施方案中,該t細胞活化性雙特異性抗原結合分子基本上由第一,第二和第三抗原結合模塊,由第一和第二亞基構成的fc域,和任選的一個或多個肽接頭組成,其中該第一和第二抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一亞基的n端且該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端。在一個此類實施方案中,該第一,第二和第三抗原結合模塊為常規fab片段且具有相同輕鏈(vlcl)。在另一個此類實施方案中,該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子且該能夠特異性結合folr的第二和第三抗原結合模塊為常規fab分子。任選地,該第一抗原結合模塊的fab輕鏈和該第三抗原結合模塊的fab輕鏈可以另外彼此融合。另一方面,本發明提供一種雙特異性抗體,其包含a)與包含seqidno:49的可變重鏈域(vh)和seqidno:51的可變輕鏈域的參照抗體競爭結合人folr1的第一抗原結合位點;和b)與包含seqidno:36的可變重鏈域(vh)和seqidno:31的可變輕鏈域的參照抗體競爭結合人cd3的第二抗原結合位點,其中結合競爭是使用表面等離振子共振測定法測量的。另一方面,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含能夠特異性結合cd3的第一抗原結合模塊和能夠特異性結合葉酸受體1(folr1)的第二抗原結合模塊,其中該t細胞活化性雙特異性抗原結合分子與包含seqidno:49的可變重鏈域(vh)和seqidno:51的可變輕鏈域的第一參照抗體結合人folr1上的相同表位;且其中該t細胞活化性雙特異性抗原結合分子與包含seqidno:36的可變重鏈域(vh)和seqidno:31的可變輕鏈域的第二參照抗體結合人cd3上的相同表位。另一方面,本發明提供一種t細胞活化性雙特異性抗原結合分子,其包含形成第一,第二和第三抗原結合模塊的第一,第二,第三,第四和第五多肽鏈,其中該第一抗原結合模塊能夠結合cd3且該第二和第三抗原結合模塊各自能夠結合葉酸受體1(folr1)。該第一和第二多肽鏈以氨基(n)端至羧基(c)端方向包含第一輕鏈可變域(vld1)和第一輕鏈恆定域(cld1)。該第三多肽鏈以n端至c端方向包含第二輕鏈可變域(vld2)和第二重鏈恆定域1(ch1d2)。該第四多肽鏈以n端至c端方向包含第一重鏈可變域(vhd1),第一重鏈恆定域1(ch1d1),第一重鏈恆定域2(ch2d1)和第一重鏈恆定域3(ch3d1)。該第五多肽鏈包含vhd1,ch1d1,第二重鏈可變域(vhd2),第二輕鏈恆定域(cld2),第二重鏈恆定域2(ch2d2)和第二重鏈恆定域3(ch3d2)。該第三多肽鏈和該第五多肽鏈的vhd2和cld2形成該能夠結合cd3的第一抗原結合模塊。該第二多肽鏈和該第五多肽鏈的vhd1和ch1d1形成該能夠結合folr1的第三結合模塊。該第一多肽鏈和該第四多肽鏈的vhd1和ch1d1形成該能夠結合folr1的第二結合模塊。在另一個實施方案中,該第二和第三抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一或第二亞基的n端,且該第一抗原結合模塊在fab重鏈的c端融合至該第二抗原結合模塊的fab重鏈的n端。在一個具體的此類實施方案中,該t細胞活化性雙特異性抗原結合分子基本上由第一,第二和第三抗原結合模塊,由第一和第二亞基構成的fc域,和任選的一個或多個肽接頭組成,其中該第二和第三抗原結合模塊各自在fab重鏈的c端融合至該fc域的第一亞基的n端且該第一抗原結合模塊在fab重鏈的c端融合至該第三抗原結合模塊的fab重鏈的n端。在一個此類實施方案中,該第一,第二和第三抗原結合模塊為常規fab片段且具有相同輕鏈(vlcl)。在另一個此類實施方案中,該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子且該能夠特異性結合folr的第二和第三抗原結合模塊為常規fab分子。任選地,該第一抗原結合模塊的fab輕鏈和該第二抗原結合模塊的fab輕鏈可以另外彼此融合。抗原結合模塊可以直接地或經由肽接頭融合至fc域。在一個特定的實施方案中,抗原結合模塊各自經由免疫球蛋白鉸鏈區融合至fc域。在一個具體的實施方案中,該免疫球蛋白鉸鏈區為人igg1鉸鏈區。在一個實施方案中,該第一和第二抗原結合模塊和該fc域是免疫球蛋白分子的部分。在一個特定的實施方案中,該免疫球蛋白分子為igg類免疫球蛋白。在一個甚至更加特定的實施方案中,該免疫球蛋白為igg1亞類免疫球蛋白。在另一個實施方案中,該免疫球蛋白為igg4亞類免疫球蛋白。在又一個特定的實施方案中,該免疫球蛋白為人免疫球蛋白。在其它實施方案中,該免疫球蛋白為嵌合免疫球蛋白或人源化免疫球蛋白。在一個特定的實施方案中,所述t細胞活化性雙特異性抗原結合分子,該第一和第二抗原結合模塊和該fc域是免疫球蛋白分子的部分,且該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端,其中該第一,第二和第三抗原結合模塊為常規fab片段且具有相同輕鏈(vlcl),其中該能夠特異性結合cd3的第一抗原結合模塊包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33和seqidno:34的組的輕鏈cdr;且該能夠特異性結合folr1的第二和第三抗原結合模塊包含至少一個選自由seqidno:16,seqidno:17和seqidno:18組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33和seqidno:34的組的輕鏈cdr。在一個特定的實施方案中,所述t細胞活化性雙特異性抗原結合分子,該第一和第二抗原結合模塊和該fc域是免疫球蛋白分子的部分,且該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端,其中該第一,第二和第三抗原結合模塊為常規fab片段且具有相同輕鏈(vlcl),其中該能夠特異性結合cd3的第一抗原結合模塊包含:包含seqidno:36的序列的可變重鏈,包含seqidno:31的序列的可變輕鏈;且該能夠特異性結合folr1的第二和第三抗原結合模塊包含:包含seqidno:15的序列的可變重鏈,包含seqidno:31的序列的可變輕鏈。在一個特定的實施方案中,所述t細胞活化性雙特異性抗原結合分子,該第一和第二抗原結合模塊和該fc域是免疫球蛋白分子的部分,且該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端且該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子,其中fab輕鏈和fab重鏈的可變或恆定區任一是交換的,包含至少一個選自由seqidno:37,seqidno:38和seqidno:39組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:32,seqidno:33和seqidno:34的組的輕鏈cdr;且該能夠特異性結合folr1的第二和第三抗原結合模塊包含至少一個選自由seqidno:8,seqidno:56和seqidno:57組成的組的重鏈互補決定區(cdr)和至少一個選自seqidno:59,seqidno:60和seqidno:65的組的輕鏈cdr。在一個特定的實施方案中,所述t細胞活化性雙特異性抗原結合分子,該第一和該第二抗原結合模塊和該fc域是免疫球蛋白分子的部分,且該第三抗原結合模塊在fab重鏈的c端融合至該第一抗原結合模塊的fab重鏈的n端且該能夠特異性結合cd3的第一抗原結合模塊為交換fab分子,其中fab輕鏈和fab重鏈的可變或恆定區任一是交換的,其中該能夠特異性結合cd3的第一抗原結合模塊包含:包含seqidno:36的序列的可變重鏈,包含seqidno:31的序列的可變輕鏈;且該能夠特異性結合folr1的第二和第三抗原結合模塊包含:包含seqidno:55的序列的可變重鏈,包含seqidno:65的序列的可變輕鏈。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子對於每種抗原是單價的。在一個特定的實施方案中,該t細胞活化性雙特異性抗原結合分子能結合人cd3和人葉酸受體α(folr1)且是在沒有採用異二聚化辦法,諸如例如節入穴技術的情況下生成的。例如,該分子可以通過採用共同輕鏈文庫和crossmab技術來生成。在一個特定的實施方案中,cd3結合物的可變區融合至標準人igg1抗體的ch1域以形成vlvh交叉分子(融合至fc),這對於兩種特異性是共同的。為了生成交叉的對應物(vhcl),cd3特異性可變重鏈域融合至恆定人λ輕鏈,而人folr1特異性可變重鏈域(例如自共同輕鏈文庫分離的)融合至恆定人κ輕鏈。所得具有正確配對鏈的期望分子包含κ和λ輕鏈或其片段二者。因此,這種期望的雙特異性分子種類能憑藉以任一順序選擇κ和λ輕鏈的順序純化步驟自錯配或同二聚體種類純化。在一個特定的實施方案中,期望的雙特異性抗體的純化採用後續的純化步驟,憑藉kappaselect和lambdafabselect柱(gehealthcare),去除不期望的同二聚體抗體。fc域t細胞活化性雙特異性抗原結合分子的fc域由一對包含免疫球蛋白分子重鏈域的多肽鏈組成。例如,免疫球蛋白g(igg)分子的fc域是二聚體,其每個亞基包含ch2和ch3igg重鏈恆定域。fc域的兩個亞基能夠彼此穩定聯合。在一個實施方案中,本發明的t細胞活化性雙特異性抗原結合分子包含不超過一個fc域。在依照本發明的一個實施方案中,t細胞活化性雙特異性抗原結合分子的fc域是iggfc域。在一個具體的實施方案中,fc域是igg1fc域。在另一個實施方案中,fc域是igg4fc域。在一個更加具體的實施方案中,fc域是包含位置s228(kabat編號方式)處的胺基酸替代,特別是胺基酸替代s228p的igg4fc域。此胺基酸替代降低igg4抗體的體內fab臂交換(參見stubenrauch等,drugmetabolismanddisposition38,84-91(2010))。在又一個具體的實施方案中,fc域是人的。促進異二聚化的fc域修飾依照本發明的t細胞活化性雙特異性抗原結合分子包含不同的抗原結合模塊,其融合至fc域的兩個亞基之一個或另一個,如此fc域的兩個亞基通常包含在兩條不相同的多肽鏈中。這些多肽的重組共表達和隨後二聚化導致兩種多肽的數種可能組合。為了改進重組生產中t細胞活化性雙特異性抗原結合分子的產率和純度,如此在t細胞活化性雙特異性抗原結合分子的fc域中引入促進期望多肽聯合的修飾會是有利的。因而,在具體的實施方案中,依照本發明的t細胞活化性雙特異性抗原結合分子的fc域包含促進fc域的第一和第二亞基聯合的修飾。人iggfc域的兩個亞基之間最廣泛的蛋白質-蛋白質相互作用的位點在fc域的ch3域中。如此,在一個實施方案中,所述修飾在fc域的ch3域中。在一個特定的實施方案中,所述修飾是所謂的「節-入-穴」修飾,其包含在fc域的兩個亞基之一中的「節」修飾和在fc域的兩個亞基之另一中的「穴」修飾。節-入-穴技術記載於例如us5,731,168;us7,695,936;ridgway等,proteng9,617-621(1996)和carter,jimmunolmeth248,7-15(2001)。一般地,該方法牽涉在第一多肽的界面處引入隆起(「節」)並在第二多肽的界面中引入相應的空腔(「穴」),使得隆起可以置於空腔中從而促進異二聚體形成並阻礙同二聚體形成。通過將來自第一多肽界面的小胺基酸側鏈用更大的側鏈(例如酪氨酸或色氨酸)替換來構建隆起。在第二多肽的界面中創建具有與隆起相同或相似大小的互補性空腔,其通過將大胺基酸側鏈用更小的胺基酸側鏈(例如丙氨酸或蘇氨酸)替換進行。因而,在一個具體的實施方案中,在t細胞活化性雙特異性抗原結合分子的fc域的第一亞基的ch3域中,一個胺基酸殘基用具有更大側鏈體積的胺基酸殘基替換,由此在第一亞基的ch3域內生成隆起,其可安置於第二亞基的ch3域內的空腔中,而且在fc域的第二亞基的ch3域中,一個胺基酸殘基用具有更小側鏈體積的胺基酸殘基替換,由此在第二亞基的ch3域內生成空腔,其中可安置第一亞基的ch3域內的隆起。可以通過改變編碼多肽的核酸,例如通過位點特異性誘變或通過肽合成來生成隆起和空腔。在一個特定的實施方案中,在fc域第一亞基的ch3域中,第366位的蘇氨酸殘基用色氨酸殘基替換(t366w),而在fc域第二亞基的ch3域中,第407位的酪氨酸殘基用纈氨酸殘基替換(y407v)。在一個實施方案中,在fc域第二亞基中,另外,第366位的蘇氨酸殘基用絲氨酸殘基替換(t366s)且第368位的亮氨酸殘基用丙氨酸殘基替換(l368a)。在還有又一個實施方案中,在fc域的第一亞基中,另外,第354位的絲氨酸殘基用半胱氨酸殘基替換(s354c),而在fc域的第二亞基中,另外,第349位的酪氨酸殘基用半胱氨酸殘基替換(y349c)。這兩個半胱氨酸殘基的引入導致在fc域的兩個亞基之間形成二硫橋,從而進一步穩定了二聚體(carter,jimmunolmethods248,7-15(2001))。在一個具體的實施方案中,將能夠結合cd3的抗原結合模塊融合(任選地經由能夠結合靶細胞抗原的抗原結合模塊)至fc域的第一亞基(其包含「節」修飾)。不希望受理論束縛,能夠結合cd3的抗原結合模塊與fc域的含節的亞基的融合會(進一步)使包含兩個能夠結合cd3的抗原結合模塊的抗原結合分子的生成最小化(兩條含節的多肽的空間碰撞)。在一個備選的實施方案中,促進fc域的第一和第二亞基聯合的修飾包含介導靜電操縱效應(electrostaticsteeringeffect)的修飾,例如如記載於pct公開文本wo2009/089004的。一般地,此方法涉及將在兩個fc域亞基界面處的一個或多個胺基酸殘基替換為帶電荷的胺基酸殘基,從而在靜電上不利於同二聚體形成而在靜電上有利於異二聚化。消除fc受體結合和/或效應器功能的fc域修飾fc域賦予t細胞活化性雙特異性抗原結合分子以有利的藥動學特性,包括長血清半衰期,其有助於在靶組織中的較好積累和有利的組織-血液分配比。然而,同時它可能導致不想要的t細胞活化性雙特異性抗原結合分子對表達fc受體的細胞而非優選的攜帶抗原的細胞的靶向。此外,fc受體信號傳導途徑的共激活可能導致細胞因子釋放,其與抗原結合分子的t細胞活化特性和長半衰期組合,在系統性施用後引起細胞因子受體的過度活化和嚴重的副作用。(攜帶fc受體的)免疫細胞而非t細胞的活化甚至可能降低t細胞活化性雙特異性抗原結合分子的功效,原因是例如通過nk細胞對t細胞的潛在破壞。因而,在具體的實施方案中,依照本發明的t細胞活化性雙特異性抗原結合分子的fc域展現出與天然igg1fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能。在一個此類實施方案中,fc域(或包含所述fc域的t細胞活化性雙特異性抗原結合分子)展現出與天然igg1fc域(或包含天然igg1fc域的t細胞活化性雙特異性抗原結合分子)相比少於50%,優選少於20%,更優選少於10%且最優選少於5%的對fc受體的結合親和力,和/或與天然igg1fc域(或包含天然igg1fc域的t細胞活化性雙特異性抗原結合分子)相比少於50%,優選少於20%,更優選少於10%且最優選少於5%的效應器功能。在一個實施方案中,fc域(或包含所述fc域的t細胞活化性雙特異性抗原結合分子)沒有實質性結合fc受體和/或誘導效應器功能。在一個具體的實施方案中,所述fc受體是fcγ受體。在一個實施方案中,所述fc受體是人fc受體。在一個實施方案中,所述fc受體是活化性fc受體。在一個特定的實施方案中,所述fc受體是活化性人fcγ受體,更具體地是人fcγriiia,fcγri或fcγriia,最具體地是人fcγriiia。在一個實施方案中,效應器功能是選自下組的一項或多項:cdc,adcc,adcp,和細胞因子分泌。在一個具體的實施方案中,所述效應器功能是adcc。在一個實施方案中,所述fc域展現出與天然igg1fc域相比基本相似的對新生兒fc受體(fcrn)的結合親和力。當fc域(或包含所述fc域的t細胞活化性雙特異性抗原結合分子)展現出超過約70%,特別是超過約80%,更特別是超過約90%的天然igg1fc域(或包含天然igg1fc域的t細胞活化性雙特異性抗原結合分子)對fcrn的結合親和力時,實現基本相似的對fcrn的結合。在某些實施方案中,fc域工程化改造為具有與非工程化fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能。在具體的實施方案中,t細胞活化性雙特異性抗原結合分子的fc域包含一處或多處降低fc域對fc受體的結合親和力和/或效應器功能的胺基酸突變。通常,fc域的兩個亞基的每一個中存在相同的一處或多處胺基酸突變。在一個實施方案中,所述胺基酸突變降低fc域對fc受體的結合親和力。在一個實施方案中,所述胺基酸突變將fc域對fc受體的結合親和力降低至少2倍,至少5倍,或至少10倍。在有超過一處降低fc域對fc受體的結合親和力的胺基酸突變的實施方案中,這些胺基酸突變的組合可以將fc域對fc受體的結合親和力降低至少10倍,至少20倍,或甚至至少50倍。在一個實施方案中,包含工程化fc域的t細胞活化性雙特異性抗原結合分子展現出與包含非工程化fc域的t細胞活化性雙特異性抗原結合分子相比少於20%,特別是少於10%,更特別是少於5%的對fc受體的結合親和力。在一個具體的實施方案中,fc受體是fcγ受體。在一些實施方案中,所述fc受體是人fc受體。在一些實施方案中,fc受體是活化性fc受體。在一個特定的實施方案中,fc受體是活化性人fcγ受體,更特別是人fcγriiia,fcγri或fcγriia,最特別是人fcγriiia。優選地,對這些受體的每一種的結合是降低的。在一些實施方案中,對補體成分的結合親和力,特別是對c1q的結合親和力也是降低的。在一個實施方案中,對新生兒fc受體(fcrn)的結合親和力沒有降低。當fc域(或包含所述fc域的t細胞活化性雙特異性抗原結合分子)展現出非工程化形式的fc域(或包含所述非工程化形式的fc域的t細胞活化性雙特異性抗原結合分子)對fcrn的結合親和力的超過約70%時,實現基本相似的對fcrn的結合,即保留該fc域對所述受體的結合親和力。fc域或包含所述fc域的本發明的t細胞活化性雙特異性抗原結合分子可以展現出超過約80%和甚至超過約90%的此類親和力。在某些實施方案中,t細胞活化性雙特異性抗原結合分子的fc域工程化改造為具有與非工程化fc域相比降低的效應器功能。所述降低的效應器功能可包括但不限於下列一項或多項:降低的補體依賴性細胞毒性(cdc),降低的抗體依賴性細胞介導的細胞毒性(adcc),降低的抗體依賴性細胞吞噬作用(adcp),降低的細胞因子分泌,降低的免疫複合物介導的抗原呈遞細胞的抗原攝取,降低的對nk細胞的結合,降低的對巨噬細胞的結合,降低的對單核細胞的結合,降低的對多形核細胞的結合,降低的誘導凋亡的直接信號傳導,降低的靶物結合的抗體的交聯,降低的樹突細胞成熟,或降低的t細胞引發。在一個實施方案中,所述降低的效應器功能是選自下組的一項或多項:降低的cdc,降低的adcc,降低的adcp,和降低的細胞因子分泌。在一個具體的實施方案中,所述降低的效應器功能是降低的adcc。在一個實施方案中,所述降低的adcc小於20%的由非工程化fc域(或包含非工程化fc域的t細胞活化性雙特異性抗原結合分子)誘導的adcc。在一個實施方案中,所述降低fc域對fc受體的結合親和力和/或效應器功能的胺基酸突變是胺基酸替代。在一個實施方案中,fc域包含在選自下組的位置處的胺基酸替代:e233,l234,l235,n297,p331和p329。在一個更特定的實施方案中,fc域包含在選自下組的位置處的胺基酸替代:l234,l235和p329。在一些實施方案中,fc域包含胺基酸替代l234a和l235a。在一個此類實施方案中,fc域是igg1fc域,特別是人igg1fc域。在一個實施方案中,fc域包含在位置p329處的胺基酸替代。在一個更加特定的實施方案中,胺基酸替代是p329a或p329g,特別是p329g。在一個實施方案中,fc域包含在位置p329處的胺基酸替代和又一處在選自以下位置處的胺基酸替代:e233,l234,l235,n297和p331。在一個更加特定的實施方案中,所述又一處胺基酸替代是e233p,l234a,l235a,l235e,n297a,n297d或p331s。在具體的實施方案中,所述fc域包含在位置p329,l234和l235處的胺基酸替代。在更具體的實施方案中,所述fc域包含胺基酸突變l234a,l235a和p329g(「p329glala」)。在一個此類實施方案中,fc域是igg1fc域,特別是人igg1fc域。胺基酸替代組合「p329glala」幾乎完全消除了人igg1fc域的fcγ受體結合,如記載於pct公開文本no.wo2012/130831,其通過提述完整併入本文。wo2012/130831還描述了製備此類突變體fc域的方法和用於測定其特性(諸如fc受體結合或效應器功能)的方法。igg4抗體展現出與igg1抗體相比降低的對fc受體的結合親和力和降低的效應器功能。因此,在一些實施方案中,本發明的t細胞活化性雙特異性抗原結合分子的fc域是igg4fc域,特別是人igg4fc域。在一個實施方案中,所述igg4fc域包含在位置s228處的胺基酸替代,具體是胺基酸替代s228p。為了進一步降低其對fc受體的結合親和力和/或其效應器功能,在一個實施方案中,所述igg4fc域包含在位置l235處的胺基酸替代,具體是胺基酸替代l235e。在另一個實施方案中,所述igg4fc域包含在位置p329處的胺基酸替代,具體是胺基酸替代p329g。在一個具體的實施方案中,所述igg4fc域包含在位置s228,l235和p329處的胺基酸替代,具體是胺基酸替代s228p,l235e和p329g。此類igg4fc域突變體及其fcγ受體結合特性記載於pct公開文本no.wo2012/130831,其通過提述完整併入本文。在一個具體的實施方案中,展現出與天然igg1fc域相比降低的對fc受體的結合親和力和/或降低的效應器功能的fc域是包含胺基酸替代l234a,l235a和任選地p329g的人igg1fc域,或包含胺基酸替代s228p,l235e和任選地p329g的人igg4fc域。在某些實施方案中,已消除fc域的n-糖基化。在一個此類實施方案中,所述fc域包含在位置n297處的胺基酸突變,特別是用丙氨酸(n297a)或天冬氨酸(n297d)替換天冬醯胺的胺基酸替代。在上文和pct公開文本no.wo2012/130831中描述的fc域以外,具有降低的fc受體結合和/或效應器功能的fc域還包括那些具有fc域殘基238,265,269,270,297,327和329中一個或多個的替代的(美國專利no.6,737,056)。此類fc突變體包括具有在胺基酸位置265,269,270,297和327的兩個或更多個處的替代的fc突變體,包括所謂的「dana」fc突變體,其具有殘基265和297到丙氨酸的替代(美國專利no.7,332,581)。可以使用本領域中公知的遺傳或化學方法通過胺基酸刪除,替代,插入或修飾來製備突變體fc域。遺傳方法可以包括編碼dna序列的位點特異性誘變,pcr,基因合成等。正確的核苷酸變化可以通過例如測序來驗證。可以容易地測定對fc受體的結合,例如通過elisa或通過使用標準儀器諸如biacore儀(gehealthcare)的表面等離振子共振(spr)進行,並且fc受體諸如可通過重組表達獲得。本文中描述了一種合適的此類結合測定法。或者,可使用已知表達特定fc受體的細胞系,如表達fcγiiia受體的人nk細胞來估測fc域或包含fc域的細胞活化性雙特異性抗原結合分子對fc受體的結合親和力。可通過本領域中已知的方法來測量fc域或包含fc域的t細胞活化性雙特異性抗原結合分子的效應器功能。本文中描述了用於測量adcc的一種合適的測定法。評估感興趣分子的adcc活性的體外測定法的其它例子記載於美國專利no.5,500,362;hellstrom等,procnatlacadsciusa83,7059-7063(1986)和hellstrom等,procnatlacadsciusa82,1499-1502(1985);美國專利no.5,821,337;bruggemann等,jexpmed166,1351-1361(1987)。或者,可採用非放射性測定方法(參見例如用於流式細胞術的actitm非放射性細胞毒性測定法(celltechnology,inc.mountainview,ca);和cytotox非放射性細胞毒性測定法(promega,madison,wi))。對於此類測定法有用的效應細胞包括外周血單個核細胞(pbmc)和天然殺傷(nk)細胞。或者/另外,可體內評估感興趣分子的adcc活性,例如在動物模型中,諸如披露於clynes等,procnatlacadsciusa95,652-656(1998)的。在一些實施方案中,fc域對補體成分(特別是對c1q)的結合是降低的。因而,在其中fc域工程化為具有降低的效應器功能的一些實施方案中,所述降低的效應器功能包括降低的cdc。可實施c1q結合測定法來測定t細胞活化性雙特異性抗原結合分子是否能夠結合c1q並因此具有cdc活性。參見例如wo2006/029879和wo2005/100402中的c1q和c3c結合elisa。為了評估補體激活,可實施cdc測定法(參見例如gazzano-santoro等,jimmunolmethods202,163(1996);cragg等,blood101,1045-1052(2003);以及cragg和glennie,blood103,2738-2743(2004))。促進異二聚化的fc域修飾本發明的t細胞活化性雙特異性抗原結合分子包含不同的抗原結合模塊,其中一些融合至fc域的兩個亞基之一個或另一個,如此fc域的兩個亞基通常包含在兩條不相同的多肽鏈中。這些多肽的重組共表達和隨後二聚化導致兩種多肽的數種可能組合。為了改進重組生產中本發明的雙特異性抗體的產率和純度,如此在本發明的雙特異性抗體的fc域中引入促進期望多肽聯合的修飾會是有利的。因而,在具體的實施方案中,本發明的雙特異性抗體的fc域包含促進fc域的第一和第二亞基聯合的修飾。人iggfc域的兩個亞基之間最廣泛的蛋白質-蛋白質相互作用的位點在fc域的ch3域中。如此,在一個實施方案中,所述修飾在fc域的ch3域中。在一個特定的實施方案中,所述修飾是所謂的「節-入-穴」修飾,其包含在fc域的兩個亞基之一中的「節」修飾和在fc域的兩個亞基之另一中的「穴」修飾。節-入-穴技術記載於例如us5,731,168;us7,695,936;ridgway等,proteng9,617-621(1996)和carter,jimmunolmeth248,7-15(2001)。一般地,該方法牽涉在第一多肽的界面處引入隆起(「節」)並在第二多肽的界面中引入相應的空腔(「穴」),使得隆起可以置於空腔中從而促進異二聚體形成並阻礙同二聚體形成。通過將來自第一多肽界面的小胺基酸側鏈用更大的側鏈(例如酪氨酸或色氨酸)替換來構建隆起。在第二多肽的界面中創建具有與隆起相同或相似大小的互補性空腔,其通過將大胺基酸側鏈用更小的胺基酸側鏈(例如丙氨酸或蘇氨酸)替換進行。因而,在一個具體的實施方案中,在本發明的雙特異性抗體的fc域的第一亞基的ch3域中,一個胺基酸殘基用具有更大側鏈體積的胺基酸殘基替換,由此在第一亞基的ch3域內生成隆起,其可安置於第二亞基的ch3域內的空腔中,而且在fc域的第二亞基的ch3域中,一個胺基酸殘基用具有更小側鏈體積的胺基酸殘基替換,由此在第二亞基的ch3域內生成空腔,其中可安置第一亞基的ch3域內的隆起。可以通過改變編碼多肽的核酸,例如通過位點特異性誘變或通過肽合成來生成隆起和空腔。在一個特定的實施方案中,在fc域第一亞基的ch3域中,第366位的蘇氨酸殘基用色氨酸殘基替換(t366w),而在fc域第二亞基的ch3域中,第407位的酪氨酸殘基用纈氨酸殘基替換(y407v)。在一個實施方案中,在fc域第二亞基中,另外,第366位的蘇氨酸殘基用絲氨酸殘基替換(t366s)且第368位的亮氨酸殘基用丙氨酸殘基替換(l368a)。在還有又一個實施方案中,在fc域的第一亞基中,另外,第354位的絲氨酸殘基用半胱氨酸殘基替換(s354c),而在fc域的第二亞基中,另外,第349位的酪氨酸殘基用半胱氨酸殘基替換(y349c)。這兩個半胱氨酸殘基的引入導致在fc域的兩個亞基之間形成二硫橋,進一步穩定了二聚體(carter,jimmunolmethods248,7-15(2001))。在一個備選的實施方案中,促進fc域的第一和第二亞基聯合的修飾包含介導靜電操縱效應(electrostaticsteeringeffect)的修飾,例如如記載於wo2009/089004的。一般地,此方法涉及將在兩個fc域亞基界面處的一個或多個胺基酸殘基替換為帶電荷的胺基酸殘基,從而在靜電上不利於同二聚體形成而在靜電上有利於異二聚化。在一個實施方案中,依照任何上述實施方案的結合folr1和cd3的t細胞活化性雙特異性抗原結合分子包含一個免疫球蛋白g(igg)分子,其具有兩個對folr1特異性的結合位點,其中第一重鏈的fc部分包含第一二聚化模塊且第二重鏈的fc部分包含第二二聚化模塊,容許igg分子的兩條重鏈異二聚化。在又一個優選的實施方案中,依照節入穴策略(參見carterp.;ridgwayj.b.b.;prestal.g.:immunotechnology,volume2,number1,february1996,pp.73-73(1)),第一二聚化模塊包含節且第二二聚化模塊包含穴。t細胞活化性雙特異性抗原結合分子的生物學特性和功能特徵本領域技術人員會領會在癌性和非癌性健康細胞之間選擇性區分的分子的有利效率。實現這一目標的一種方式是通過適宜靶物選擇。可以採用在腫瘤細胞上排他表達的標誌物將效應分子或細胞選擇性靶向腫瘤細胞,同時不傷害不表達此類標誌物的正常細胞。然而,在一些情況中,所謂的腫瘤細胞標誌物也在正常組織中表達,雖然處於較低的水平。正常組織中的這種表達喚起毒性的可能性。如此,本領域需要能更加選擇性地靶向腫瘤細胞的分子。本文中描述的發明提供選擇性靶向folr1陽性腫瘤細胞且不靶向以低水平表達或根本不表達folr1的正常非癌性細胞的t細胞活化性雙特異性抗原結合分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含至少兩個,優選兩個具有相對低親和力的folr1結合模塊,這賦予容許在高和低folr1表達性細胞之間區分的親合效應。因為腫瘤細胞以高或中等水平表達folr1,所以這個本發明的實施方案選擇性結合腫瘤細胞和/或誘導對腫瘤細胞的殺傷,且對以低水平表達或根本不表達folr1的正常非癌性細胞不然。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子處於2+1倒轉的型式。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子誘導t細胞介導的對folr1陽性腫瘤細胞不對非腫瘤細胞的殺傷且包含:包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3的cd3抗原結合模塊和各自包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3的兩個folr1抗原結合模塊。在一個具體的實施方案中,該t細胞活化性雙特異性抗原結合分子不誘導對在它的表面上具有少於約1000個拷貝的folr1的正常細胞的殺傷。在上述有利特徵以外,本發明的一個實施方案不要求化學交聯或雜合辦法來生成。因而,在一個實施方案中,本發明提供能夠在cho細胞中生成的t細胞活化性雙特異性抗原結合分子。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子包含人源化和人多肽。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子不引起fcgr交聯。在一個此類實施方案中,該t細胞活化性雙特異性抗原結合分子能夠在cho細胞中生成且包含:包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3的cd3抗原結合模塊和各自包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3的兩個folr1抗原結合模塊。如上文記錄的,本文中涵蓋的一些實施方案包括具有兩個賦予針對folr1的特異性結合的結合模塊和一個賦予針對t細胞活化性抗原cd3的特異性的結合模塊的t細胞活化性雙特異性抗原結合分子,其中每個個體folr1結合模塊以低親和力接合抗原。因為該分子包含兩個賦予針對folr1的結合的抗原結合模塊,所以該分子的總體親合力仍然提供有效的對folr1表達性靶細胞的結合和t細胞的活化以誘導t細胞效應器功能。考慮到雖然folr1在腫瘤細胞上以各種水平表達,但是它在某些正常細胞中也以很低水平(例如細胞表面上少於約1000個拷貝)表達,本領域技術人員會容易地認識到此類分子用作治療劑的有利效率。此類分子選擇性靶向腫瘤細胞,勝過正常細胞。如此,與以高親和力結合folr1以誘導效應器功能的分子相比,此類分子可以以顯著更少的關於源自folr1陽性正常細胞的毒性的擔憂施用於有所需要的個體。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以約5.36pm至約4nm的表觀kd結合人folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以約4nm的表觀kd結合人和食蟹猴folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以約1.5nm的表觀kd結合鼠folr1。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以至少約1000nm的單價結合kd結合人folr1。在一個具體的實施方案中,該t細胞活化性雙特異性抗原結合分子以約4nm的表觀kd結合人和食蟹猴folr1,以約1.5nm的表觀kd結合鼠folr1,且包含:包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3的cd3抗原結合模塊和各自包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3的兩個folr1抗原結合模塊。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子以至少約1000nm的單價結合kd結合人folr1且包含:包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3的cd3抗原結合模塊和各自包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3的兩個folr1抗原結合模塊。如上文描述的,本文中涵蓋的t細胞活化性雙特異性抗原結合分子能誘導t細胞效應器功能,例如細胞表面標誌物表達,細胞因子生成,t細胞介導的殺傷。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外誘導t細胞介導的對folr1表達性靶細胞,諸如人腫瘤細胞的殺傷。在一個實施方案中,該t細胞為cd8陽性t細胞。folr1表達性人腫瘤細胞的例子包括但不限於hela,skov-3,ht-29,和hrcepic細胞。可用於體外測試的其它folr1陽性人癌細胞是熟練技術人員容易獲得的。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外在24小時之後以介於約36pm和約39573pm之間的ec50誘導t細胞介導的對folr1表達性人腫瘤細胞的殺傷。具體涵蓋t細胞活化性雙特異性抗原結合分子在體外在24小時之後以約36pm的ec50誘導t細胞介導的對folr1表達性腫瘤細胞的殺傷。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外在24小時之後以約178.4pm的ec50誘導t細胞介導的對folr1表達性腫瘤細胞的殺傷。在一個實施方案中,該t細胞活化性雙特異性抗原結合分子在體外在48小時之後以約134.5pm或更大的ec50誘導t細胞介導的對folr1表達性腫瘤細胞的殺傷。可以通過本領域知道的方法,例如通過本文中通過實施例公開的方法來測量ec50。在一個實施方案中,上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子誘導t細胞上cd25和cd69中至少一項的細胞表面表達的上調,如通過流式細胞術測量的。在一個實施方案中,該t細胞為cd4陽性t細胞或cd8陽性t細胞。在一個實施方案中,上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子結合人腫瘤細胞上表達的folr1。在一個實施方案中,上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子結合人folr1上的構象表位。在一個實施方案中,上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子不結合人葉酸受體2(folr2)或人葉酸受體3(folr3)。在上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子的一個實施方案中,該抗原結合模塊結合包含人folr1(seqidno:227)的胺基酸25至234的folr1多肽。在上述實施方案中任一項的t細胞活化性雙特異性抗原結合分子的一個實施方案中,該folr1抗原結合模塊結合包含seqidno:227,230和231的胺基酸序列的folr1多肽,且其中該folr1抗原結合模塊不結合包含seqidno:228和229的胺基酸序列的folr多肽。在一個具體的實施方案中,該t細胞活化性雙特異性抗原結合分子包含如下的folr1抗原結合模塊,該folr1抗原結合模塊結合包含seqidno:227,230和231的胺基酸序列的folr1多肽,且不結合包含seqidno:228和229的胺基酸序列的folr多肽,且包含如下的cd3抗原結合模塊,該cd3抗原結合模塊包含seqidno:37的重鏈cdr1,seqidno:38的重鏈cdr2,seqidno:39的重鏈cdr3,seqidno:32的輕鏈cdr1,seqidno:33的輕鏈cdr2,和seqidno:34的輕鏈cdr3和兩個如下的folr1抗原結合模塊,該folr1抗原結合模塊各自包含seqidno:8的重鏈cdr1,seqidno:9的重鏈cdr2,seqidno:50的重鏈cdr3,seqidno:52的輕鏈cdr1,seqidno:53的輕鏈cdr2,和seqidno:54的輕鏈cdr3。就folr1而言,本文中涵蓋的t細胞活化性雙特異性抗原結合分子可具有激動,拮抗或中性效果。激動效果的例子包括在通過folr1結合模塊與靶細胞上的folr1受體接合後誘導或增強經由folr1的信號傳導。拮抗活性的例子包括在通過folr1結合模塊與靶細胞上的folr1受體接合後消除或降低經由folr1的信號傳導。這可以例如通過阻斷或降低葉酸與folr1之間的相互作用而發生。供本發明中使用的例示性pd-1軸結合拮抗劑本文中提供的是用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子和pd-1軸結合拮抗劑。例如,pd-1軸結合拮抗劑包括pd-1結合拮抗劑,pdl1結合拮抗劑和pdl2結合拮抗劑。「pd-1」的備選名稱包括cd279和sleb2。「pdl1」的備選名稱包括b7-h1,b7-4,cd274,和b7-h。「pdl2」的備選名稱包括b7-dc,btdc,和cd273。在一些實施方案中,pd-1,pdl1,和pdl2是人pd-1,pdl1和pdl2。在一些實施方案中,pd-1結合拮抗劑是抑制pd-1與其配體結合配偶結合的分子。在一個具體的方面,pd-1配體結合配偶是pdl1和/或pdl2。在另一個實施方案中,pdl1結合拮抗劑是抑制pdl1與其結合配偶結合的分子。在一個具體的方面,pdl1結合配偶是pd-1和/或b7-1。在另一個實施方案中,pdl2結合拮抗劑是抑制pdl2與其結合配偶結合的分子。在一個具體的方面,pdl2結合配偶是pd-1。拮抗劑可以是抗體,其抗原結合片段,免疫粘附素,融合蛋白,或寡肽。在一些實施方案中,pd-1結合拮抗劑是抗pd-1抗體(例如人抗體,人源化抗體,或嵌合抗體)。在一些實施方案中,抗pd-1抗體選自下組:nivolumab,pembrolizumab,和ct-011。在一些實施方案中,pd-1結合拮抗劑是免疫粘附素(例如包含與恆定區(例如免疫球蛋白序列的fc區)融合的pdl1或pdl2的胞外或pd-1結合部分的免疫粘附素)。在一些實施方案中,pd-1結合拮抗劑是amp-224。nivolumab,又稱為mdx-1106-04,mdx-1106,ono-4538,bms-936558,和,是一種在wo2006/121168中描述的抗pd-1抗體。pembrolizumab,又稱為mk-3475,merck3745,lambrolizumab,,和sch-900475,是一種在wo2009/114335中描述的抗pd-1抗體。ct-011,又稱為hbat或hbat-1,是一種在wo2009/101611中描述的抗pd-1抗體。amp-224,又稱為b7-dcig,是一種在wo2010/027827和wo2011/066342中描述的pdl2-fc融合可溶性受體。在一些實施方案中,抗pd-1抗體是nivolumab(cas登錄號:946414-94-4)。在又一個實施方案中,提供了分離的抗pd-1抗體,其包含重鏈可變區和/或輕鏈可變區,所述重鏈可變區包含來自seqidno:274的重鏈可變區胺基酸序列,所述輕鏈可變區包含來自seqidno:275的輕鏈可變區胺基酸序列。在又一個實施方案中,提供了分離的抗pd-1抗體,其包含重鏈和/或輕鏈序列,其中:(a)重鏈序列與下述重鏈序列具有至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%或100%序列同一性:qvqlvesgggvvqpgrslrldckasgitfsnsgmhwvrqapgkglewvaviwydgskryyadsvkgrftisrdnskntlflqmnslraedtavyycatnddywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk(seqidno:274),或(b)輕鏈序列與下述輕鏈序列具有至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%或100%序列同一性:eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasnratgiparfsgsgsgtdftltisslepedfavyycqqssnwprtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:275)。在一些實施方案中,抗pd-1抗體是pembrolizumab(cas登錄號:1374853-91-4)。在仍有又一個實施方案中,提供了分離的抗pd-1抗體,其包含重鏈可變區和/或輕鏈可變區,所述重鏈可變區包含來自seqidno:276的重鏈可變區胺基酸序列,所述輕鏈可變區包含來自seqidno:277的輕鏈可變區胺基酸序列。在仍有又一個實施方案中,提供了分離的抗pd-1抗體,其包含重鏈和/或輕鏈序列,其中:(a)重鏈序列與下述重鏈序列具有至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%或100%序列同一性:(b)輕鏈序列與下述輕鏈序列具有至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%或100%序列同一性:eivltqspatlslspgeratlscraskgvstsgysylhwyqqkpgqaprlliylasylesgvparfsgsgsgtdftltisslepedfavyycqhsrdlpltfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:277)。在一些實施方案中,pdl1結合拮抗劑是抗pdl1抗體。在一些實施方案中,抗pdl1結合拮抗劑選自下組:yw243.55.s70,mpdl3280a,mdx-1105,和medi4736。mdx-1105,又稱為bms-936559,是一種在wo2007/005874中描述的抗pdl1抗體。抗體yw243.55.s70(seqidno20和21中分別顯示的重和輕鏈可變區序列)是一種在wo2010/077634a1中描述的抗pdl1。medi4736是一種在wo2011/066389和us2013/034559中描述的抗pdl1抗體,通過援引將每一篇收入本文,就像完整列出一樣。可用於本發明方法的抗pdl1抗體及其生成方法的例子記載於pct專利申請wo2010/077634a1和美國專利no.8,217,149,通過援引將每一篇收入本文,就像完整列出一樣。在一些實施方案中,pd-1軸結合拮抗劑是抗pdl1抗體。在一些實施方案中,抗pdl1抗體能夠抑制pdl1和pd-1之間和/或pdl1和b7-1之間的結合。在一些實施方案中,抗pdl1抗體是單克隆抗體。在一些實施方案中,抗pdl1抗體是選自下組的抗體片段:fab,fab』-sh,fv,scfv,和(fab』)2片段。在一些實施方案中,抗pdl1抗體是人源化抗體。在一些實施方案中,抗pdl1抗體是人抗體。可用於本發明的抗pdl1抗體(包括含有此類抗體的組合物),諸如那些記載於wo2010/077634a1的抗pd-l1抗體可以與t細胞活化性抗原結合分子和任選的抗tim3拮抗劑抗體組合使用以治療癌症。在一些實施方案中,抗pdl1抗體含有包含胺基酸序列seqidno:382的重鏈可變區和包含胺基酸序列seqidno:383的輕鏈可變區。在一個實施方案中,抗pdl1抗體含有重鏈可變區多肽,其包含hvr-h1,hvr-h2和hvr-h3序列,其中:(a)hvr-h1序列是gftfsx1swih(seqidno:283);(b)hvr-h2序列是awix2pyggsx3yyadsvkg(seqidno:284);(c)hvr-h3序列是rhwpggfdy(seqidno:285);進一步其中:x1是d或g;x2是s或l;x3是t或s。在一個具體的方面,x1是d;x2是s且x3是t。在另一個方面,多肽進一步包含依照下式的hvr間並置的可變區重鏈框架序列:(hc-fr1)-(hvr-h1)-(hc-fr2)-(hvr-h2)-(hc-fr3)-(hvr-h3)-(hc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在別的方面,框架序列是vh亞組iii共有框架。在又一個方面,至少一個框架序列如下:hc-fr1是evqlvesggglvqpggslrlscaas(seqidno:295)hc-fr2是wvrqapgkglewv(seqidno:296)hc-fr3是rftisadtskntaylqmnslraedtavyycar(seqidno:297)hc-fr4是wgqgtlvtvsa(seqidno:298)。在又一個方面,重鏈多肽與可變區輕鏈進一步組合,所述可變區輕鏈包含hvr-l1,hvr-l2和hvr-l3,其中:(a)hvr-l1序列是rasqx4x5x6tx7x8a(seqidno:286);(b)hvr-l2序列是sasx9lx10s(seqidno:287);(c)hvr-l3序列是qqx11x12x13x14px15t(seqidno:288);進一步其中:x4是d或v;x5是v或i;x6是s或n;x7是a或f;x8是v或l;x9是f或t;x10是y或a;x11是y,g,f,或s;x12是l,y,f或w;x13是y,n,a,t,g,f或i;x14是h,v,p,t或i;x15是a,w,r,p或t。在又一個方面,x4是d;x5是v;x6是s;x7是a;x8是v;x9是f;x10是y;x11是y;x12是l;x13是y;x14是h;x15是a。在又一個方面,輕鏈進一步包含依照下式的hvr間並置的可變區輕鏈框架序列:(lc-fr1)-(hvr-l1)-(lc-fr2)-(hvr-l2)-(lc-fr3)-(hvr-l3)-(lc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在又一個方面,框架序列是vlκi共有框架。在又一個方面,至少一個框架序列如下:lc-fr1是diqmtqspsslsasvgdrvtitc(seqidno:300)lc-fr2是wyqqkpgkapklliy(seqidno:301)lc-fr3是gvpsrfsgsgsgtdftltisslqpedfatyyc(seqidno:302)lc-fr4是fgqgtkveikr(seqidno:303)。在另一個實施方案中,提供了分離的抗pdl1抗體或抗原結合片段,其包含重鏈和輕鏈可變區序列,其中:(a)重鏈包含hvr-h1,hvr-h2和hvr-h3,其中進一步:(i)hvr-h1序列是gftfsx1swih(seqidno:283),(ii)hvr-h2序列是awix2pyggsx3yyadsvkg(seqidno:284)(iii)hvr-h3序列是rhwpggfdy(seqidno:285),且(b)輕鏈包含hvr-l1,hvr-l2和hvr-l3,其中進一步:(i)hvr-l1序列是rasqx4x5x6tx7x8a(seqidno:286),(ii)hvr-l2序列是sasx9lx10s(seqidno:287),和(iii)hvr-l3序列是qqx11x12x13x14px15t(seqidno:288)。進一步其中:x1是d或g;x2是s或l;x3是t或s;x4是d或v;x5是v或i;x6是s或n;x7是a或f;x8是v或l;x9是f或t;x10是y或a;x11是y,g,f,或s;x12是l,y,f或w;x13是y,n,a,t,g,f或i;x14是h,v,p,t或i;x15是a,w,r,p或t。在一個具體的方面,x1是d;x2是s且x3是t。在另一個方面,x4是d;x5是v;x6是s;x7是a;x8是v;x9是f;x10是y;x11是y;x12是l;x13是y;x14是h;x15是a。在又一個方面,x1是d;x2是s且x3是t,x4是d;x5是v;x6是s;x7是a;x8是v;x9是f;x10是y;x11是y;x12是l;x13是y;x14是h且x15是a。在別的方面,重鏈可變區包含如下的hvr間並置的一個或多個框架序列:(hc-fr1)-(hvr-h1)-(hc-fr2)-(hvr-h2)-(hc-fr3)-(hvr-h3)-(hc-fr4),並且輕鏈可變區包含如下的hvr間並置的一個或多個框架序列:(lc-fr1)-(hvr-l1)-(lc-fr2)-(hvr-l2)-(lc-fr3)-(hvr-l3)-(lc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在又一個方面,重鏈框架序列自kabat亞組i,ii,或iii序列衍生。在又一個方面,重鏈框架序列是vh亞組iii共有框架。在又一個方面,一個或多個重鏈框架序列如下:hc-fr1evqlvesggglvqpggslrlscaas(seqidno:295)hc-fr2wvrqapgkglewv(seqidno:296)hc-fr3rftisadtskntaylqmnslraedtavyycar(seqidno:297)hc-fr4wgqgtlvtvsa(seqidno:298)。在又一個方面,輕鏈框架序列自kabatκi,ii,ii或iv亞組序列衍生。在又一個方面,輕鏈框架序列是vlκi共有框架。在又一個方面,一個或多個輕鏈框架序列如下:lc-fr1diqmtqspsslsasvgdrvtitc(seqidno:300)lc-fr2wyqqkpgkapklliy(seqidno:301)lc-fr3gvpsrfsgsgsgtdftltisslqpedfatyyc(seqidno:302)lc-fr4fgqgtkveikr(seqidno:303)。在又一個具體的方面,抗體進一步包含人或鼠恆定區。在又一個方面,人恆定區選自下組:igg1,igg2,igg2,igg3,和igg4。在又一個具體的方面,人恆定區是igg1。在又一個方面,鼠恆定區選自下組:igg1,igg2a,igg2b,和igg3。在又一個方面,鼠恆定區是igg2a。在又一個具體的方面,抗體具有降低的或最小的效應器功能。在又一個具體的方面,最小效應器功能源自「效應器較小(effector-less)的fc突變」或無糖基化(aglycosylation)。在又一個實施方案中,效應器較小的fc突變是恆定區中的n297a或d265a/n297a替代。在又一個實施方案中,提供了抗pdl1抗體,其包含重鏈和輕鏈可變區序列,其中:(a)重鏈進一步包含與gftfsdswih(seqidno:289),awispyggstyyadsvkg(seqidno:290)和rhwpggfdy(seqidno:291)分別具有至少85%序列同一性的hvr-h1,hvr-h2和hvr-h3序列,或(b)輕鏈進一步包含與rasqdvstava(seqidno:292),sasflys(seqidno:293)和qqylyhpat(seqidno:294)分別具有至少85%序列同一性的hvr-l1,hvr-l2和hvr-l3序列。在一個具體的方面,序列同一性是86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%。在另一個方面,重鏈可變區包含如下的hvr間並置的一個或多個框架序列:(hc-fr1)-(hvr-h1)-(hc-fr2)-(hvr-h2)-(hc-fr3)-(hvr-h3)-(hc-fr4),且輕鏈可變區包含如下的hvr間並置的一個或多個框架序列:(lc-fr1)-(hvr-l1)-(lc-fr2)-(hvr-l2)-(lc-fr3)-(hvr-l3)-(lc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在又一個方面,重鏈框架序列自kabat亞組i,ii,或iii序列衍生。在又一個方面,重鏈框架序列是vh亞組iii共有框架。在又一個方面,一個或多個重鏈框架序列如下:hc-fr1evqlvesggglvqpggslrlscaas(seqidno:295)hc-fr2wvrqapgkglewv(seqidno:296)hc-fr3rftisadtskntaylqmnslraedtavyycar(seqidno:297)hc-fr4wgqgtlvtvsa(seqidno:298)。在又一個方面,輕鏈框架序列自kabatκi,ii,ii或iv亞組序列衍生。在又一個方面,輕鏈框架序列是vlκi共有框架。在又一個方面,一個或多個輕鏈框架序列如下:lc-fr1diqmtqspsslsasvgdrvtitc(seqidno:300)lc-fr2wyqqkpgkapklliy(seqidno:301)lc-fr3gvpsrfsgsgsgtdftltisslqpedfatyyc(seqidno:302)lc-fr4fgqgtkveikr(seqidno:303)。在又一個具體的方面,抗體進一步包含人或鼠恆定區。在又一個方面,人恆定區選自下組:igg1,igg2,igg2,igg3,和igg4。在又一個具體的方面,人恆定區是igg1。在又一個方面,鼠恆定區選自下組:igg1,igg2a,igg2b,和igg3。在又一個方面,鼠恆定區是igg2a。在又一個具體的方面,抗體具有降低的或最小的效應器功能。在又一個具體的方面,最小效應器功能源自「效應器較小的fc突變」或無糖基化。在又一個實施方案中,效應器較小的fc突變是恆定區中的n297a或d265a/n297a替代。在又一個實施方案中,提供了分離的抗pdl1抗體,其包含重鏈和輕鏈可變區序列,其中:(a)重鏈序列與下述重鏈序列具有至少85%序列同一性:evqlvesggglvqpggslrlscaasgftfsdswihwvrqapgkglewvawispyggstyyadsvkgrftisadtskntaylqmnslraedtavyycarrhwpggfdywgqgtlvtvsa(seqidno:382),或(b)輕鏈序列與下述輕鏈序列具有至少85%序列同一性:diqmtqspsslsasvgdrvtitcrasqdvstavawyqqkpgkapklliysasflysgvpsrfsgsgsgtdftltisslqpedfatyycqqylyhpatfgqgtkveikr(seqidno:383)。在一個具體的方面,序列同一性是86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%。在另一個方面,重鏈可變區包含如下的hvr間並置的一個或多個框架序列:(hc-fr1)-(hvr-h1)-(hc-fr2)-(hvr-h2)-(hc-fr3)-(hvr-h3)-(hc-fr4),且輕鏈可變區包含如下的hvr間並置的一個或多個框架序列:(lc-fr1)-(hvr-l1)-(lc-fr2)-(hvr-l2)-(lc-fr3)-(hvr-l3)-(lc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在又一個方面,重鏈框架序列自kabat亞組i,ii,或iii序列衍生。在又一個方面,重鏈框架序列是vh亞組iii共有框架。在又一個方面,一個或多個重鏈框架序列如下:hc-fr1evqlvesggglvqpggslrlscaas(seqidno:295)hc-fr2wvrqapgkglewv(seqidno:296)hc-fr3rftisadtskntaylqmnslraedtavyycar(seqidno:297)hc-fr4wgqgtlvtvsa(seqidno:298)。在又一個方面,輕鏈框架序列自kabatκi,ii,ii或iv亞組序列衍生。在又一個方面,輕鏈框架序列是vlκi共有框架。在又一個方面,一個或多個輕鏈框架序列如下:lc-fr1diqmtqspsslsasvgdrvtitc(seqidno:300)lc-fr2wyqqkpgkapklliy(seqidno:301)lc-fr3gvpsrfsgsgsgtdftltisslqpedfatyyc(seqidno:302)lc-fr4fgqgtkveikr(seqidno:303)。在又一個具體的方面,抗體進一步包含人或鼠恆定區。在又一個方面,人恆定區選自下組:igg1,igg2,igg2,igg3,和igg4。在又一個具體的方面,人恆定區是igg1。在又一個方面,鼠恆定區選自下組:igg1,igg2a,igg2b,和igg3。在又一個方面,鼠恆定區是igg2a。在又一個具體的方面,抗體具有降低的或最小的效應器功能。在又一個具體的方面,最小的效應器功能源自原核細胞中的生成。在又一個具體的方面,最小的效應器功能源自「效應器較小的fc突變」或無糖基化。在又一個實施方案中,效應器較小的fc突變是恆定區中的n297a或d265a/n297a替代。在又一個實施方案中,提供了分離的抗pdl1抗體,其包含重鏈和輕鏈可變區序列,其中:(a)重鏈序列與下述重鏈序列具有至少85%序列同一性:evqlvesggglvqpggslrlscaasgftfsdswihwvrqapgkglewvawispyggstyyadsvkgrftisadtskntaylqmnslraedtavyycarrhwpggfdywgqgtlvtvss(seqidno:280),或(b)輕鏈序列與下述輕鏈序列具有至少85%序列同一性:diqmtqspsslsasvgdrvtitcrasqdvstavawyqqkpgkapklliysasflysgvpsrfsgsgsgtdftltisslqpedfatyycqqylyhpatfgqgtkveikr(seqidno:383)。在又一個實施方案中,提供了分離的抗pd-l1抗體,其包含重鏈和輕鏈可變區序列,其中:(a)重鏈序列與下述重鏈序列具有至少85%序列同一性:evqlvesggglvqpggslrlscaasgftfsdswihwvrqapgkglewvawispyggstyyadsvkgrftisadtskntaylqmnslraedtavyycarrhwpggfdywgqgtlvtvssastk(seqidno:281),或(b)輕鏈序列與下述輕鏈序列具有至少85%序列同一性:diqmtqspsslsasvgdrvtitcrasqdvstavawyqqkpgkapklliysasflysgvpsrfsgsgsgtdftltisslqpedfatyycqqylyhpatfgqgtkveikr(seqidno:282)。在一個具體的方面,序列同一性是86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%。在另一個方面,重鏈可變區包含如下的hvr間並置的一個或多個框架序列:(hc-fr1)-(hvr-h1)-(hc-fr2)-(hvr-h2)-(hc-fr3)-(hvr-h3)-(hc-fr4),且輕鏈可變區包含如下的hvr間並置的一個或多個框架序列:(lc-fr1)-(hvr-l1)-(lc-fr2)-(hvr-l2)-(lc-fr3)-(hvr-l3)-(lc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在又一個方面,重鏈框架序列自kabat亞組i,ii,或iii序列衍生。在又一個方面,重鏈框架序列是vh亞組iii共有框架。在又一個方面,一個或多個重鏈框架序列如下:hc-fr1evqlvesggglvqpggslrlscaas(seqidno:295)hc-fr2wvrqapgkglewv(seqidno:296)hc-fr3rftisadtskntaylqmnslraedtavyycar(seqidno:297)hc-fr4wgqgtlvtvss(seqidno:299)。在又一個方面,輕鏈框架序列自kabatκi,ii,ii或iv亞組序列衍生。在又一個方面,輕鏈框架序列是vlκi共有框架。在又一個方面,一個或多個輕鏈框架序列如下:lc-fr1diqmtqspsslsasvgdrvtitc(seqidno:300)lc-fr2wyqqkpgkapklliy(seqidno:301)lc-fr3gvpsrfsgsgsgtdftltisslqpedfatyyc(seqidno:302)lc-fr4fgqgtkveikr(seqidno:303)。在又一個具體的方面,抗體進一步包含人或鼠恆定區。在又一個方面,人恆定區選自下組:igg1,igg2,igg2,igg3,和igg4。在又一個具體的方面,人恆定區是igg1。在又一個方面,鼠恆定區選自下組:igg1,igg2a,igg2b,和igg3。在又一個方面,鼠恆定區是igg2a。在又一個具體的方面,抗體具有降低的或最小的效應器功能。在又一個具體的方面,最小的效應器功能源自原核細胞中的生成。在又一個具體的方面最小的效應器功能源自「效應器較小的fc突變」或無糖基化。在又一個實施方案中,效應器較小的fc突變是恆定區中的n297a或d265a/n297a替代。在又一個實施方案中,抗pdl1抗體是mpdl3280a(cas登錄號:1422185-06-5)。在又一個實施方案中,提供了分離的抗pdl1抗體,其包含重鏈可變區和/或輕鏈可變區,所述重鏈可變區包含來自seqidno:24或seqidno:28的重鏈可變區胺基酸序列,所述輕鏈可變區包含來自seqidno:21的輕鏈可變區胺基酸序列。在又一個實施方案中,提供了分離的抗pdl1抗體,其包含重鏈和/或輕鏈序列,其中:(a)重鏈序列與下述重鏈序列具有至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%或100%序列同一性:evqlvesggglvqpggslrlscaasgftfsdswihwvrqapgkglewvawispyggstyyadsvkgrftisadtskntaylqmnslraedtavyycarrhwpggfdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seqidno:278),或(b)輕鏈序列與下述輕鏈序列具有至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%或100%序列同一性:diqmtqspsslsasvgdrvtitcrasqdvstavawyqqkpgkapklliysasflysgvpsrfsgsgsgtdftltisslqpedfatyycqqylyhpatfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:279)。在又一個實施方案中,本發明提供了組合物,其包含與至少一種藥學可接受載體組合的任一種上文描述的抗pdl1抗體。在又一個實施方案中,提供了分離的核酸,其編碼抗pdl1抗體的輕鏈或重鏈可變區序列,其中:(a)重鏈進一步包含與gftfsdswih(seqidno:289),awispyggstyyadsvkg(seqidno:290)和rhwpggfdy(seqidno:291)分別具有至少85%序列同一性的hvr-h1,hvr-h2和hvr-h3序列,和(b)輕鏈進一步包含與rasqdvstava(seqidno:292),sasflys(seqidno:293)和qqylyhpat(seqidno:294)分別具有至少85%序列同一性的hvr-l1,hvr-l2和hvr-l3序列。在一個具體的方面,序列同一性是86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%或100%。在各方面,重鏈可變區包含如下的hvr間並置的一個或多個框架序列:(hc-fr1)-(hvr-h1)-(hc-fr2)-(hvr-h2)-(hc-fr3)-(hvr-h3)-(hc-fr4),且輕鏈可變區包含如下的hvr間並置的一個或多個框架序列:(lc-fr1)-(hvr-l1)-(lc-fr2)-(hvr-l2)-(lc-fr3)-(hvr-l3)-(lc-fr4)。在又一個方面,框架序列自人共有框架序列衍生。在別的方面,重鏈框架序列自kabat亞組i,ii,或iii序列衍生。在又一個方面,重鏈框架序列是vh亞組iii共有框架。在又一個方面,一個或多個重鏈框架序列如下:hc-fr1evqlvesggglvqpggslrlscaas(seqidno:295)hc-fr2wvrqapgkglewv(seqidno:296)hc-fr3rftisadtskntaylqmnslraedtavyycar(seqidno:297)hc-fr4wgqgtlvtvsa(seqidno:298)。在又一個方面,輕鏈框架序列自kabatκi,ii,ii或iv亞組序列衍生。在又一個方面,輕鏈框架序列是vlκi共有框架。在又一個方面,一個或多個輕鏈框架序列如下:lc-fr1diqmtqspsslsasvgdrvtitc(seqidno:300)lc-fr2wyqqkpgkapklliy(seqidno:301)lc-fr3gvpsrfsgsgsgtdftltisslqpedfatyyc(seqidno:302)lc-fr4fgqgtkveikr(seqidno:303)。在又一個具體的方面,本文中描述的抗體(諸如抗pd-1抗體,抗pdl1抗體,或抗pdl2抗體)進一步包含人或鼠恆定區。在又一個方面,人恆定區選自下組:igg1,igg2,igg2,igg3,和igg4。在又一個具體的方面,人恆定區是igg1。在又一個方面,鼠恆定區選自下組:igg1,igg2a,igg2b,和igg3。在又一個方面,鼠恆定區是igg2a。在又一個具體的方面,抗體具有降低的或最小的效應器功能。在又一個具體的方面,最小的效應器功能源自原核細胞中的生成。在又一個具體的方面最小的效應器功能源自「效應器較小的fc突變」或無糖基化。在又一個方面,效應器較小的fc突變是恆定區中的n297a或d265a/n297a替代。在又一個方面,本文中提供了編碼本文中描述的任何抗體的核酸。在一些實施方案中,核酸進一步包含適合於表達核酸的載體,所述核酸編碼先前描述的抗pdl1,抗pd-1,或抗pdl2抗體之任一種。在又一個具體的方面,載體進一步包含適合於表達核酸的宿主細胞。在又一個具體的方面,宿主細胞是真核細胞或原核細胞。在又一個具體的方面,真核細胞是哺乳動物細胞,諸如中國倉鼠卵巢(cho)。可以使用本領域中已知的方法,例如通過如下的方法生成抗體或其抗原結合片段,所述方法包括在適合於生成此類抗體或片段的條件下培養含有核酸的宿主細胞,並回收抗體或片段,所述核酸編碼適合於表達的形式的先前描述的抗pdl1,抗pd-1,或抗pdl2抗體或抗原結合片段之任一種。在一些實施方案中,分離的抗pdl1抗體是無糖基化的。抗體的糖基化通常是n連接的或o連接的。n連接指碳水化合物模塊附著至天冬醯胺殘基的側鏈。三肽序列天冬醯胺-x-絲氨酸和天冬醯胺-x-蘇氨酸(其中x是除脯氨酸以外的任何胺基酸)是碳水化合物模塊酶促附著至天冬醯胺側鏈的識別序列。如此,這些三肽序列任一在多肽中的存在創建潛在的糖基化位點。o連接的糖基化指糖n-乙醯基半乳糖胺,半乳糖,或木糖之一附著至羥基胺基酸,最常見絲氨酸或蘇氨酸,儘管也可以使用5-羥基脯氨酸或5-羥基賴氨酸。通過改變胺基酸序列,使得去除上文所述三肽序列(用於n連接的糖基化位點)之一,方便地實現自抗體去除糖基化位點。可以通過將糖基化位點內的天冬醯胺,絲氨酸或蘇氨酸殘基用另一種胺基酸殘基(例如甘氨酸,丙氨酸或保守胺基酸替代)替代來進行改變。在本文中的任何實施方案中,分離的抗pdl1抗體能結合人pdl1(例如uniprotkb/swiss-prot登錄號q9nzq7.1中所示人pdl1)或其變體。在又一個實施方案中,本發明提供了組合物,其包含如本文中提供的抗pdl1,抗pd-1,或抗pdl2抗體或其抗原結合片段和至少一種藥學可接受載體。在一些實施方案中,對個體施用的抗pdl1,抗pd-1,或抗pdl2抗體或其抗原結合片段是包含一種或多種藥學可接受載體的組合物。可以使用本文中描述的或本領域中已知的任何藥學可接受載體。在一些實施方案中,本文所述抗pdl1抗體在配製劑中,該配製劑包含量為約60mg/ml的抗體,濃度為約20mm的組氨酸乙酸酯,濃度為約120mm的蔗糖,和濃度為0.04%(w/v)的聚山梨酯(例如聚山梨酯20),而且該配製劑具有約5.8的ph。在一些實施方案中,本文所述抗pdl1抗體在配製劑中,該配製劑包含量為約125mg/ml的抗體,濃度為約20mm的組氨酸乙酸酯,濃度為約240mm的蔗糖,和濃度為0.02%(w/v)的聚山梨酯(例如聚山梨酯20),而且該配製劑具有約5.5的ph。供本發明中使用的例示性tim3拮抗劑本文中提供的是用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的t細胞活化性雙特異性抗原結合分子,pd-1軸結合拮抗劑,和tim-3拮抗劑。在一個實施方案中,該tim-3拮抗劑為抗tim-3抗體。在一些實施方案中,該抗tim3於37℃120分鐘後誘導至少45%的細胞上表達的tim3內在化,如通過facs分析測定的。該細胞為例如rpmi8226細胞(ccl-155tm)。在一個實施方案中,該抗體於37℃120分鐘後誘導至少55%的tim3表達性rpmi8226細胞(ccl-155tm)上的tim3內在化,如通過facs分析測定的。在一個實施方案中,該抗體於37℃240分鐘後誘導至少60%的tim3表達性rpmi8226細胞(ccl-155tm)上的tim3內在化,如通過facs分析測定的。在一個實施方案中,該抗體於37℃240分鐘後誘導至少65%的tim3表達性rpmi8226細胞(ccl-155tm)上的tim3內在化,如通過facs分析測定的。在一些實施方案中,該抗tim3抗體與包含tim3_0016的vh和vl的抗tim3抗體競爭結合tim3。在一些實施方案中,該抗tim3抗體結合人和食蟹猴tim3。在一些實施方案中,該抗tim3抗體作為免疫綴合物對tim3表達性細胞顯示細胞毒性活性。在一個此類實施方案中,該免疫綴合物作為假單胞菌外毒素a綴合物對rpmi-8226細胞具有0.1或更低的細胞毒性活性的相對ic50值。在一個實施方案中,該抗tim3抗體誘導幹擾素-γ釋放,如通過mlr測定法測定的。在某些實施方案中,該抗tim3抗體結合人和食蟹猴tim3且誘導幹擾素-γ釋放,如通過mlr測定法測定的。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:304的胺基酸序列的hvr-h1;(b)包含seqidno:305的胺基酸序列的hvr-h2;(c)包含seqidno:306的胺基酸序列的hvr-h3;(d)包含seqidno:307的胺基酸序列的hvr-l1;或包含seqidno:314的胺基酸序列的hvr-l1;或包含seqidno:315的胺基酸序列的hvr-l1;(e)包含seqidno:308的胺基酸序列的hvr-l2;和(f)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:304的胺基酸序列的hvr-h1;(b)包含seqidno:305的胺基酸序列的hvr-h2;(c)包含seqidno:306的胺基酸序列的hvr-h3;(d)包含seqidno:307的胺基酸序列的hvr-l1;或包含seqidno:314的胺基酸序列的hvr-l1;或包含seqidno:315的胺基酸序列的hvr-l1;(e)包含seqidno:308的胺基酸序列的hvr-l2;和(f)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:304的胺基酸序列的hvr-h1;(b)包含seqidno:305的胺基酸序列的hvr-h2;(c)包含seqidno:306的胺基酸序列的hvr-h3;(d)包含seqidno:307的胺基酸序列的hvr-l1;(e)包含seqidno:308的胺基酸序列的hvr-l2;和(f)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:304的胺基酸序列的hvr-h1;(b)包含seqidno:305的胺基酸序列的hvr-h2;(c)包含seqidno:306的胺基酸序列的hvr-h3;(d)包含seqidno:314的胺基酸序列的hvr-l1;(e)包含seqidno:308的胺基酸序列的hvr-l2;和(f)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:304的胺基酸序列的hvr-h1;(b)包含seqidno:305的胺基酸序列的hvr-h2;(c)包含seqidno:306的胺基酸序列的hvr-h3;(d)包含seqidno:315的胺基酸序列的hvr-l1;(e)包含seqidno:308的胺基酸序列的hvr-l2;和(f)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:307的胺基酸序列的hvr-l1;或包含seqidno:314的胺基酸序列的hvr-l1;或包含seqidno:315的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(c)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:307的胺基酸序列的hvr-l1;或包含seqidno:314的胺基酸序列的hvr-l1;或包含seqidno:315的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:307的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:314的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:304的胺基酸序列的hvr-h1,(ii)包含seqidno:305的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:306的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:315的胺基酸序列的hvr-l1,(ii)包含seqidno:308的胺基酸序列的hvr-l2,和(iii)包含seqidno:309的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:310的vh序列和seqidno:311的vl序列;ii)seqidno:312的vh序列和seqidno:313的vl序列;或iii)i)或ii)下的抗體的vh和vl的人源化變體。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:316的胺基酸序列的hvr-h1;(b)包含seqidno:317的胺基酸序列的hvr-h2;(c)包含seqidno:318的胺基酸序列的hvr-h3;(d)包含seqidno:319的胺基酸序列的hvr-l1;(e)包含seqidno:320的胺基酸序列的hvr-l2;和(f)包含seqidno:321的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:316的胺基酸序列的hvr-h1;(b)包含seqidno:317的胺基酸序列的hvr-h2;(c)包含seqidno:318的胺基酸序列的hvr-h3;(d)包含seqidno:319的胺基酸序列的hvr-l1;(e)包含seqidno:320的胺基酸序列的hvr-l2;和(f)包含seqidno:321的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:316的胺基酸序列的hvr-h1,(ii)包含seqidno:317的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:318的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:319的胺基酸序列的hvr-l1,(ii)包含seqidno:320的胺基酸序列的hvr-l2,和(c)包含seqidno:321的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:316的胺基酸序列的hvr-h1,(ii)包含seqidno:317的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:318的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:319的胺基酸序列的hvr-l1,(ii)包含seqidno:320的胺基酸序列的hvr-l2,和(iii)包含seqidno:321的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:322的vh序列和seqidno:323的vl序列;或ii)i)下的抗體的vh和vl的人源化變體。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:324的胺基酸序列的hvr-h1;(b)包含seqidno:325的胺基酸序列的hvr-h2;(c)包含seqidno:326的胺基酸序列的hvr-h3;(d)包含seqidno:327的胺基酸序列的hvr-l1;(e)包含seqidno:328的胺基酸序列的hvr-l2;和(f)包含seqidno:329的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:324的胺基酸序列的hvr-h1;(b)包含seqidno:325的胺基酸序列的hvr-h2;(c)包含seqidno:326的胺基酸序列的hvr-h3;(d)包含seqidno:327的胺基酸序列的hvr-l1;(e)包含seqidno:328的胺基酸序列的hvr-l2;和(f)包含seqidno:329的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:324的胺基酸序列的hvr-h1,(ii)包含seqidno:325的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:326的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:327的胺基酸序列的hvr-l1,(ii)包含seqidno:328的胺基酸序列的hvr-l2,和(c)包含seqidno:329的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:324的胺基酸序列的hvr-h1,(ii)包含seqidno:325的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:326的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:327的胺基酸序列的hvr-l1,(ii)包含seqidno:328的胺基酸序列的hvr-l2,和(iii)包含seqidno:329的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:330的vh序列和seqidno:331的vl序列;ii)i)下的抗體的vh和vl的人源化變體。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:332的胺基酸序列的hvr-h1;(b)包含seqidno:333的胺基酸序列的hvr-h2;(c)包含seqidno:334的胺基酸序列的hvr-h3;(d)包含seqidno:335的胺基酸序列的hvr-l1;(e)包含seqidno:336的胺基酸序列的hvr-l2;和(f)包含seqidno:337的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:332的胺基酸序列的hvr-h1;(b)包含seqidno:333的胺基酸序列的hvr-h2;(c)包含seqidno:334的胺基酸序列的hvr-h3;(d)包含seqidno:335的胺基酸序列的hvr-l1;(e)包含seqidno:336的胺基酸序列的hvr-l2;和(f)包含seqidno:337的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:332的胺基酸序列的hvr-h1,(ii)包含seqidno:333的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:334的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:335的胺基酸序列的hvr-l1,(ii)包含seqidno:336的胺基酸序列的hvr-l2,和(c)包含seqidno:337的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:332的胺基酸序列的hvr-h1,(ii)包含seqidno:333的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:334的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:335的胺基酸序列的hvr-l1,(ii)包含seqidno:336的胺基酸序列的hvr-l2,和(iii)包含seqidno:337的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:338的vh序列和seqidno:339的vl序列;ii)i)下的抗體的vh和vl的人源化變體。在一個方面,本發明提供一種抗tim3抗體,其包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:340的胺基酸序列的hvr-h1;(b)包含seqidno:341的胺基酸序列的hvr-h2;(c)包含seqidno:342的胺基酸序列的hvr-h3;(d)包含seqidno:343的胺基酸序列的hvr-l1;(e)包含seqidno:344的胺基酸序列的hvr-l2;和(f)包含seqidno:345的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:340的胺基酸序列的hvr-h1;(b)包含seqidno:341的胺基酸序列的hvr-h2;(c)包含seqidno:342的胺基酸序列的hvr-h3;(d)包含seqidno:343的胺基酸序列的hvr-l1;(e)包含seqidno:344的胺基酸序列的hvr-l2;和(f)包含seqidno:345的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:340的胺基酸序列的hvr-h1,(ii)包含seqidno:341的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:342的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:343的胺基酸序列的hvr-l1,(ii)包含seqidno:344的胺基酸序列的hvr-l2,和(c)包含seqidno:345的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:340的胺基酸序列的hvr-h1,(ii)包含seqidno:341的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:342的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:343的胺基酸序列的hvr-l1,(ii)包含seqidno:344的胺基酸序列的hvr-l2,和(iii)包含seqidno:345的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:346的vh序列和seqidno:347的vl序列;ii)i)下的抗體的vh和vl的人源化變體。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:348的胺基酸序列的hvr-h1;(b)包含seqidno:349的胺基酸序列的hvr-h2;(c)包含seqidno:350的胺基酸序列的hvr-h3;(d)包含seqidno:351的胺基酸序列的hvr-l1;(e)包含seqidno:352的胺基酸序列的hvr-l2;和(f)包含seqidno:353的胺基酸序列的hvr-l3。在一個方面,本發明提供一種抗tim3抗體,其包含(a)包含seqidno:348的胺基酸序列的hvr-h1;(b)包含seqidno:349的胺基酸序列的hvr-h2;(c)包含seqidno:350的胺基酸序列的hvr-h3;(d)包含seqidno:351的胺基酸序列的hvr-l1;(e)包含seqidno:352的胺基酸序列的hvr-l2;和(f)包含seqidno:353的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:348的胺基酸序列的hvr-h1,(ii)包含seqidno:349的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:350的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:351的胺基酸序列的hvr-l1,(ii)包含seqidno:352的胺基酸序列的hvr-l2,和(c)包含seqidno:353的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:348的胺基酸序列的hvr-h1,(ii)包含seqidno:349的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:350的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:351的胺基酸序列的hvr-l1,(ii)包含seqidno:352的胺基酸序列的hvr-l2,和(iii)包含seqidno:353的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:354的vh序列和seqidno:355的vl序列;ii)i)下的抗體的vh和vl的人源化變體。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:356的胺基酸序列的hvr-h1;(b)包含seqidno:357的胺基酸序列的hvr-h2;(c)包含seqidno:358的胺基酸序列的hvr-h3;(d)包含seqidno:359的胺基酸序列的hvr-l1;(e)包含seqidno:360的胺基酸序列的hvr-l2;和(f)包含seqidno:361的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:356的胺基酸序列的hvr-h1;(b)包含seqidno:357的胺基酸序列的hvr-h2;(c)包含seqidno:358的胺基酸序列的hvr-h3;(d)包含seqidno:359的胺基酸序列的hvr-l1;(e)包含seqidno:360的胺基酸序列的hvr-l2;和(f)包含seqidno:361的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:356的胺基酸序列的hvr-h1,(ii)包含seqidno:357的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:358的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:359的胺基酸序列的hvr-l1,(ii)包含seqidno:360的胺基酸序列的hvr-l2,和(c)包含seqidno:361的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:356的胺基酸序列的hvr-h1,(ii)包含seqidno:357的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:358的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:359的胺基酸序列的hvr-l1,(ii)包含seqidno:360的胺基酸序列的hvr-l2,和(iii)包含seqidno:361的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:362的vh序列和seqidno:363的vl序列;ii)i)下的抗體的vh和vl的人源化變體。在一個實施方案中,該抗tim3抗體包含至少一種,兩種,三種,四種,五種,或六種選自下述的hvr:(a)包含seqidno:364的胺基酸序列的hvr-h1;(b)包含seqidno:365的胺基酸序列的hvr-h2;(c)包含seqidno:366的胺基酸序列的hvr-h3;(d)包含seqidno:367的胺基酸序列的hvr-l1;(e)包含seqidno:368的胺基酸序列的hvr-l2;和(f)包含seqidno:369的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)包含seqidno:364的胺基酸序列的hvr-h1;(b)包含seqidno:365的胺基酸序列的hvr-h2;(c)包含seqidno:366的胺基酸序列的hvr-h3;(d)包含seqidno:367的胺基酸序列的hvr-l1;(e)包含seqidno:368的胺基酸序列的hvr-l2;和(f)包含seqidno:369的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含至少一種,至少兩種,或所有三種選自下述的vhhvr序列:(i)包含seqidno:364的胺基酸序列的hvr-h1,(ii)包含seqidno:365的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:366的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含至少一種,至少兩種,或所有三種選自下述的vlhvr序列:(i)包含seqidno:367的胺基酸序列的hvr-l1,(ii)包含seqidno:368的胺基酸序列的hvr-l2,和(c)包含seqidno:369的胺基酸序列的hvr-l3。在一個實施方案中,該抗tim3抗體包含(a)如下的vh域,該vh域包含(i)包含seqidno:364的胺基酸序列的hvr-h1,(ii)包含seqidno:365的胺基酸序列的hvr-h2,和(iii)包含選自seqidno:366的胺基酸序列的hvr-h3;和(b)如下的vl域,該vl域包含(i)包含seqidno:367的胺基酸序列的hvr-l1,(ii)包含seqidno:368的胺基酸序列的hvr-l2,和(iii)包含seqidno:369的胺基酸序列的hvr-l3。在一個實施方案中,此類抗tim3抗體包含i)seqidno:370的vh序列和seqidno:371的vl序列;ii)i)下的抗體的vh和vl的人源化變體。在上述實施方案任一中,抗tim3抗體是人源化的。在一個實施方案中,抗tim3抗體包含上述實施方案任一中的hvr,且進一步包含受體人框架,例如人免疫球蛋白框架或人共有框架。在另一個實施方案中,抗tim3抗體包含上述實施方案任一中的hvr,且進一步包含包含此類hvr的vh和vl。在又一個方面,該抗tim3抗體與本文中提供的抗tim3抗體結合相同表位。例如,在某些實施方案中,提供了與包含seqidno:310的vh序列和seqidno:311的vl序列的抗tim3抗體結合相同表位的抗tim3抗體,或與包含seqidno:312的vh序列和seqidno:313的vl序列的抗tim3抗體結合相同表位的抗tim3抗體,或與包含seqidno:322的vh序列和seqidno:323的vl序列的抗tim3抗體結合相同表位的抗體,或提供了與包含seqidno:330的vh序列和seqidno:331的vl序列的抗tim3抗體結合相同表位的抗體,或提供了與包含seqidno:338的vh序列和seqidno:339的vl序列的抗tim3抗體結合相同表位的抗體,或提供了與包含seqidno:346的vh序列和seqidno:347的vl序列的抗tim3抗體結合相同表位的抗體,或提供了與包含seqidno:354的vh序列和seqidno:355的vl序列的抗tim3抗體結合相同表位的抗體,或提供了與包含seqidno:362的vh序列和seqidno:363的vl序列的抗tim3抗體結合相同表位的抗體,或提供了與包含seqidno:370的vh序列和seqidno:371的vl序列的抗tim3抗體結合相同表位的抗體。在一個優選的實施方案中,提供了與包含seqidno:310的vh序列和seqidno:311的vl序列的抗tim3抗體結合相同表位的抗體。在一個實施方案中,該抗tim3與包含seqidno:310的vh序列和seqidno:311的vl序列的抗tim3抗體競爭對人tim3的結合,如在使用tim3表達性rpmi-8226細胞(ccl-155tm)的競爭測定法中測定的。在一個實施方案中,依照上述實施方案任一的抗tim3抗體是單克隆抗體,包括嵌合,人源化或人抗體。在一個實施方案中,抗tim3抗體是抗體片段,例如fv,fab,fab』,scfv,雙抗體,或f(ab』)2片段。在另一個實施方案中,該抗體是全長抗體,例如完整igg1或igg4抗體或本文中定義的其它抗體類或同種型。在又一個方面,依照上述實施方案任一的抗tim3抗體可以單一地或組合地併入本文中描述的任何特徵。在一個實施方案中,該抗tim3抗體為wo2011/155607,wo2013/006490,wo03/063792,wo2009/097394,或wo2011/159877中描述的抗體任一。在一個實施方案中,該抗tim3抗體為f38-2e2。在一些實施方案中,該抗tim-3抗體為來自雜交瘤8b.2c12和25f.1d6及如美國專利申請no.2004/0005322和2005/0191721,sabatos,c.a.etal.,natureimmunol.4:1102-1110,2003,及sanchez-fueyo,a.etal.,natureimmunol.4:1093-1012003中公開的那樣製備的抗體,據此通過援引收錄它們所有,就像完整列出一樣。特別涵蓋針對tim-3的其它抗體,而且可以例如用本文中公開的方法來製備。tim3人序列的核苷酸和蛋白質序列可見於genbank登錄號af251707.1和uniprot登錄號q8tdq0。一種例示性人tim3胺基酸序列列於seqidno:380;一種例示性人tim3胞外域胺基酸序列列於seqidno:381。抗體製備如上文描述的,在一些實施方案中,pd-1結合拮抗劑是抗體(例如抗pd-1抗體,抗pdl1抗體,或抗pdl2抗體)。在一些實施方案中,tim3拮抗劑是抗體(例如抗tim3拮抗性抗體)。可以使用本領域用來生成抗體的可用技術來製備本文中描述的抗體,下面各節中更為詳細地描述了其例示性方法。抗體針對感興趣抗原。例如抗體可以針對pd-1(諸如人pd-1),pdl1(諸如人pdl1),pdl2(諸如人pdl2),tim3(諸如人tim3)。優選地,抗原是生物學上重要的多肽,而且對罹患病症的哺乳動物施用抗體能在該哺乳動物中導致治療好處。在某些實施方案中,本文中描述的抗體具有1μm,150nm,100nm,50nm,10nm,1nm,0.1nm,0.01nm,或0.001nm(例如10-8m或更少,例如10-8m至10-13m,例如10-9m至10-13m)的解離常數(kd)。在一個實施方案中,kd是通過如下述測定法所述用fab型式的感興趣抗體及其抗原實施的放射性標記抗原結合測定法(ria)測量的。通過在存在未標記抗原的滴定系列的情況中用最小濃度的(125i)標記抗原平衡fab,然後用抗fab抗體包被板捕捉結合的抗原來測量fab對抗原的溶液結合親和力(參見例如chenetal.,j.mol.biol.293:865-881(1999))。為了建立測定法的條件,將多孔板(thermoscientific)用50mm碳酸鈉(ph9.6)中的5μg/ml捕捉用抗fab抗體(cappellabs)包被過夜,隨後用pbs中的2%(w/v)牛血清清蛋白於室溫(大約23℃)封閉2-5小時。在非吸附板(nunc#269620)中,將100pm或26pm[125i]-抗原與連續稀釋的感興趣fab混合。然後將感興趣fab溫育過夜;然而,溫育可持續更長時段(例如約65個小時)以確保達到平衡。此後,將混合物轉移至捕捉板,於室溫溫育(例如1小時)。然後除去溶液,並用pbs中的0.1%聚山梨酯20(tween-)洗板8次。板乾燥後,添加150μl/孔閃爍液(microscint-20tm;packard),然後在topcounttm伽馬計數儀(packard)上對板計數10分鐘。選擇各fab給出小於或等於最大結合之20%的濃度用於競爭性結合測定法。依照另一個實施方案,kd是使用表面等離振子共振測定法使用-2000或-3000(biacore,inc.,piscataway,nj)於25℃使用固定化抗原cm5晶片在約10個響應單位(ru)測量的。簡言之,依照供應商的用法說明書用鹽酸n-乙基-n』-(3-二甲基氨基丙基)-碳二亞胺(edc)和n-羥基琥珀醯亞胺(nhs)活化羧甲基化右旋糖苷生物傳感器晶片(cm5,biacore,inc.)。將抗原用10mm乙酸鈉ph4.8稀釋至5μg/ml(約0.2μm),然後以5μl/分鐘的流速注射以獲得大約10個響應單位(ru)的偶聯蛋白質。注入抗原後,注入1m乙醇胺以封閉未反應基團。為了動力學測量,於25℃以大約25μl/分鐘的流速注入在含0.05%聚山梨酯20(tween-20tm)表面活性劑的pbs(pbst)中兩倍連續稀釋的fab(0.78nm至500nm)。使用簡單一對一朗格繆爾(langmuir)結合模型(evaluation軟體版本3.2)通過同時擬合結合和解離傳感圖計算結合速率(kon)和解離速率(koff)。平衡解離常數(kd)以比率koff/kon計算。參見例如chenetal.,j.mol.biol.293:865-881(1999)。如果根據上文表面等離振子共振測定法,結合速率超過106m-1s-1,那麼可使用螢光淬滅技術來測定結合速率,即根據分光計諸如配備了斷流裝置的分光光度計(avivinstruments)或8000系列slm-amincotm分光光度計(thermospectronic)中用攪拌比色杯進行的測量,在存在濃度漸增的抗原的情況中,測量pbsph7.2中20nm抗抗原抗體(fab形式)於25℃的螢光發射強度(激發=295nm;發射=340nm,16nm帶通)的升高或降低。在一些實施方案中,本文所述抗tim3抗體展現至少100pm或更少的針對人tim3的結合親和力,至少300pm或更少的針對人tim3的結合親和力,至少400pm或更少的針對人tim3的結合親和力,至少40nm或更少的針對人tim3的中和能力,至少120nm或更少的針對人tim3的中和能力,和至少31nm或更少的針對人tim3的中和能力。在這些實施方案中,可以如美國專利no.8,771,697中所述通過表面等離振子共振測量結合親和力。抗體片段在某些實施方案中,本文中描述的抗體是抗體片段。抗體片段包括但不限於fab,fab』,fab』-sh,f(ab』)2,fv,和scfv片段,及下文所描述的其它片段。對於某些抗體片段的綜述,參見hudson等,nat.med.9:129-134(2003)。對於scfv片段的綜述,參見例如pluckthün,於thepharmacologyofmonoclonalantibodies,vol.113,rosenburg和moore編,(springer-verlag,newyork),pp.269-315(1994);亦參見wo93/16185;和美國專利no.5,571,894和5,587,458。對包含補救受體結合表位殘基且具有延長的體內半衰期的fab和f(ab』)2片段的論述,參見美國專利no.5,869,046。雙抗體是具有兩個抗原結合位點的抗體片段,其可以是二價或雙特異性的。參見,例如ep404,097;wo1993/01161;hudson等,nat.med.9:129-134(2003);和hollinger等,proc.natl.acad.sci.usa90:6444-6448(1993)。三抗體和四抗體也記載於hudson等,nat.med.9:129-134(2003)。單域抗體是包含抗體的整個或部分重鏈可變域,或整個或部分輕鏈可變域的抗體片段。在某些實施方案中,單域抗體是人單域抗體(domantis,inc.,waltham,ma;參見例如美國專利no.6,248,516b1)。可以通過各種技術來製備抗體片段,包括但不限於對完整抗體的蛋白水解消化以及通過重組宿主細胞(例如大腸桿菌或噬菌體)產生,如本文中描述的。嵌合抗體和人源化抗體在某些實施方案中,本文中描述的抗體是嵌合抗體。某些嵌合抗體記載於例如美國專利no.4,816,567;及morrisonetal.,proc.natl.acad.sci.usa81:6851-6855(1984)。在一個例子中,嵌合抗體包含非人可變區(例如自小鼠,大鼠,倉鼠,家兔,或非人靈長類,諸如猴衍生的可變區)和人恆定區。在又一個例子中,嵌合抗體是「類轉換的」抗體,其中類或亞類已經自親本抗體的類或亞類改變。嵌合抗體包括其抗原結合片段。在某些實施方案中,嵌合抗體是人源化抗體。通常,將非人抗體人源化以降低對人的免疫原性,同時保留親本非人抗體的特異性和親和力。一般地,人源化抗體包含一個或多個可變域,其中hvr,例如cdr(或其部分)自非人抗體衍生,而fr(或其部分)自人抗體序列衍生。任選地,人源化抗體還會至少包含人恆定區的一部分。在一些實施方案中,將人源化抗體中的一些fr殘基用來自非人抗體(例如衍生hvr殘基的抗體)的相應殘基替代,例如為了恢復或改善抗體特異性或親和力。人源化抗體及其生成方法綜述於例如almagroandfransson,front.biosci.13:1619-1633(2008),並且進一步記載於例如riechmannetal.,nature332:323-329(1988);queenetal.,proc.nat』lacad.sci.usa86:10029-10033(1989);美國專利no.5,821,337,no.7,527,791,no.6,982,321,和no.7,087,409;kashmirietal.,methods36:25-34(2005)(記載sdr(a-cdr)嫁接);padlan,mol.immunol.28:489-498(1991)(記載「重修表面」);dall』acquaetal.,methods36:43-60(2005)(記載「fr改組」);及osbournetal.,methods36:61-68(2005)及klimkaetal.,br.j.cancer83:252-260(2000)(記載fr改組的「引導選擇」辦法)。可以用於人源化的人框架區包括但不限於:使用「最佳擬合(best-fit)」方法選擇的框架區(參見例如simsetal.,j.immunol.151:2296(1993));自輕或重鏈可變區的特定亞組的人抗體的共有序列衍生的框架區(參見例如carteretal.,proc.natl.acad.sci.usa89:4285(1992);及prestaetal.,j.immunol.151:2623(1993));人成熟的(體細胞突變的)框架區或人種系框架區(參見例如almagroandfransson,front.biosci.13:1619-1633(2008));和通過篩選fr文庫衍生的框架區(參見例如bacaetal.,j.biol.chem.272:10678-10684(1997)及rosoketal.,j.biol.chem.271:22611-22618(1996))。人抗體在某些實施方案中,本文中描述的抗體是人抗體。可以使用本領域中已知的多種技術來生成人抗體。一般地,人抗體記載於vandijkandvandewinkel,curr.opin.pharmacol.5:368-74(2001)及lonberg,curr.opin.immunol.20:450-459(2008)。可以通過對轉基因動物施用免疫原來製備人抗體,所述轉基因動物已經修飾為響應抗原性攻擊而生成完整人抗體或具有人可變區的完整抗體。此類動物通常含有整個或部分人免疫球蛋白基因座,其替換內源免疫球蛋白基因座,或者其在染色體外存在或隨機整合入動物的染色體中。在此類轉基因小鼠中,一般已經將內源免疫球蛋白基因座滅活。關於自轉基因動物獲得人抗體的方法的綜述參見lonberg,nat.biotech.23:1117-1125(2005)。還可參見例如美國專利no.6,075,181和no.6,150,584,其描述了xenomousetm技術;美國專利no.5,770,429,其描述了技術;美國專利no.7,041,870,其描述了k-m技術,和美國專利申請公開文本no.us2007/0061900,其描述了技術。可以例如通過與不同人恆定區組合進一步修飾來自由此類動物生成的完整抗體的人可變區。也可以通過基於雜交瘤的方法生成人抗體。已經描述了用於生成人單克隆抗體的人骨髓瘤和小鼠-人異源骨髓瘤細胞系(參見例如kozbor,j.immunol.133:3001(1984);brodeuretal.,monoclonalantibodyproductiontechniquesandapplications,pp.51-63(marceldekker,inc.,newyork,1987);及boerneretal.,j.immunol.147:86(1991))。經由人b細胞雜交瘤技術生成的人抗體也記載於lietal.,proc.natl.acad.sci.usa103:3557-3562(2006)。其它方法包括那些記載於例如美國專利no.7,189,826(其描述了自雜交瘤細胞系生成單複製人igm抗體)及ni,xiandaimianyixue26(4):265-268(2006)(其描述了人-人雜交瘤)的。人雜交瘤技術(trioma技術)也記載於vollmersandbrandlein,histologyandhistopathology20(3):927-937(2005)及vollmersandbrandlein,methodsandfindingsinexperimentalandclinicalpharmacology27(3):185-91(2005)。也可以如下生成人抗體,即分離自人衍生的噬菌體展示文庫選擇的fv克隆可變域序列。然後,可以將此類可變域序列與期望的人恆定域組合。下文描述了自抗體文庫選擇人抗體的技術。文庫衍生的抗體可以通過對組合文庫篩選具有期望的一種或多種活性的抗體來分離抗體。例如,用於生成噬菌體展示文庫及對此類文庫篩選擁有期望結合特徵的抗體的多種方法是本領域中已知的。此類方法綜述於例如hoogenboometal.,inmethodsinmolecularbiology178:1-37(o』brienetal.,ed.,humanpress,totowa,nj,2001),並且進一步記載於例如mccaffertyetal.,nature348:552-554;clacksonetal.,nature352:624-628(1991);marksetal.,j.mol.biol.222:581-597(1992);marksandbradbury,inmethodsinmolecularbiology248:161-175(lo,ed.,humanpress,totowa,nj,2003);sidhuetal.,j.mol.biol.338(2):299-310(2004);leeetal.,j.mol.biol.340(5):1073-1093(2004);fellouse,proc.natl.acad.sci.usa101(34):12467-12472(2004);及leeetal.,j.immunol.methods284(1-2):119-132(2004)。在某些噬菌體展示方法中,將vh和vl基因的全集分別通過聚合酶鏈式反應(pcr)克隆,並在噬菌體文庫中隨機重組,然後可以對所述噬菌體文庫篩選抗原結合噬菌體,如記載於winteretal.,ann.rev.immunol.12:433-455(1994)。噬菌體通常以單鏈fv(scfv)片段或以fab片段展示抗體片段。來自經免疫來源的文庫提供針對免疫原的高親和力抗體,而不需要構建雜交瘤。或者,可以(例如自人)克隆未免疫全集以在沒有任何免疫的情況中提供針對一大批非自身和還有自身抗原的抗體的單一來源,如由griffithsetal.,emboj,12:725-734(1993)描述的。最後,也可以通過自幹細胞克隆未重排的v基因區段,並使用含有隨機序列的pcr引物編碼高度可變的cdr3區並在體外實現重排來合成生成未免疫文庫,如由hoogenboomandwinter,j.mol.biol.227:381-388(1992)所描述的。描述人抗體噬菌體文庫的專利公開文本包括例如:美國專利no.5,750,373及美國專利公開文本no.2005/0079574,2005/0119455,2005/0266000,2007/0117126,2007/0160598,2007/0237764,2007/0292936和2009/0002360。認為自人抗體文庫分離的抗體或抗體片段是本文中的人抗體或人抗體片段。多特異性抗體在某些實施方案中,本文中描述的抗體是多特異性抗體,例如雙特異性抗體。多特異性抗體是對至少兩個不同位點具有結合特異性的單克隆抗體。本文中描述了對folr1和cd3特異性的t細胞活化性雙特異性抗原結合分子的例子。在一些實施方案中,該pd1軸成分拮抗劑是多特異性的。結合特異性之一針對pd-1軸成分(例如pd-1,pdl1,或pdl2),而另一種針對任何其它抗原。在一些實施方案中,結合特異性之一針對il-17或il-17r,而另一種針對任何其它抗原。在某些實施方案中,雙特異性抗體可以結合pd-1軸成分(例如pd-1,pdl1,或pdl2),il-17,或il-17r的兩個不同表位。雙特異性抗體可以以全長抗體或抗體片段製備。在一些實施方案中,結合特異性之一針對pd-1軸成分(例如pd-1,pdl1,或pdl2),而另一種針對il-17或il-17r。本文中提供的是用於在個體中治療癌症或延遲癌症進展的方法,其包括對該個體施用有效量的多特異性抗體,其中該多特異性抗體包含針對pd-1軸成分(例如pd-1,pdl1,或pdl2)的第一結合特異性和針對il-17或il-17r的第二結合特異性。在一些實施方案中,可以通過本文和下文描述的任何技術來生成多特異性抗體。用於生成多特異性抗體的技術包括但不限於具有不同特異性的兩對免疫球蛋白重鏈-輕鏈對的重組共表達(參見milstein和cuello,nature305:537(1983)),wo93/08829,和traunecker等,emboj.10:3655(1991)),和「突起-入-空穴」工程化(參見例如美國專利no.5,731,168)。也可以通過用於生成抗體fc-異二聚體分子的工程化靜電操縱效應(wo2009/089004a1);交聯兩個或更多個抗體或片段(參見例如美國專利no.4,676,980,及brennan等,science,229:81(1985));使用亮氨酸拉鏈來生成雙特異性抗體(參見例如kostelny等,j.immunol.,148(5):1547-1553(1992));使用用於生成雙特異性抗體片段的「雙抗體」技術(參見例如hollinger等,proc.natl.acad.sci.usa,90:6444-6448(1993));及使用單鏈fv(sfv)二聚體(參見例如gruber等,j.immunol.,152:5368(1994));及如例如tutt等,j.immunol.147:60(1991)中所描述的,製備三特異性抗體來生成多特異性抗體。本文中還包括具有三個或更多個功能性抗原結合位點的工程化改造抗體,包括「章魚抗體」(參見例如us2006/0025576a1)。本文中的抗體或片段還包括包含結合pd-1軸成分(例如pd-1,pdl1,或pdl2),il-17,或il-17r及另一種不同抗原的抗原結合位點的「雙重作用fab」或「daf」(參見例如us2008/0069820)。c.核酸序列,載體和生產方法編碼t細胞活化性雙特異性抗原結合分子,例如t細胞活化性雙特異性抗原結合分子,例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子,和抗體的多核苷酸可用於生成本文中描述的t細胞活化性雙特異性抗原結合分子和抗體。本發明的t細胞活化性雙特異性抗原結合分子和抗體可以作為編碼完整雙特異性抗原結合分子的單條多核苷酸或作為多條(例如兩條或更多條)共表達的多核苷酸來表達。由共表達的多核苷酸編碼的多肽可經由例如二硫鍵或其它手段聯合以形成功能性t細胞活化性雙特異性抗原結合分子和抗體。例如,fab片段的輕鏈部分可以與雙特異性抗體或結合folr1的抗體中包含fab片段的重鏈部分,fc域亞基和任選(部分)另一個fab片段的部分由分開的多核苷酸編碼。當共表達時,重鏈多肽會與輕鏈多肽聯合以形成fab片段。又例如,本文中提供的t細胞活化性雙特異性抗原結合分子中或folr1抗原結合部分中包含兩個fc域亞基中的一個和任選(部分)一個或多個fab片段的部分可以與本文中提供的雙特異性抗體或結合folr1的抗體中包含兩個fc域亞基中的另一個和任選(部分)fab片段的部分由分開的多核苷酸編碼。當共表達時,fc域亞基會聯合以形成fc域。在某些實施方案中,所述多核苷酸或核酸為dna。在其它實施方案中,本發明的多核苷酸為rna,例如信使rna(mrna)的形式。本發明的rna可以是單鏈的或雙鏈的。c.抗體變體在某些實施方案中,在上文描述的那些以外,還涵蓋本文中提供的對folr1和cd3特異性的t細胞活化性雙特異性抗原結合分子和抗體的胺基酸序列變體。例如,可以期望改善t細胞活化性雙特異性抗原結合分子的結合親和力和/或其它生物學特性。可以通過將合適的修飾引入編碼t細胞活化性雙特異性抗原結合分子或抗體的核苷酸序列中,或者通過肽合成來製備t細胞活化性雙特異性抗原結合分子和抗體的胺基酸序列變體。此類修飾包括例如對抗體的胺基酸序列內的殘基的刪除,和/或插入和/或替代。可以進行刪除,插入,和替代的任何組合以得到最終的構建體,只要最終的構建體擁有期望的特徵,例如抗原結合。1.替代,插入,和刪除變體在某些實施方案中,提供了具有一處或多處胺基酸替代的變體。替代誘變感興趣的位點包括hvr和fr。保守替代在表b中在「保守替代」的標題下顯示。更實質的變化在表b中在「例示性替代」的標題下提供,並且如下文參照胺基酸側鏈類別進一步描述的。可以將胺基酸替代引入感興趣的抗體中,並且對產物篩選期望的活性,例如保留/改善的抗原結合,降低的免疫原性,或改進的adcc或cdc。表b依照共同的側鏈特性,胺基酸可以如下分組:(1)疏水性的:正亮氨酸,met,ala,val,leu,ile;(2)中性,親水性的:cys,ser,thr,asn,gln;(3)酸性的:asp,glu;(4)鹼性的:his,lys,arg;(5)影響鏈取向的殘基:gly,pro;(6)芳香族的:trp,tyr,phe。非保守替代會需要用這些類別之一的成員替換另一個類別的。一類替代變體牽涉替代親本抗體(例如人源化或人抗體)的一個或多個高變區殘基。一般地,為進一步研究選擇的所得變體相對於親本抗體會具有某些生物學特性的改變(例如改善)(例如升高的親和力,降低的免疫原性)和/或會基本上保留親本抗體的某些生物學特性。例示性的替代變體是親和力成熟的抗體,其可以例如使用基於噬菌體展示的親和力成熟技術諸如本文中所描述的那些技術來方便地生成。簡言之,將一個或多個hvr殘基突變,並將變體抗體在噬菌體上展示,並對其篩選特定的生物學活性(例如結合親和力)。可以對hvr做出變化(例如,替代),例如以改善抗體親和力。可以對hvr「熱點」,即由在體細胞成熟過程期間以高頻率經歷突變的密碼子編碼的殘基(見例如chowdhury,methodsmol.biol.207:179-196(2008)),和/或sdr(a-cdr)做出此類變化,其中對所得的變體vh或vl測試結合親和力。通過次級文庫的構建和再選擇進行的親和力成熟已經記載於例如hoogenboom等於methodsinmolecularbiology178:1-37(o』brien等編,humanpress,totowa,nj,(2001))。在親和力成熟的一些實施方案中,通過多種方法(例如,易錯pcr,鏈改組,或寡核苷酸指導的誘變)將多樣性引入為成熟選擇的可變基因。然後,創建次級文庫。然後,篩選文庫以鑑定具有期望的親和力的任何抗體變體。另一種引入多樣性的方法牽涉hvr指導的方法,其中將幾個hvr殘基(例如,一次4-6個殘基)隨機化。可以例如使用丙氨酸掃描誘變或建模來特異性鑑定牽涉抗原結合的hvr殘基。特別地,經常靶向cdr-h3和cdr-l3。在某些實施方案中,可以在一個或多個hvr內發生替代,插入,或刪除,只要此類變化不實質性降低抗體結合抗原的能力。例如,可以對hvr做出保守變化(例如,保守替代,如本文中提供的),其不實質性降低結合親和力。此類變化可以在hvr「熱點」或sdr外部。在上文提供的變體vh和vl序列的某些實施方案中,每個hvr是未改變的,或者含有不超過1,2或3處胺基酸替代。一種可用於鑑定抗體中可以作為誘變靶位的殘基或區域的方法稱作「丙氨酸掃描誘變」,如由cunningham和wells(1989)science,244:1081-1085所描述的。在此方法中,將一個殘基或一組靶殘基(例如,帶電荷的殘基諸如arg,asp,his,lys,和glu)鑑定,並用中性或帶負電荷的胺基酸(例如,丙氨酸或多丙氨酸)替換以測定抗體與抗原的相互作用是否受到影響。可以在對初始替代表明功能敏感性的胺基酸位置引入進一步的替代。或者/另外,抗原-抗體複合物的晶體結構來鑑定抗體與抗原間的接觸點。作為替代的候選,可以靶向或消除此類接觸殘基和鄰近殘基。可以篩選變體以確定它們是否含有期望的特性。胺基酸序列插入包括長度範圍為1個殘基至含有100或更多個殘基的多肽的氨基和/或羧基端融合,及單個或多個胺基酸殘基的序列內插入。末端插入的例子包括具有n端甲硫氨醯基殘基的抗體。抗體分子的其它插入變體包括抗體的n或c端與酶(例如對於adept)或延長抗體的血清半衰期的多肽的融合物。2.糖基化變體在某些實施方案中,改變本文中提供的t細胞活化性雙特異性抗原結合分子或抗體以提高或降低抗體糖基化的程度。可以通過改變胺基酸序列,使得創建或消除一個或多個糖基化位點來方便地實現對抗體的糖基化位點的添加或刪除。在與本發明一起使用的t細胞活化性雙特異性抗原結合分子或抗體包含fc區的情況中,可以改變其附著的碳水化合物。由哺乳動物細胞生成的天然抗體通常包含分支的,雙觸角寡糖,其一般通過n連接附著於fc區的ch2域的asn297。見例如wright等tibtech15:26-32(1997)。寡糖可以包括各種碳水化合物,例如,甘露糖,n-乙醯葡糖胺(glcnac),半乳糖,和唾液酸,以及附著於雙觸角寡糖結構「主幹」中的glcnac的巖藻糖。在一些實施方案中,可以對本發明的雙特異性抗體或結合dr5的抗體中的寡糖進行修飾以創建具有某些改善的特性的抗體變體。在一個實施方案中,提供了雙特異性抗體變體或抗體的變體,其具有缺乏附著(直接或間接)於fc區的巖藻糖的碳水化合物結構。例如,此類抗體中的巖藻糖量可以是1%至80%,1%至65%,5%至65%或20%至40%。通過相對於附著於asn297的所有糖結構(例如,複合的,雜合的和高甘露糖的結構)的總和,計算asn297處糖鏈內巖藻糖的平均量來測定巖藻糖量,如通過maldi-tof質譜術測量的,例如如記載於wo2008/077546的。asn297指位於fc區中的約第297位(fc區殘基的eu編號方式)的天冬醯胺殘基;然而,asn297也可以由於抗體中的微小序列變異而位於第297位上遊或下遊約±3個胺基酸,即在第294位和第300位之間。此類巖藻糖基化變體可以具有改善的adcc功能。見例如美國專利公開文本no.us2003/0157108(presta,l.);us2004/0093621(kyowahakkokogyoco.,ltd)。涉及「脫巖藻糖基化的」或「巖藻糖缺乏的」抗體變體的出版物的例子包括:us2003/0157108;wo2000/61739;wo2001/29246;us2003/0115614;us2002/0164328;us2004/0093621;us2004/0132140;us2004/0110704;us2004/0110282;us2004/0109865;wo2003/085119;wo2003/084570;wo2005/035586;wo2005/035778;wo2005/053742;wo2002/031140;okazaki等j.mol.biol.336:1239-1249(2004);yamane-ohnuki等biotech.bioeng.87:614(2004)。能夠生成脫巖藻糖基化抗體的細胞系的例子包括蛋白質巖藻糖基化缺陷的lec13cho細胞(ripka等arch.biochem.biophys.249:533-545(1986);美國專利申請nous2003/0157108a1,presta,l;及wo2004/056312a1,adams等,尤其在實施例11),和敲除細胞系,諸如α-1,6-巖藻糖基轉移酶基因fut8敲除cho細胞(見例如yamane-ohnuki等biotech.bioeng.87:614(2004);kanda,y.等,biotechnol.bioeng.,94(4):680-688(2006);及wo2003/085107)。進一步提供了具有兩分型寡糖的t細胞活化性雙特異性抗原結合分子變體或抗體變體,例如其中附著於結合folr1的t細胞活化性雙特異性抗原結合分子的fc區的雙觸角寡糖是通過glcnac兩分的。此類t細胞活化性雙特異性抗原結合分子變體可以具有降低的巖藻糖基化和/或改善的adcc功能。此類抗體變體的例子記載於例如wo2003/011878(jean-mairet等);美國專利no.6,602,684(umana等);及us2005/0123546(umana等)。還提供了在附著於fc區的寡糖中具有至少一個半乳糖殘基的抗體變體。此類抗體變體可以具有改善的cdc功能。此類抗體變體記載於例如wo1997/30087(patel等);wo1998/58964(raju,s.);及wo1999/22764(raju,s.)。3.經半胱氨酸工程化改造的抗體變體在某些實施方案中,可以期望創建經半胱氨酸工程化改造的t細胞活化性雙特異性抗原結合分子和抗體,例如,「thiomab」,其中t細胞活化性雙特異性抗原結合分子的一個或多個殘基用半胱氨酸殘基替代。在具體的實施方案中,替代的殘基存在於t細胞活化性雙特異性抗原結合分子的可接近位點。通過用半胱氨酸替代那些殘基,反應性硫醇基團由此定位於抗體的可接近位點,並且可以用於將抗體與其它模塊,諸如藥物模塊或接頭-藥物模塊綴合,以創建免疫綴合物。在某些實施方案中,可以用半胱氨酸替代下列殘基之任一個或多個:輕鏈的v205(kabat編號方式);重鏈的a118(eu編號方式);和重鏈fc區的s400(eu編號方式)。可以如例如美國專利no.7,521,541所述生成經半胱氨酸工程化改造的抗體。e.重組方法和組合物可以例如通過固相肽合成(例如merrifield固相肽合成)或重組生成來獲得本發明的t細胞活化性雙特異性抗原結合分子和抗體。對於重組生成,分離一種或多種編碼所述t細胞活化性雙特異性抗原結合分子或抗體(或片段)的多核苷酸(例如如上文描述的),並將其插入一種或多種載體中用於在宿主細胞中進一步克隆和/或表達。可以使用常規規程容易分離並測序此類多核苷酸。在一個實施方案中,提供包含一種或多種本發明的多核苷酸的載體(優選為表達載體)。可以使用本領域技術人員公知的方法來構建含有t細胞活化性雙特異性抗原結合分子或抗體的編碼序列以及適宜的轉錄/翻譯控制信號的表達載體。這些方法包括體外重組dna技術,合成技術和體內重組/遺傳重組。參見例如記載於maniatis等,molecularcloning:alaboratorymanual,coldspringharborlaboratory,n.y.(1989);和ausubel等,currentprotocolsinmolecularbiology,greenepublishingassociatesandwileyinterscience,n.y(1989)的技術。表達載體可以是質粒,病毒的一部分或可以是核酸片段。表達載體包含表達盒,其中(在與啟動子和/或其它轉錄或翻譯控制元件的可操作聯合中)克隆編碼t細胞活化性雙特異性抗原結合分子(片段)或抗體(片段)的多核苷酸(即編碼區)。如本文中使用的,「編碼區」是核酸中由翻譯成胺基酸的密碼子組成的一部分。儘管「終止密碼子」(tag,tga或taa)不翻譯成胺基酸,但可將其視為編碼區的一部分(若存在的話),但任何側翼序列例如啟動子,核糖體結合位點,轉錄終止子,內含子,5』和3』非翻譯區等,不是編碼區的一部分。兩個或更多個編碼區可以存在於單一多核苷酸構建體中(例如在單一載體上),或存在於分開的多核苷酸構建體中,例如在分開的(不同的)載體上。此外,任何載體可含有單個編碼區,或可包含兩個或更多個編碼區,例如本發明的載體可以編碼一種或多種多肽,其經由蛋白水解切割在翻譯後或共翻譯分開成最終蛋白質。另外,本發明的載體,多核苷酸或核酸可以編碼異源編碼區,其與編碼t細胞活化性雙特異性抗原結合分子(片段)或抗體或其變體或衍生物的多核苷酸融合或未融合。異源編碼區包括但不限於特殊化的元件或基序,諸如分泌信號肽或異源功能域。當基因產物例如多肽的編碼區與一種或多種調節序列以某種方式聯合從而使得該基因產物的表達置於該調節序列的影響或控制下時,即為可操作聯合。若誘導啟動子功能導致編碼期望的基因產物的mrna的轉錄並且若兩個dna片段之間的連接的性質不幹擾表達調節序列指導基因產物表達的能力或不幹擾dna模板被轉錄的能力,則兩個dna片段(諸如多肽編碼區和與其聯合的啟動子)為「可操作聯合的」。如此,如果啟動子能夠實現編碼多肽的核酸的轉錄,那麼該啟動子區將是與該核酸可操作聯合。啟動子可以是細胞特異性啟動子,其僅在預先確定的細胞中指導dna的實質性轉錄。除啟動子以外,其它轉錄控制元件例如增強子,操縱基因,阻遏物和轉錄終止信號能與多核苷酸可操作聯合以指導細胞特異性轉錄。在本文中公開了合適的啟動子和其它轉錄控制區。多種轉錄控制區是本領域技術人員已知的。這些包括但不限於在脊椎動物細胞中發揮功能的轉錄控制區,諸如但不限於來自巨細胞病毒的啟動子和增強子區段(例如立即早期啟動子,連同內含子-a),猿病毒40(例如早期啟動子)和逆轉錄病毒(諸如例如勞斯(rous)肉瘤病毒)。其它轉錄控制區包括那些自脊椎動物基因諸如肌動蛋白,熱休克蛋白,牛生長激素和家兔a-球蛋白衍生的,以及能夠控制真核細胞中基因表達的其它序列。另外的合適的轉錄控制區包括組織特異性啟動子和增強子以及誘導型啟動子(例如四環素誘導型啟動子)。類似地,多種翻譯控制元件是本領域普通技術人員已知的。這些包括但不限於核糖體結合位點,翻譯起始和終止密碼子以及自病毒系統衍生的元件(具體地,內部核糖體進入位點或ires,亦稱為cite序列)。表達盒還可以包含其它特徵,諸如複製起點和/或染色體整合元件,諸如逆轉錄病毒長末端重複(ltr)或腺伴隨病毒(aav)反向末端重複(itr)。本發明的多核苷酸和核酸編碼區可以與編碼分泌或信號肽的另外的編碼區聯合,所述分泌或信號肽指導由本發明的多核苷酸編碼的多肽的分泌。例如,如果期望分泌t細胞活化性雙特異性抗原結合分子或抗體,那麼可以將編碼信號序列的dna置於編碼本發明雙特異性抗體或本發明結合dr5的抗體或其片段的核酸上遊。依照信號假說,由哺乳動物細胞分泌的蛋白質具有信號肽或分泌前導序列,一旦啟動將生長中的蛋白質鏈跨越粗面內質網輸出,就將該信號肽或分泌前導序列從成熟的蛋白質切去。本領域中普通技術人員知曉由脊椎動物細胞分泌的多肽一般具有融合至多肽n端的信號肽,其從所翻譯的多肽切去以生成分泌或「成熟」形式的多肽。在某些實施方案中,使用天然的信號肽,例如免疫球蛋白重鏈或輕鏈信號肽,或該序列的保留指導與其可操作聯合的多肽分泌的能力的功能性衍生物。或者,可以使用異源哺乳動物信號肽或其功能性衍生物。例如,可以將野生型前導序列用人組織纖溶酶原激活劑(tpa)或小鼠β-葡糖醛酸糖苷酶的前導序列取代。可以將編碼能用於促進後期純化(例如組氨酸標籤)或輔助標記t細胞活化性雙特異性抗原結合分子的短蛋白質序列的dna納入t細胞活化性雙特異性抗原結合分子(片段)或抗體(片段)編碼多核苷酸內或其末端。在又一個實施方案中,提供包含本發明的一種或多種多核苷酸的宿主細胞。在某些實施方案中,提供包含本發明的一種或多種載體的宿主細胞。多核苷酸和載體可以單獨地或組合地摻入本文中分別關於多核苷酸和載體所描述的任何特徵。在一個此類實施方案中,宿主細胞包含載體(例如已用該載體轉化或轉染),所述載體包含編碼本發明t細胞活化性雙特異性抗原結合分子或抗體或其部分的多核苷酸。如本文中使用的,術語「宿主細胞」指任何種類能工程化改造以生成本文中公開的t細胞活化性雙特異性抗原結合分子,例如folr1t細胞活化性雙特異性抗原結合分子,或本發明的抗體,例如抗pd-1抗體,抗pd-l1抗體,和抗tim3抗體或其片段的細胞系統。適用於複製本發明的t細胞活化性雙特異性抗原結合分子和抗體及支持其表達的宿主細胞是本領域中公知的。在適當時,可用特定的表達載體轉染或轉導此類細胞,並且可以培養大量的含載體細胞以用於接種大規模發酵罐,從而獲得充足量的t細胞活化性雙特異性抗原結合分子和抗體用於臨床應用。合適的宿主細胞包括原核微生物諸如大腸桿菌,或各種真核細胞,諸如中國倉鼠卵巢細胞(cho),昆蟲細胞等。例如,可以在細菌中生成多肽,特別是在不需要糖基化時。在表達後,可以將多肽在可溶性級分中與細菌細胞糊分離並可以進一步純化。除了原核生物外,真核微生物諸如絲狀真菌或酵母也是適合多肽編碼載體的克隆或表達宿主,包括其糖基化途徑已被「人源化」,導致生成具有部分或完全人的糖基化樣式的多肽的真菌和酵母菌株。參見gerngross,natbiotech22,1409-1414(2004),和li等,natbiotech24,210-215(2006)。適用於表達(糖基化)多肽的宿主細胞還自多細胞生物體(無脊椎動物和脊椎動物)衍生。無脊椎動物細胞的例子包括植物和昆蟲細胞。已鑑定出可與昆蟲細胞一起使用的大量杆狀病毒株,特別是用於轉染草地貪夜蛾(spodopterafrugiperda)細胞。也可以將植物細胞培養物用作宿主。參見例如美國專利no.5,959,177,6,040,498,6,420,548,7,125,978和6,417,429(描述用於在轉基因植物中生成抗體的plantibodiestm技術)。脊椎動物細胞也可以用作宿主。例如,適應於在懸浮液中生長的哺乳動物細胞系可以是有用的。有用的哺乳動物宿主細胞系的其它例子是由sv40轉化的猴腎cv1系(cos-7);人胚腎系(293或293t細胞,如例如記載於graham等,jgenvirol36,59(1977)),幼倉鼠腎細胞(bhk),小鼠塞託利(sertoli)細胞(tm4細胞,如例如記載於mather,biolreprod23,243-251(1980)的),猴腎細胞(cv1),非洲綠猴腎細胞(vero-76),人宮頸癌細胞(hela),犬腎細胞(mdck),牛鼠(buffalorat)肝細胞(brl3a),人肺細胞(w138),人肝細胞(hepg2),小鼠乳房腫瘤細胞(mmt060562),tri細胞(如例如記載於mather等,annalsn.y.acadsci383,44-68(1982)的),mrc5細胞和fs4細胞。其它有用的哺乳動物宿主細胞系包括中國倉鼠卵巢(cho)細胞,包括dhfr-cho細胞(urlaub等,procnatlacadsciusa77,4216(1980));和骨髓瘤細胞系諸如yo,ns0,p3x63和sp2/0。對於某些適用於蛋白質生產的哺乳動物宿主細胞系的綜述,參見例如yazaki和wu,methodsinmolecularbiology,第248卷(b.k.c.lo編,humanapress,totowa,nj),pp.255-268(2003)。宿主細胞包括培養的細胞,例如哺乳動物培養細胞,酵母細胞,昆蟲細胞,細菌細胞和植物細胞等,但還包括在轉基因動物,轉基因植物或培養的植物或動物組織中包含的細胞。在一個實施方案中,宿主細胞是真核細胞,優選為哺乳動物細胞諸如中國倉鼠卵巢(cho)細胞,人胚腎(hek)細胞或淋巴樣細胞(例如y0,ns0,sp20細胞)。本領域中已知在這些系統中表達外來基因的標準技術。可以將表達包含抗原結合域諸如抗體的重鏈或輕鏈的多肽的細胞工程化改造為使得還表達另一抗體鏈,從而使得表達的產物是具有重鏈和輕鏈兩者的抗體。可以將任何動物種類的抗體,抗體片段,抗原結合域或可變區用於本發明的t細胞活化性雙特異性抗原結合分子。可用於本發明的非限制性抗體,抗體片段,抗原結合域或可變區可以是鼠,靈長類或人起源的。如果t細胞活化性雙特異性抗原結合分子意圖供人使用,那麼可以使用嵌合形式的抗體,其中抗體的恆定區來自人。也可以依照本領域中公知的方法製備人源化或全人形式的抗體(參見例如winter的美國專利no.5,565,332)。人源化可以通過各種方法實現,包括但不限於(a)將非人(例如供體抗體)cdr嫁接到人(例如受體抗體)框架和恆定區上,保留或不保留關鍵的框架殘基(例如那些對於保留較好的抗原結合親和力或抗體功能重要的殘基),(b)僅將非人特異性決定區(sdr或a-cdr;對於抗體-抗原相互作用關鍵的殘基)嫁接到人框架和恆定區上,或(c)移植完整的非人可變域,但通過替換表面殘基用人樣部分來「掩飾(cloak)」它們。人源化的抗體及其製備方法綜述於例如almagro和fransson,frontbiosci13,1619-1633(2008),並且還記載於例如riechmann等,nature332,323-329(1988);queen等,procnatlacadsciusa86,10029-10033(1989);美國專利no.5,821,337,7,527,791,6,982,321和7,087,409;jones等,nature321,522-525(1986);morrison等,procnatlacadsci81,6851-6855(1984);morrison和oi,advimmunol44,65-92(1988);verhoeyen等,science239,1534-1536(1988);padlan,molecimmun31(3),169-217(1994);kashmiri等,methods36,25-34(2005)(描述sdr(a-cdr)嫁接);padlan,molimmunol28,489-498(1991)(描述「表面重建」);dall』acqua等,methods36,43-60(2005)(描述「fr改組」);和osbourn等,methods36,61-68(2005)以及klimka等,brjcancer83,252-260(2000)(描述了fr改組的「引導選擇」辦法)。可以使用本領域中已知的各種技術來生成人抗體和人可變區。人抗體一般記載於vandijk和vandewinkel,curropinpharmacol5,368-74(2001)以及lonberg,curropinimmunol20,450-459(2008)。人可變區能形成通過雜交瘤方法製備的人單克隆抗體的一部分及自其衍生(參見例如monoclonalantibodyproductiontechniquesandapplications,pp.51-63(marceldekker,inc.,newyork,1987))。還可以通過對轉基因動物施用免疫原來製備人抗體和人可變區,所述轉基因動物已經過修飾以應答抗原刺激而生成完整的人抗體或具有人可變區的完整抗體(參見例如lonberg,natbiotech23,1117-1125(2005))。還可以通過分離自人衍生的噬菌體展示庫選擇的fv克隆可變區序列來生成人抗體和人可變區(參見例如hoogenboom等,於methodsinmolecularbiology178,1-37(o』brien等編,humanpress,totowa,nj,2001);和mccafferty等,nature348,552-554;clackson等,nature352,624-628(1991))。噬菌體通常展示抗體片段,作為單鏈fv(scfv)片段或作為fab片段。在某些實施方案中,將可用於本發明的抗原結合模塊工程化改造為具有增強的結合親和力,其依照例如公開於美國專利申請公開文本no.2004/0132066的方法進行,其完整內容通過提述據此併入。可以經由酶聯免疫吸附測定法(elisa)或本領域技術人員熟知的其它技術來測量本發明的t細胞活化性雙特異性抗原結合分子結合特定抗原性決定簇的能力,所述其它技術例如表面等離振子共振技術(在biacoret100系統上分析)(liljeblad等,glycoj17,323-329(2000))和傳統的結合測定法(heeley,endocrres28,217-229(2002))。可以使用競爭測定法來鑑定與參照抗體競爭對特定抗原的結合的抗體,抗體片段,抗原結合域或可變域(例如與v9抗體競爭對cd3的結合的抗體)。在某些實施方案中,此類競爭性抗體結合由參照抗體結合的相同表位(例如線性或構象表位)。用於定位抗體結合的表位的詳細的例示性方法在morris(1996)「epitopemappingprotocols,」於methodsinmolecularbiologyvol.66(humanapress,totowa,nj)中提供。在一種例示性競爭測定法中,將固定化的抗原(例如cd3)在溶液中溫育,所述溶液包含結合該抗原的第一經標記抗體(例如us6,054,297中描述的v9抗體)和測試其與第一抗體競爭對抗原的結合的能力的第二未標記抗體。第二抗體可以存在於雜交瘤上清液中。作為對照,將固定化的抗原在溶液中溫育,所述溶液包含第一標記抗體但沒有第二未標記抗體。在允許第一抗體結合抗原的條件下溫育後,除去過量的未結合的抗體,並測量與固定化抗原聯合的標記物的量。如果與固定化抗原聯合的標記物的量在測試樣品中相對於對照樣品實質性降低,那麼這指示第二抗體與第一抗體競爭對抗原的結合。參見harlow和lane(1988)antibodies:alaboratorymanualch.14(coldspringharborlaboratory,coldspringharbor,ny)。在某些實施方案中,將可用於本發明的抗原結合模塊工程化改造為具有增強的結合親和力,其依照例如公開於美國專利申請公開文本no.2004/0132066的方法進行,其完整內容通過提述據此併入。可以經由酶聯免疫吸附測定法(elisa)或本領域技術人員熟知的其它技術來測量本發明的t細胞活化性雙特異性抗原結合分子或抗體結合特定抗原性決定簇的能力,所述其它技術例如表面等離振子共振技術(在biacoret100系統上分析)(liljeblad等,glycoj17,323-329(2000))和傳統的結合測定法(heeley,endocrres28,217-229(2002))。可以使用競爭測定法來鑑定與參照抗體競爭對特定抗原的結合的抗體,抗體片段,抗原結合域或可變域。在某些實施方案中,此類競爭性抗體結合由參照抗體結合的相同表位(例如線性或構象表位)。用於定位抗體結合的表位的詳細的例示性方法在morris(1996)「epitopemappingprotocols,」於methodsinmolecularbiologyvol.66(humanapress,totowa,nj)中提供。在一種例示性競爭測定法中,將固定化的抗原在溶液中溫育,所述溶液包含結合該抗原的第一經標記抗體和測試其與第一抗體競爭對抗原的結合的能力的第二未標記抗體。第二抗體可以存在於雜交瘤上清液中。作為對照,將固定化的抗原在溶液中溫育,所述溶液包含第一標記抗體但沒有第二未標記抗體。在允許第一抗體結合抗原的條件下溫育後,除去過量的未結合的抗體,並測量與固定化抗原聯合的標記物的量。如果與固定化抗原聯合的標記物的量在測試樣品中相對於對照樣品實質性降低,那麼這指示第二抗體與第一抗體競爭對抗原的結合。參見harlow和lane(1988)antibodies:alaboratorymanualch.14(coldspringharborlaboratory,coldspringharbor,ny)。可以通過本領域已知的技術來純化如本文中描述的那樣製備的t細胞活化性雙特異性抗原結合分子和抗體,所述技術諸如高效液相層析,離子交換層析,凝膠電泳,親和層析,大小排阻層析等。用於純化具體蛋白質的實際條件將部分取決於諸如淨電荷,疏水性,親水性等因素,而且對於本領域中的技術人員將是明顯的。對於親和層析純化,可以使用雙特異性抗體或結合dr5的抗體結合的抗體,配體,受體或抗原。例如,對於本發明的雙特異性抗體的親和層析純化,可以使用具有蛋白a或蛋白g的基質。可以連續使用蛋白a或g親和層析和大小排阻層析來分離雙特異性抗體,基本如實施例中描述的。可以通過多種公知的分析方法中的任一種來測定雙特異性抗體或結合dr5的抗體的純度,包括凝膠電泳,高壓液相層析等。c.測定法可以通過本領域中已知的多種測定法對本文中提供的t細胞活化性雙特異性抗原結合分子,例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子和抗體,例如抗pd-1軸結合拮抗性抗體和抗tim3拮抗性抗體鑑定,篩選,或表徵其物理/化學特性和/或生物學活性。1.親和力測定法可以依照實施例中提出的方法使用標準的儀器如biacore儀(gehealthcare)通過表面等離振子共振(spr)測定本文中提供的t細胞活化性雙特異性抗原結合分子,例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子和抗體,例如抗pd-1軸結合拮抗性抗體和抗tim3拮抗性抗體對它們相應抗原,例如folr1,pd-1,pd-l1,tim3的親和力,而且諸如可以通過重組表達獲得受體或靶蛋白。或者,可以例如通過流式細胞術(facs),使用表達特定受體或靶抗原的細胞系來評估本文中提供的t細胞活化性雙特異性抗原結合分子和抗體對它們相應抗原的結合。可以通過表面等離振子共振使用t100儀(gehealthcare)於25℃測量kd。為了分析fc部分與fc受體之間的相互作用,通過固定化於cm5晶片上的抗5xhis抗體(qiagen)(「5xhis」作為seqidno:392公開)來捕捉帶his標籤的重組fc受體並將雙特異性構建體用作分析物。簡言之,將羧甲基化的葡聚糖生物傳感器晶片(cm5,gehealthcare)依照供應商說明書用n-乙基-n』-(3-二甲基氨丙基)-碳二亞胺氫氯化物(edc)和n-羥基琥珀醯亞胺(nhs)活化。將抗5xhis抗體(「5xhis」作為seqidno:392公開)用10mm醋酸鈉ph5.0稀釋至40μg/ml,接著以5μl/分鐘的流速注射以實現約6500響應單位(ru)的偶聯蛋白質。在注射配體後,注射1m乙醇胺以封閉未反應的基團。然後,在4或10nm捕捉fc受體60秒。對於動力學測量,將雙特異性構建體的4倍連續稀釋液(範圍為約500nm至4000nm)在hbs-ep(gehealthcare,10mmhepes,150mmnacl,3mmedta,0.05%表面活性劑p20,ph7.4)中於25℃以30μl/min的流速注射120秒。為了測定對靶抗原的親和力,通過固定化於活化cm5傳感器晶片表面上的抗人fab特異性抗體(gehealthcare)來捕捉雙特異性構建體,如對於抗5xhis抗體(「5xhis」作為seqidno:392公開)所描述的。偶聯蛋白質的最終量為約12000ru。雙特異性構建體在300nm捕捉90秒。使靶抗原在從250至1000nm的濃度範圍以30μl/min的流速通過流動池達180秒。監測解離達180秒。通過扣除在參照流動池上獲得的響應來校正批量折射率(bulkrefractiveindex)差異。使用穩定態響應通過langmuir結合等溫線的非線性曲線擬合來導出解離常數kd。使用簡單的1對1langmuir結合模型(biacoret100評估軟體版本1.1.1)通過同時擬合結合和解離傳感圖來計算結合速率(k結合)和解離速率(k解離)。平衡解離常數(kd)計算為比率k解離/k結合。參見例如chen等,jmolbiol293,865-881(1999)。2.結合測定法和其它測定法在一個方面,對本發明的t細胞活化性雙特異性抗原結合分子,例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子和抗體,例如抗pd-1軸結合拮抗性抗體和抗tim3拮抗性抗體測試其抗原結合活性,例如通過已知的方法諸如elisa,western印跡,等來進行。在另一個方面,可使用競爭測定法來鑑定與特定參照抗體競爭對相應抗原的結合的抗體或片段。在某些實施方案中,此類競爭性抗體結合與特定參照抗體所結合表位相同的表位(例如線性或構象表位)。用於定位抗體所結合表位的詳細例示性方法見morris(1996)「epitopemappingprotocols」,methodsinmolecularbiologyvol.66(humanapress,totowa,nj)。實施例部分描述了別的方法。3.活性測定法在一個方面,提供了用於鑑定具有生物學活性的本文中提供的t細胞活化性雙特異性抗原結合分子,例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子和抗體,例如抗pd-1軸結合拮抗性抗體和抗tim3拮抗性抗體的測定法。生物學活性可包括例如誘導dna片段化,誘導凋亡和靶細胞裂解。還提供了在體內和/或在體外具有此類生物學活性的抗體。在某些實施方案中,對本發明的t細胞活化性雙特異性抗原結合分子和抗體測試此類生物學活性。用於檢測細胞裂解(例如通過測量ldh釋放)或凋亡(例如使用tunel測定法)的測定法是本領域公知的。用於測量adcc或cdc的測定法還記載於wo2004/065540(參見其中的實施例1),通過述及將其完整內容收入本文。d.藥物配製劑通過混合具有期望純度的此類t細胞活化性雙特異性抗原結合分子或抗體與一種或多種任選的藥學可接受載劑(remington’spharmaceuticalsciences第16版,osol,a.編(1980))以凍幹配製劑或水性溶液形式製備如本文中所描述的t細胞活化性雙特異性抗原結合分子,例如包含對葉酸受體1(folr1)特異性的第一抗原結合位點和對cd3特異性的第二抗原結合位點的t細胞活化性雙特異性抗原結合分子和抗體,例如抗pd-1軸結合拮抗性抗體和抗tim3拮抗性抗體的藥物配製劑。一般地,藥學可接受載劑在所採用的劑量和濃度對接受者是無毒的,而且包括但不限於緩衝劑,諸如磷酸鹽,檸檬酸鹽,和其它有機酸;抗氧化劑,包括抗壞血酸和甲硫氨酸;防腐劑(諸如氯化十八烷基二甲基苄基銨;氯化己烷雙胺;苯扎氯銨,苄索氯銨;酚,丁醇或苯甲醇;對羥基苯甲酸烴基酯,諸如對羥基苯甲酸甲酯或丙酯;鄰苯二酚;間苯二酚;環己醇;3-戊醇;和間甲酚);低分子量(少於約10個殘基)多肽;蛋白質,諸如血清清蛋白,明膠或免疫球蛋白;親水性聚合物,諸如聚乙烯吡咯烷酮;胺基酸,諸如甘氨酸,穀氨醯胺,天冬醯胺,組氨酸,精氨酸或賴氨酸;單糖,二糖和其它碳水化合物,包括葡萄糖,甘露糖或糊精;螯合劑,諸如edta;糖類,諸如蔗糖,甘露醇,海藻糖或山梨醇;成鹽相反離子,諸如鈉;金屬複合物(例如zn-蛋白質複合物);和/或非離子表面活性劑,諸如聚乙二醇(peg)。本文中的例示性的藥學可接受載劑進一步包含間質藥物分散劑諸如可溶性中性活性透明質酸酶糖蛋白(shasegp),例如人可溶性ph-20透明質酸酶糖蛋白,諸如rhuph20(baxterinternational,inc.)。某些例示性的shasegp和使用方法,包括rhuph20記載於美國專利公開文本no.2005/0260186和2006/0104968。在一個方面,將shasegp與一種或多種另外的糖胺聚糖酶諸如軟骨素酶組合。例示性的凍幹抗體配製劑記載於美國專利no.6,267,958。水性抗體配製劑包括那些記載於美國專利no.6,171,586和wo2006/044908的,後一種配製劑包含組氨酸-乙酸鹽緩衝液。本文中的配製劑還可含有所治療具體適應症所必需的超過一種活性組分,優選那些活性互補且彼此沒有不利影響的。此類活性組分適於以有效用於所需目的的量而組合存在。活性組分可包載於例如通過凝聚技術或通過界面聚合製備的微膠囊中(例如分別是羥甲基纖維素或明膠微膠囊和聚(甲基丙烯酸甲酯)微膠囊),在膠狀藥物投遞系統中(例如脂質體,清蛋白微球體,微乳劑,納米顆粒和納米膠囊),或在粗滴乳狀液中。此類技術披露於例如remington′spharmaceuticalsciences,第16版,osol,a.編(1980)。可以製備持續釋放製劑。持續釋放製劑的合適的例子包括含有抗體的固體疏水性聚合物的半透性基質,該基質為成形物品形式,例如膜,或微膠囊。要用於體內施用的配製劑一般是無菌的。無菌性可容易地實現,例如通過穿過無菌濾膜過濾。e.治療性方法和組合物可以在治療性方法中使用本文中提供的包含一種或多種t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體和任選的tim3拮抗劑的治療劑組合。在一個方面,提供了作為藥物使用的結合葉酸受體1(folr1)和cd3的t細胞活化性雙特異性抗原結合分子,用於與抗pd-1軸結合拮抗性抗體組合使用。在某些實施方案中,提供了用於與抗pd-1軸結合拮抗性抗體組合使用的結合folr1和cd3的t細胞活化性雙特異性抗原結合分子,用於在治療方法中使用。在某些實施方案中,該組合進一步包含tim3拮抗劑,例如抗tim3拮抗性抗體。在某些實施方案中,本發明提供了用於在治療具有癌症的個體的方法中使用的結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體,該治療包括對個體施用有效量的結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體。在一個此類實施方案中,該方法進一步包括對個體施用有效量的至少一種tim3拮抗劑,例如如下文所描述的。依照任何上述實施方案的「個體」優選是人。在一個優選實施方案中,所述癌症是胰腺癌,肉瘤或結直腸癌。在其它實施方案中,該癌症為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌或間皮瘤。在該癌症為乳腺癌的實施方案中,該乳腺癌可以是三重陰性乳腺癌。在又一個方面,本發明提供了包含結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體的治療劑組合在製造或製備藥物中的用途。在一個實施方案中,該組合進一步包含tim3拮抗劑。在一個實施方案中,該藥物用於治療癌症。在又一個實施方案中,該藥物用於治療癌症的方法,其包括對具有癌症的個體施用有效量的該藥物。在一個此類實施方案中,該方法進一步包括對個體施用有效量的至少一種另外的治療劑,例如如下文所描述的。依照任何上述實施方案的「個體」可以是人。在又一個方面,本發明提供了用於治療癌症的方法。在一個實施方案中,該方法包括對具有癌症的個體施用有效量的包含結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體的治療劑組合。在一個此類實施方案中,該方法進一步包括對個體施用有效量的至少一種另外的治療劑,如下文所描述的。在一個此類實施方案中,該至少一種另外的治療劑是抗tim3拮抗性抗體。依照任何上述實施方案的「個體」可以是人。在一個優選實施方案中,所述癌症是胰腺癌,肉瘤或結直腸癌。在其它實施方案中,該癌症為結直腸癌,肉瘤,頭和頸癌,鱗狀細胞癌,乳腺癌,胰腺癌,胃癌,非小細胞肺癌,小細胞肺癌或間皮瘤。在又一個方面,本發明提供了藥物配製劑,其包含本文中提供的任何結合folr1和cd3的t細胞活化性雙特異性抗原結合分子,例如在任何上述治療性方法中使用,和抗pd-1軸結合拮抗性抗體。在一個實施方案中,藥物配製劑包含本文中提供的任何結合folr1的t細胞活化性雙特異性抗原結合分子和藥學可接受載劑。在另一個實施方案中,藥物配製劑包含本文中提供的任何結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體和至少一種另外的治療劑,例如如下文所描述的。可以通過任何合適的手段,包括胃腸外,肺內,和鼻內,及若期望用於局部治療的話,損傷內施用來施用雙特異性抗體。胃腸外輸注包括肌肉內,靜脈內,動脈內,腹膜內,或皮下施用。部分根據施用是短暫的還是長期的,劑量給藥可以通過任何合適的路徑,例如通過注射,諸如靜脈內或皮下注射進行。本文中涵蓋各種劑量給藥日程表,包括但不限於單次施用或在多個時間點裡的多次施用,推注施用,和脈衝輸注。雙特異性抗體可以以一種符合良好的醫學實踐的方式配製,確定劑量及施用。在此背景中考慮的因素包括所治療的特定病症,所治療的特定哺乳動物,患者個體的臨床狀況,病症的起因,藥劑投遞的部位,施用的方法,施用進度,以及醫學從業人員知道的其它因素。雙特異性抗體無需但任選地與一種或多種目前用於預防或治療所討論病症的藥劑一起配製。此類其它藥劑的有效量取決於配製劑中存在的抗體的量,病症或治療的類型,及上文討論的其它因素。這些藥劑通常以本文所述相同的劑量和施用途徑使用,或以約1-99%的本文所述劑量使用,或以憑經驗/臨床確定為合適的任何劑量並通過任何途徑使用。為了預防或治療疾病,雙特異性抗體的合適劑量會取決於要治療的疾病的類型,抗體的種類,疾病的嚴重性和病程,所給予雙特異性抗體的預防或治療目的,之前的療法,患者的臨床史和對雙特異性抗體的應答及主治醫師的斟酌決定。雙特異性抗體適合於在一次或一系列的治療中施用於患者。取決於疾病的類型和嚴重性,約1μg/kg-15mg/kg(例如0.1mg/kg-10mg/kg)的雙特異性抗體或結合dr5的新穎抗體可作為首次候選劑量給予患者,無論是例如通過一次或多次分開的給藥或通過連續輸注。取決予上述提及的因素,一種典型的日劑量可在約1μg/kg-100mg/kg或更多的範圍內。對於幾天或更長時間的重複給藥,取決於病情,治療通常會持續直至出現疾病症狀得到期望的抑制為止。雙特異性抗體的一種例示性劑量會在約0.05mg/kg至約10mg/kg的範圍中。如此,可以對患者施用約0.5mg/kg,2.0mg/kg,4.0mg/kg或10mg/kg的一劑或多劑。上述劑量可間歇給予,如每周或每三周(例如使得患者得到約2-約20劑,或例如約6劑雙特異性抗體)。可給予初始較高的加載劑量,接著給予較低的一或多劑。然而,可使用其它劑量方案。通過常規技術和測定法易於監測該療法的進展。應當理解,可以替換結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體和任選的抗tim3拮抗性抗體或在結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體和任選的抗tim3拮抗性抗體外使用本發明的免疫綴合物實施任何上述配製劑或治療性方法。l.製品在本發明的另一個方面,提供了一種製品,其含有可用於治療,預防和/或診斷上文所描述的病症的材料。製品包含容器和容器上或與容器聯合的標籤或包裝插頁。合適的容器包括例如瓶,管形瓶,注射器,iv溶液袋,等等。容器可以由多種材料諸如玻璃或塑料形成。容器容納單獨或與另一種組合物組合有效治療,預防和/或診斷狀況的組合物,並且可以具有無菌存取口(例如,容器可以是具有由皮下注射針可穿過的塞子的管形瓶或靜脈內溶液袋)。組合物中的至少一種活性劑是雙特異性抗體且另外的活性劑是本文所述別的化療劑。標籤或包裝插頁指示使用組合物來治療選擇的狀況。此外,製品可以包含(a)其中裝有組合物的第一容器,其中組合物包含雙特異性抗體;和(b)其中裝有組合物的第二容器,其中組合物包含別的細胞毒性或其它方面治療性的藥劑。本發明的這個實施方案中的製品可以進一步包含包裝插頁,其指示可以使用組合物來治療特定的狀況。或者/另外,製品可以進一步包含第二(或第三)容器,其包含藥學可接受緩衝液,諸如抑菌性注射用水(bwfi),磷酸鹽緩衝鹽水,ringer氏溶液和右旋糖溶液。它可以進一步包含從商業和用戶觀點看期望的其它材料,包括其它緩衝液,稀釋劑,濾器,針,和注射器。應當理解,任何上述製品可包括本發明的免疫綴合物來代替或補充結合folr1和cd3的t細胞活化性雙特異性抗原結合分子和抗pd-1軸結合拮抗性抗體和任選的抗tim3拮抗性抗體。iii.實施例以下是本發明的方法和組合物的實施例。應理解鑑於上文提供的一般性描述,可以實踐各種其他實施方案。下面是本發明的方法和組合物的實施例。應當理解,鑑於上文提供的一般性描述,可以實踐各種其他實施方案。通用方法重組dna技術使用標準方法操作dna,如sambrooketal.,molecularcloning:alaboratorymanual;coldspringharborlaboratorypress,coldspringharbor,newyork,1989中描述的。依照製造商的說明書使用分子生物學試劑。關於人免疫球蛋白輕和重鏈的核苷酸序列的一般信息參見:kabat,e.a.etal.,(1991)sequencesofproteinsofimmunologicalinterest,5thed.,nihpublicationno91-3242。dna測序通過雙鏈測序來測定dna序列。基因合成在需要的情況下,期望的基因區段使用適宜的模板通過pcr來生成或由geneartag(regensburg,germany)通過自動化基因合成從合成的寡核苷酸和pcr產物合成。在確切基因序列不可得的情況下,基於來自最近的同源物的序列設計寡核苷酸引物,並通過rt-pcr從源自適宜組織的rna分離基因。將側翼為單一限制性內切核酸酶切割位點的基因區段克隆入標準的克隆/測序載體。從經轉化的細菌純化質粒dna,並通過uv分光術測定濃度。通過dna測序確認亞克隆的基因片段的dna序列。基因區段設計為具有合適的限制性位點以允許亞克隆入相應的表達載體。所有構建體均設計為具有編碼前導肽的5』端dna序列,該前導肽在真核細胞中將蛋白質靶向分泌。從pbmc分離原代人泛t細胞通過histopaque密度離心從富集的淋巴細胞製備物(血沉棕黃層)製備外周血單個核細胞(pbmc),所述製備物自當地血庫或來自健康人供體的新鮮血液獲得。簡言之,將血液用無菌pbs稀釋並小心在histopaque梯度(sigma,h8889)上鋪層。於室溫以450xg離心30分鐘後(關閉制動器),丟棄含pbmc界面上方的血漿部分。將pbmc轉移至新的50mlfalcon管並將管用pbs補充至總體積50ml。將混合物於室溫以400xg離心10分鐘(開啟制動器)。丟棄上清液並將pbmc團粒用無菌pbs清洗兩次(離心步驟為4℃,350xg,10分鐘)。將所得pbmc群自動計數(vicell)並在溫箱中在37℃,5%co2在含有10%fcs和1%l-丙氨醯-l-穀氨醯胺(biochrom,k0302)的rpmi1640培養基中貯存直至測定開始。使用泛t細胞分離試劑盒ii(miltenyibiotec#130-091-156)依照製造商的說明書實施從pbmc富集t細胞。簡言之,將細胞團粒以每1千萬個細胞40μl冷緩衝液(含0.5%bsa,2mmedta的pbs,無菌過濾)稀釋並與每1千萬個細胞10μl生物素-抗體混合物一起於4℃溫育10分鐘。每1千萬個細胞添加30μl冷緩衝液和20μl抗生物素磁珠,並將混合物於4℃再溫育15分鐘。通過添加10-20倍當前體積的緩衝液和300xg,10分鐘的隨後離心步驟來清洗細胞。將高達1億個細胞重懸浮於500μl緩衝液。使用ls柱(miltenyibiotec#130-042-401)依照製造商的說明書實施未標記人泛t細胞的磁性分離。將所得t細胞群自動計數(vicell)並在溫箱中在37℃,5%co2在aim-v培養基中貯存直至測定開始(不超過24小時)。從pbmc分離原代人幼稚t細胞通過histopaque密度離心從富集的淋巴細胞製備物(血沉棕黃層)製備外周血單個核細胞(pbmc),所述製備物(血沉棕黃層)自當地血庫或來自健康人供體的新鮮血液獲得。使用幼稚cd8+t細胞分離試劑盒(miltenyibiotec#130-093-244)依照製造商的說明書實施從pbmc富集t細胞,但是跳過最後一個cd8+t細胞分離步驟(亦見關於分離原代人泛t細胞的描述)。從脾細胞分離鼠泛t細胞從c57bl/6小鼠分離脾,轉移到裝有macs緩衝液(pbs+0.5%bsa+2mmedta)的gentlemacsc管(miltenyibiotech#130-093-237)中,並依照製造商的說明書用gentlemacs解離器解離以獲得單細胞懸浮液。使細胞懸浮液通過預分離濾器以除去剩餘的未解離組織顆粒。於4℃以400xg離心4分鐘後,添加ack裂解緩衝液以裂解紅血球(於室溫溫育5分鐘)。將剩餘細胞用macs緩衝液清洗兩次,計數並用於分離鼠泛t細胞。使用泛t細胞分離試劑盒(miltenyibiotec#130-090-861)依照製造商的說明書實施負(磁性)選擇。將所得t細胞群自動計數(vicell)並立即用於進一步測定。從肝素化血液分離原代食蟹猴pbmc如下通過密度離心從來自健康食蟹猴供體的新鮮血液製備外周血單個核細胞(pbmc):將肝素化血液用無菌pbs以1:3稀釋,並將lymphoprep介質(axonlab#1114545)用無菌pbs稀釋至90%。將2份體積的稀釋血液在1份體積的稀釋密度梯度上鋪層,並通過於室溫以520xg離心30分鐘(無制動)來分離pbmc級分。將pbmc帶轉移入新的50mlfalcon管並通過於4℃以400xg離心10分鐘用無菌pbs清洗。實施一次低速離心以除去血小板(150xg,15分鐘,4℃),將所得pbmc群自動計數(vicell)並立即用於進一步測定。實施例1生物素化葉酸受體-fc融合物的純化為了生成針對人folr1的新抗體,作為單價fc融合蛋白(抗原的胞外域連接至fc-節的鉸鏈區,它與與fc-穴分子共表達)生成下述抗原和篩選工具。基於自genbank或swissprot獲得的序列合成(geneart,regensburg,germany)抗原基因,並插入表達載體以生成具有fc-節(其具有c端avi標籤,供體內或體外生物素化用)的融合蛋白。通過生成期間編碼細菌生物素連接酶的細菌bira基因的共表達來實現體內生物素化。所有基因的表達在含有orip元件(其用於質粒在含有ebna的細胞系中的穩定維持)的質粒上的嵌合mpsv啟動子控制下。為了製備生物素化單體抗原/fc融合分子,用編碼融合蛋白的兩種成分(節和穴鏈)以及bira(生物素化反應必需的一種酶)的三種載體共轉染指數式生長中的懸浮hek293ebna細胞。以9.5:9.5:1比率(「抗原ecd-fc節-avi標籤」:「fc穴」:「bira」)使用相應的載體。對於500ml搖瓶中的蛋白質生成,在轉染之前24小時接種400x106個hek293ebna細胞。對於轉染,將細胞以210g離心5分鐘,並用預溫熱的cdcho培養基替換上清液。在20ml含有200μg載體dna的cdcho培養基中重懸浮表達載體。在添加540μl聚乙烯亞胺(pei)之後,將溶液混合15秒並於室溫溫育10分鐘。之後,將細胞與dna/pei溶液混合,轉移至500ml搖瓶並在具有5%co2氣氛的溫箱中於37℃溫育3小時。溫育後,添加160mlf17培養基並將細胞培養24小時。轉染後1天,對培養物添加1mm丙戊酸和7%補料1(lonza)。還對生產培養基補充100μm生物素。培養7天後,通過將細胞以210g旋轉沉降15分鐘來收集細胞上清液。將溶液無菌過濾(0.22μm濾器),補充疊氮化鈉至終濃度0.01%(w/v),並保存於4℃。通過使用蛋白a的親和層析,接著是大小排阻層析自細胞培養物上清液純化所分泌的蛋白質。對於親和層析,將上清液加載到用40ml20mm磷酸鈉,20mm檸檬酸鈉,ph7.5平衡的hitrap蛋白ahp柱(cv=5ml,gehealthcare)上。通過用至少10個柱體積的20mm磷酸鈉,20mm檸檬酸鈉,ph7.5清洗來去除未結合的蛋白質。使用在20個柱體積的20mm檸檬酸鈉,100mm氯化鈉,100mm甘氨酸,ph3.0上創建的線性ph梯度洗脫結合的蛋白質。然後用10個柱體積的20mm檸檬酸鈉,100mm氯化鈉,100mm甘氨酸,ph3.0清洗柱。通過添加1/10(v/v)的0.5m磷酸鈉,ph8.0來調節收集的級分的ph。將蛋白質濃縮並過濾,之後加載到用20mm組氨酸,140mm氯化鈉,ph6.0平衡的hiloadsuperdex200柱(gehealthcare)上。通過測量280nm處的光密度(od),使用基於胺基酸序列計算的摩爾消光係數來測定蛋白質濃度。通過在還原劑存在和缺失下的sds毛細管電泳遵循製造商的說明書(instrumentcaliperlabchipgx,perkinelmer)分析folr1-fc融合物的純度和分子量。於25℃使用在25mmk2hpo4,125mmnacl,200mml-精氨酸單氫氯化物,0.02%(w/v)nan3,ph6.7運行緩衝液中平衡的tskgelg3000swxl分析性大小排阻柱(tosoh)分析樣品的聚集體含量。通過表面等離振子共振測定法分析經過純化的抗原-fc融合蛋白,使用商品化抗體來確認抗原的正確和天然構象(數據未顯示)。表1:為分離,選擇和反選擇人folr1抗體生成的抗原表2:folr-fc融合物的產率和最終單體含量的匯總。抗原單體[%](sec)產率hufolr110030mg/lcyfolr110032mg/lmufolr110031mg/lhufolr210016mg/lhufolr39538mg/l實施例2具有cd3ε特異性的共同輕鏈的生成本文中描述的t細胞活化性雙特異性分子包含至少一個cd3結合模塊。這個模塊可以通過免疫接種實驗室動物,篩選噬菌體文庫或使用已知的抗cd3抗體來生成。具有cd3ε特異性的共同輕鏈是通過人源化鼠親本抗cd3ε抗體(ch2527)的輕鏈而生成的。為了人源化非人起源的抗體,不得不將來自非人抗體(供體)的cdr殘基移植到人(受體)抗體的框架上。一般而言,通過將供體序列與潛在受體序列集合比對並選擇與供體具有任何合理同源性或在對於結構和活性至關重要的一些位置顯示相似胺基酸的來選擇受體框架序列。在本案中,抗體受體框架搜索是通過將親本抗體的小鼠vl域序列與人種系序列集合比對並選擇顯示高序列同一性的人序列來實施的。令人驚訝的是,在相當不頻繁的屬於λ型的v域家族7,更加準確的說,hvl_7_46(imgt命名法,genbank登錄號z73674)的人輕鏈中找到了就框架序列同源性而言較好的匹配。隨後選擇這種不頻繁的人輕鏈作為受體框架,用於人源化ch2527的輕鏈。將小鼠輕鏈可變域的三個互補決定區(cdr)嫁接到這種受體框架上。既然框架4區不是種系v基因的可變區的一部分,那麼個別進行這個區(j元件)的比對。因而,選擇iglj3-02序列用於人源化這種輕鏈。生成了13種人源化變體(ch2527-vl7_46-1至vl7_46-10,vl7_46-12至vl7_46-14)。它們的差異在於回復突變成鼠v域序列的框架殘基(及其組合)或能保持與人種系序列相同的cdr殘基(kabat定義)。cdr以外的下述框架殘基在最終的人源化vl域變體vl7_46-13中分別回復突變成鼠殘基(列出了鼠殘基):v36,e38,f44,g46,g49,和g57。人j元件iglj3-02與鼠親本抗體的j元件100%相同。實施例3具有cd3ε特異性的人源化變體的spr評估作為2+1tcb型式的嵌合物評估人源化vl變體,即人源化輕鏈v域與鼠重鏈v域配對。在proteonxpr36儀器(bio-rad)上進行spr評估。更加準確的說,以垂直取向在抗fab衍生物glm傳感器晶片(山羊抗人igg,f(ab』)2片段特異性,jacksonimmunoresearch)上直接自培養物上清液捕捉變體。隨後作為單一濃度水平注射下述分析物以分別評估對人和食蟹猴cd3ε的結合:3μmhucd3ε(-1-26)-fc(節)-avi(id807)和2.5μmcycd3ε-(-1-26)-fc(節)-avi-fc(穴)(id873)。將結合響應與鼠對照構建體的結合定性比較,並評級為+(觀察到相當的結合),+/-(觀察到降低的結合)和–(沒有觀察到結合)。在配體捕捉和分析物結合的每個循環之後再生捕捉抗體,並在研究結束時再注射鼠構建體以確認捕捉表面的活性。結果匯總於表3。表3:與ch2527的鼠重鏈組合的人源化輕鏈變體的基於spr的定性結合評估。只有最終選擇的人源化輕鏈變體ch2527-vl7_46-13(以粗體字母突顯)展現相當的對人和食蟹猴cd3ε的結合。實施例4具有cd3ε特異性的人源化共同輕鏈的特性為人源化先導分子選擇的輕鏈v域變體為vl7_46-13。測定人性的程度,即人源化v域與人種系v域序列的序列同源性。對於vl7_46-13,與最接近的人種系同系物的總體序列同一性在人源化之前為65%且在人源化之後為80%。忽略cdr區,與最接近的人種系同系物的序列同一性為92%。自表3可知,vl7_46-13是一組13種變體中唯一顯示與親本鼠抗體相當的結合且還保留它的對食蟹猴cd3ε的交叉反應性的人源化vl變體。這一結果指示人源化鼠vl域而不喪失對cd3ε的結合親和力並非微不足道,這要求幾處回復突變成鼠框架殘基(特別是g46)同時保留cdr1中的g24。另外,這一結果顯示vl域發揮在靶物識別中關鍵作用。重要的是,基於屬於λ型的v域家族7的一種不頻繁的人種系且保留對cd3ε的親和力和特異性的人源化vl域vl7_46-13也適合在fab型式的噬菌體展示抗體文庫中用作共同輕鏈且使得能夠成功選擇新穎特異性,大大推動結合cd3ε和例如腫瘤靶物且共享相同『共同』輕鏈的雙特異性分子的生成和生產。實施例5使用自hvk1-39衍生的人種系共同輕鏈的噬菌體展示抗體文庫的生成生成類似全長人igg的雙特異性抗體的數種辦法利用fc區中誘導兩條不同重鏈異二聚化的修飾。此類例子包括節-入-穴(merchantetal.,natbiotechnol.1998jul;16(7):677-81),seed(davisetal.,proteinengdessel.2010apr;23(4):195-202)和靜電操縱技術(gunasekaranetal.,jbiolchem.2010jun18;285(25):19637-46)。雖然這些辦法能夠實現兩條不同重鏈的有效異二聚化,但是關聯輕和重鏈的恰當配對仍然是個問題。使用共同輕鏈(lc)能解決這個問題(merchant,etal.natbiotech16,677-681(1998))。在此,我們描述用於在m13噬菌體上展示的抗體文庫的生成。本質上,我們設計了重鏈與一種恆定(或「共同」)輕鏈的一種多框架文庫。此文庫設計用於生成多特異性抗體而不需要使用複雜的技術來避免輕鏈錯配。通過使用共同輕鏈能方便這些分子的生成,因為不再發生錯配,而且方便高度純的雙特異性抗體的分離。與其它型式相比,使用fab片段作為構建塊與例如使用scfv片段相比導致更高的熱穩定性且沒有scfv聚集和分子間scfv形成。文庫生成下面描述用於在m13噬菌體上展示的一種抗體文庫的生成。本質上,我們設計了重鏈與一種恆定(或「共同」)輕鏈的一種多框架文庫。我們在文庫中使用這些重鏈(括號中為genbank登錄號):ighv1-46*01(x92343)(seqidno:104),ighv1-69*06(l22583)(seqidno:105),ighv3-15*01(x92216)(seqidno:106),ighv3-23*01(m99660)(seqidno:107),ighv4-59*01(ab019438)(seqidno:108)ighv5-51*01(m99686)(seqidno:109)。所有重鏈使用ighj2作為j元件,ighv1-69*06除外,它使用ighj6序列。隨機化的設計包括cdr-h1,cdr-h2,和cdr-h3。對於cdr-h1和cdr-h2,選擇「軟」隨機化策略,而且隨機化寡核苷酸使得種系序列的胺基酸的密碼子以50%存在。除半胱氨酸以外的所有其它胺基酸合起來成為剩餘50%。在cdr-h3中,其中因遺傳d元件的存在而不存在種系胺基酸,寡核苷酸設計成容許在v元件和j元件之間使用長度為4至9個胺基酸的隨機化插入物。那些寡核苷酸在它們的隨機化部分中含有例如各自以15%存在的三種胺基酸g/y/s,各自以4.6%存在的胺基酸a/d/t/r/p/l/v/n/w/f/i/e。用於生成抗體文庫的例示性方法描述於hoogenboometal.,nucleicacidsres.1991,19,4133-413;leeetal.,j.mol.biol.(2004)340,1073-1093。輕鏈是自人序列hvk1-39衍生的,而且以未修飾且未隨機化的樣式使用。這會確保相同的輕鏈能在沒有另外的修飾的情況下用於其它計劃。例示性文庫選擇:依照下述規程在溶液中使用靶抗原x的單體和生物素化胞外域進行對所有親和力成熟文庫的選擇。1.在1ml的總體積中將每種文庫的1012個噬菌粒顆粒結合至100nm生物素化可溶性抗原達0.5小時。2.捕捉生物素化抗原,並通過添加約5x107個鏈黴親合素包被的磁珠達10分鐘來分離特異性結合的噬菌體顆粒。3.使用5-10x1mlpbs/tween20和5-10x1mlpbs清洗珠。4.通過添加1ml100mmtea(三乙胺)達10分鐘來進行噬菌體顆粒的洗脫,並通過添加500μl1mtris/hclph7.4來中和。5.再感染指數式生長中的大腸桿菌tg1細菌,用輔助噬菌體vcsm13感染,隨後peg/nacl沉澱噬菌粒顆粒,在後續輪選擇中應用。3-5輪使用恆定的或遞減的(自10-7m至2x10-9m)抗原濃度任一進行選擇。在第2輪中,使用中性親合素板代替鏈黴親合素珠來實施抗原/噬菌體複合物的捕捉。對所有結合反應補充100nm牛血清清蛋白或脫脂奶粉任一以競爭僅僅因抗體對塑料支持物的粘性結合而產生的不想要的克隆。3或4輪使用遞減的抗原濃度進行選擇,抗原始於100nm並在最後一輪選擇中降至5nm。特異性結合物定義為信號比背景高約5倍,而且通過elisa來鑑定。如下通過elisa鑑定特異性結合物:在中性親合素板上包被每孔100μl10nm生物素化抗原。添加含有fab的細菌上清液,並使用抗flag/hrp二抗經由它們的flag標籤檢測結合性fab。以96孔型式作為可溶性fab片段在細菌中表達elisa陽性克隆,並使用proteonxpr36(biorad)通過spr分析對上清液進行動力學篩選實驗。鑑定表達具有最高親和常數的fab的克隆,並對相應的噬菌粒測序。為了進一步表徵,經由pcr自噬菌粒擴增fab序列,並經由適宜的限制性位點克隆入人igg1表達載體,用於哺乳動物生成。使用人源化cd3ε特異性共同輕鏈的噬菌體展示抗體文庫的生成在此,我們描述用於在m13噬菌體上展示的抗體文庫的生成。本質上,我們設計了重鏈與一種恆定(或「共同」)輕鏈的一種多框架文庫。此文庫設計用於生成igg1p329glala或igg4splepg同種型的含有fc但fcgr結合無活性的t細胞雙特異性抗體,其中一個或兩個fab識別腫瘤細胞上表達的腫瘤表面抗原,而抗體的剩餘fab臂識別t細胞上的cd3e。文庫生成下面描述用於在m13噬菌體上展示的一種抗體文庫的生成。本質上,我們設計了重鏈與一種恆定(或「共同」)輕鏈的一種多框架文庫。這個文庫設計用於唯獨生成igg1p329glala或igg4splepg同種型的含有fc但fcgr結合無活性的t細胞雙特異性抗體。經由隨機化寡核苷酸僅僅在不同重鏈的cdr3中引入多樣性。用於生成抗體文庫的方法是本領域公知的,而且描述於hoogenboometal.,nucleicacidsres.1991,19,4133-413;或leeetal.,j.mol.biol.(2004)340,1073-1093。我們在文庫中使用這些重鏈:ighv1-46*01(x92343)(seqidno:104),ighv1-69*06(l22583)(seqidno:105),ighv3-15*01(x92216)(seqidno:106),ighv3-23*01(m99660)(seqidno:107),ighv4-59*01(ab019438)(seqidno:108),ighv5-51*01(m99686)(seqidno:109)。我們在文庫中使用自人源化人和食蟹猴cd3ε特異性抗體ch2527衍生的輕鏈:(vl7_46-13;seqidno:112)。這種輕鏈沒有隨機化,在沒有任何進一步修飾的情況下使用,以確保與不同雙特異性結合物的相容性。所有重鏈使用ighj2作為j元件,ighv1-69*06除外,它使用ighj6序列。隨機化的設計僅聚焦於cdr-h3,而且pcr寡核苷酸設計成容許介於v元件和j元件之間使用長度為4至9個胺基酸的隨機化插入物。實施例6自針對folr1的共同輕鏈文庫(包含具有cd3ε特異性的輕鏈)選擇抗體片段通過針對不同物種(人,食蟹猴和鼠)的folr1的噬菌體展示選擇獲得了抗體16a3,15a1,18d3,19e5,19a4,15h7,15b6,16d5,15e12,21d1,16f12,21a5,21g8,19h3,20g6,和20h7,它們包含具有cd3ε特異性的共同輕鏈vl7_46-13。克隆16a3,15a1,18d3,19e5,19a4,15h7,15b6,21d1,16f12,19h3,20g6,和20h7選自共同輕鏈與基於人種系vh1_46的重鏈全集配對的子文庫。在這個子文庫中,vh1_46的cdr已經基於6種不同cdr3長度而隨機化。克隆16d5,15e12,21a5,和21g8選自共同輕鏈與基於人種系vh3_15的重鏈全集配對的子文庫。在這個子文庫中,vh3_15的cdr3已經基於6種不同cdr3長度而隨機化。為了獲得物種交叉反應性(或鼠folr1反應性)抗體,在3輪生物淘選中以不同方式變更(或保持恆定)不同物種的folr1:16a3和15a1(人-食蟹猴-人folr1);18d3(食蟹猴-人-鼠folr1);19e5和19a4(3輪針對鼠folr1);15h7,15b6,16d5,15e12,21d1,16f12,21a5,21g8(人-食蟹猴-人folr1);19h3,20g6,和20h7(3輪針對鼠folr1)。作為n端單體fc融合物在hekebna細胞中瞬時表達作為抗原用於噬菌體展示選擇以及基於elisa和spr的篩選的人,鼠和食蟹猴folr1,並經由共表達bira生物素連接酶在位於攜帶受體鏈的fc部分(fc節鏈)c端的avi標籤識別序列處進行體內位點特異性生物素化。為了評估針對folr1的特異性,以相同方式生成了兩種相關受體,即人folr2和folr3。依照下述樣式在溶液中實施多輪選擇(生物淘選):1.在用10μg/ml無關人igg包被的maxisorp板上預清潔約1012個噬菌粒顆粒以消減文庫中識別抗原的fc部分的抗體。2.在1ml總體積中在100nm無關非生物素化fc節入穴構建體存在下將非fc結合性噬菌粒顆粒與100nm生物素化人,食蟹猴,或鼠folr1一起溫育0.5小時以進一步消減fc結合物。3.通過轉移至中性親合素預包被的微量滴定板的4個孔達10分鐘來捕捉生物素化folr1和附著的特異結合噬菌體(在第1和3輪中)。4.使用5xpbs/tween20和5xpbs清洗相應的孔。5.通過對每個孔添加250μl100mmtea(三乙胺)達10分鐘來洗脫噬菌體顆粒,並通過將500μl1mtris/hclph7.4添加至來自4個孔的合併洗出液來中和。6.通過在中性親合素預包被的微量滴定板上與100nm生物素捕捉的folr2或folr3一起溫育來後清潔經過中和的洗出液以最終去除fc結合物和非特異性結合物。7.用洗脫的噬菌體顆粒的上清液再感染對數期大腸桿菌tg1細胞,用輔助噬菌體vcsm13感染,在搖床上於30℃溫育過夜,隨後peg/nacl沉澱噬菌粒顆粒,要用於下一輪選擇。3輪使用恆定抗原濃度100nm進行選擇。在第2輪,為了避免富集針對中性親合素的結合物,通過添加5.4x107個鏈黴親合素包被的磁珠來實施抗原:噬菌體複合物的捕捉。如下通過elisa鑑定特異性結合物:分別在中性親合素板和maxisorp板上包被100μl25nm生物素化人,食蟹猴,或鼠folr1和10μg/ml人igg。添加含有fab的細菌上清液,並使用抗flag/hrp二抗經由它們的flag標籤檢查結合性fab。在人folr1上展現信號且在人igg上呈陰性的克隆通過初選用於進一步分析,並且還以相似方式針對其餘兩個物種的folr1進行測試。它們以0.5升培養體積在細菌中表達,親和純化,並使用biorad的proteonxpr36生物傳感器通過spr分析進一步表徵。於25℃使用proteonxpr36儀器(biorad)通過表面等離振子共振(spr)測量選定克隆的親和力(kd),通過中性親合素捕捉在nlc晶片上固定化的生物素化人,食蟹猴,和鼠folr1以及人folr2和folr3(陰性對照)。抗原(配體)的固定化:將重組抗原用pbst(10mm磷酸鹽,150mm氯化鈉ph7.4,0.005%tween20)稀釋至10μg/ml,然後以垂直取向以30μl/min注射。分析物的注射:對於『一擊動力學』測量,將注射方向變成水平取向,沿著分開的通道1-5同時注射經過純化的fab(不同濃度範圍)的兩倍稀釋系列,結合時間200秒,解離時間600秒。沿著第六通道注射緩衝液(pbst)以提供「在線」空白作為參照。使用proteonmanagerv3.1軟體中的簡單一對一langmuir結合模型通過同時擬合結合和解離傳感圖計算結合速率常數(kon)和解離速率常數(koff)。作為比koff/kon計算平衡解離常數(kd)。表4列出了對folr1特異性的選定克隆的平衡解離常數(kd)。表4:通過噬菌體展示自包含vl7_46-13(一種對cd3ε特異性的人源化輕鏈)的共同輕鏈子文庫選擇的抗folr1抗體(fab型式)的平衡解離常數(kd)。kd以nm計。實施例7自通用多框架文庫選擇針對folr1的抗體片段基於通用多框架子文庫通過針對不同物種(人,食蟹猴和鼠)的folr1的噬菌體展示選擇獲得了抗體11f8,36f2,9d11,5d9,6b6,和14e4。在這些多框架子文庫中,具有隨機化cdr3(3種不同長度)的不同vl域與具有隨機化cdr3(6種不同長度)的不同vh域配對。選定克隆是如下vl/vh配對:11f8(vk_1_5/vh_1_69),36f2(vk_3_20/vh_1_46),9d11(vk2d_28/vh1_46),5d9(vk3_20/vh1_46),6b6(vk3_20/vh1_46),和14e4(vk3_20/vh3_23)。為了獲得物種交叉反應性(或鼠folr1反應性)抗體,在3或4輪生物淘選中以不同方式變更(或保持恆定)不同物種的folr1:11f8(食蟹猴-鼠-人folr1);36f2(人-鼠-食蟹猴-鼠folr1);9d11(食蟹猴-人-食蟹猴folr1);5d9(人-食蟹猴-人folr1);6b6(人-食蟹猴-人folr1)和14e4(3輪針對鼠folr1)。作為n端單體fc融合物在hekebna細胞中瞬時表達作為抗原用於噬菌體展示選擇以及基於elisa和spr的篩選的人,鼠和食蟹猴folr1,並經由共表達bira生物素連接酶在位於攜帶受體鏈的fc部分(fc節鏈)c端的avi標籤識別序列處進行體內位點特異性生物素化。為了評估針對folr1的特異性,以相同方式生成了兩種相關受體,即人folr2和folr3。依照下述樣式在溶液中實施多輪選擇(生物淘選):1.在用10μg/ml無關人igg包被的maxisorp板上預清潔約1012個噬菌粒顆粒以消減文庫中識別抗原的fc部分的抗體。2.在1ml總體積中在100nm無關非生物素化fc節入穴構建體存在下將非fc結合性噬菌粒顆粒與100nm生物素化人,食蟹猴,或鼠folr1一起溫育0.5小時以進一步消減fc結合物。3.通過轉移至中性親合素預包被的微量滴定板的4個孔達10分鐘來捕捉生物素化folr1和附著的特異結合噬菌體(在第1和3輪中)。4.使用5xpbs/tween20和5xpbs清洗相應的孔。5.通過對每個孔添加250μl100mmtea(三乙胺)達10分鐘來洗脫噬菌體顆粒,並通過將500μl1mtris/hclph7.4添加至來自4個孔的合併洗出液來中和。6.通過在中性親合素預包被的微量滴定板上與100nm生物素捕捉的folr2或folr3一起溫育來後清潔經過中和的洗出液以最終去除fc結合物和非特異性結合物。7.用洗脫的噬菌體顆粒的上清液再感染對數期大腸桿菌tg1細胞,用輔助噬菌體vcsm13感染,在搖床上於30℃溫育過夜,隨後peg/nacl沉澱噬菌粒顆粒,要用於下一輪選擇。3輪使用恆定抗原濃度100nm進行選擇。在第2和4輪,為了避免富集針對中性親合素的結合物,通過添加5.4x107個鏈黴親合素包被的磁珠來實施抗原:噬菌體複合物的捕捉。如下通過elisa鑑定特異性結合物:分別在中性親合素板和maxisorp板上包被100μl25nm生物素化人,食蟹猴,或鼠folr1和10μg/ml人igg。添加含有fab的細菌上清液,並使用抗flag/hrp二抗經由它們的flag標籤檢查結合性fab。在人folr1上展現信號且在人igg上呈陰性的克隆通過初選用於進一步分析,並且還以相似方式針對其餘兩個物種的folr1進行測試。它們以0.5升培養體積在細菌中表達,親和純化,並使用biorad的proteonxpr36生物傳感器通過spr分析進一步表徵。於25℃使用proteonxpr36儀器(biorad)通過表面等離振子共振(spr)測量選定克隆的親和力(kd),通過中性親合素捕捉在nlc晶片上固定化的生物素化人,食蟹猴,和鼠folr1以及人folr2和folr3(陰性對照)。抗原(配體)的固定化:將重組抗原用pbst(10mm磷酸鹽,150mm氯化鈉ph7.4,0.005%tween20)稀釋至10μg/ml,然後以垂直取向以30μl/min注射。分析物的注射:對於『一擊動力學』測量,將注射方向變成水平取向,沿著分開的通道1-5同時注射經過純化的fab(不同濃度範圍)的兩倍稀釋系列,結合時間分別為150或200秒,解離時間分別為200或600秒。沿著第六通道注射緩衝液(pbst)以提供「在線」空白作為參照。使用proteonmanagerv3.1軟體中的簡單一對一langmuir結合模型通過同時擬合結合和解離傳感圖計算結合速率常數(kon)和解離速率常數(koff)。作為比koff/kon計算平衡解離常數(kd)。表5列出了對folr1特異性的選定克隆的平衡解離常數(kd)。表5:通過噬菌體展示自通用多框架子文庫選擇的抗folr1抗體(fab型式)的平衡解離常數(kd)。kd以nm計。實施例8igg和t細胞雙特異性型式的新穎folr1結合物的生成和純化為了鑑定能夠對選定靶細胞的誘導t細胞依賴性殺傷的folr1結合物,將自共同輕鏈文庫或fab文庫分離的抗體轉變成相應的人igg1型式。簡言之,使用fab克隆作為模板,通過標準pcr反應擴增來自噬菌體展示的獨特folr1結合物的可變重和可變輕鏈。純化pcr產物,並插入(或是通過基於限制性內切核酸酶和連接酶的克隆,或是通過使用來自invitrogen的infusion試劑盒進行的『重組工程』)合適的表達載體,其中它們融合至適宜的人恆定重或人恆定輕鏈。這些載體中的表達盒由嵌合mpsv啟動子和合成多腺苷酸化位點組成。另外,質粒含有來自eb病毒的orip區,用於在包含ebv核抗原(ebna)的hek293細胞中穩定維持質粒。在pei介導的轉染之後,抗體在hek293ebna細胞中瞬時生成,並如描述的那樣通過標準蛋白a親和層析,接著是大小排阻層析來純化:瞬時轉染和生成如下文所述對於所需載體使用pei介導的轉染規程在hek293ebna細胞中瞬時生成本文中使用的所有(雙特異性)抗體(如果不是自商業來源獲得的話)。在cdcho培養基中懸浮無血清培養hek293ebna細胞。對於500ml搖瓶中的生成,在轉染之前24小時接種400x106個hek293ebna細胞(對於備選規模,相應調節所有量)。為了轉染,將細胞以210xg離心5分鐘,用預溫熱的20mlcdcho培養基替換上清液。在20mlcdcho培養基中混合表達載體至最終量200μgdna。在添加540μlpei溶液之後,漩渦震蕩15秒,隨後於室溫溫育10分鐘。之後,將細胞與dna/pei溶液混合,轉移至500ml燒瓶,並在具有5%co2氣氛的溫箱中於37℃溫育3小時。在溫育時間之後,添加160mlf17培養基,並將細胞培養24小時。轉染後1天,添加1mm丙戊酸並添加7%補料1。7天後,收集培養上清液,用於通過以210xg離心15分鐘來純化,將溶液無菌過濾(0.22μm濾器),以終濃度0.01%w/v添加疊氮化鈉,並保存於4℃。在生成之後,收穫上清液,將含有抗體的上清液過濾通過0.22μm無菌濾器,並保存於4℃直至純化。抗體純化使用標準規程以兩個步驟純化所有分子,諸如蛋白a親和純化(explorer)和大小排阻層析。將自瞬時生成獲得的上清液調節至ph8.0(使用2mtrisph8.0),並應用於用8個柱體積(cv)的緩衝液a(20mm磷酸鈉,20mm檸檬酸鈉,ph7.5)平衡的hitrappaff(gehealthcare,柱體積(cv)=5ml)。在用10cv的緩衝液a清洗之後,使用12cv上變成緩衝液b(20mm檸檬酸鈉ph3,100mmnacl,100mm甘氨酸)的ph梯度洗脫蛋白質。合併含有感興趣蛋白質的級分,並溫和地將溶液的ph調節至ph6.0(使用0.5mna2hpo4ph8.0)。使用超濃縮器(vivaspin15r30.000mwcohy,sartorius)將樣品濃縮至2ml,隨後應用於用20mm組氨酸,ph6.0,140mmnacl,0.01%tween-20平衡的hiloadtm16/60superdextm200製備級(gehealthcare)。通過分析性大小排阻層析分析洗脫級分的聚集體含量。因此,於25℃將30μl每份級分應用於在25mmk2hpo4,125mmnacl,200mml-精氨酸單氫氯化物,0.02%(w/v)nan3,ph6.7運行緩衝液中平衡的tskgelg3000swxl分析性大小排阻柱(tosoh)。合併含有少於2%寡聚物的級分,並使用超濃縮器(vivaspin15r30.000mwcohy,sartorius)濃縮至1-1.5mg/ml的終濃度。通過測量280nm處的光密度(od),使用基於胺基酸序列計算的摩爾消光係數來測定蛋白質濃度。通過在還原劑存在和缺失下的sds毛細管電泳遵循製造商的說明書(instrumentcaliperlabchipgx,perkinelmer)分析構建體的純度和分子量。在液氮中冷凍經過純化的蛋白質,並保存於-80℃。基於體外表徵結果,將選定的結合物轉變成t細胞雙特異性型式。在這些分子中,以2:1次序排列folr1:cd3結合模塊,其中folr1fab位於n端。對於自標準fab文庫分離的克隆,作為crossfab生成cd3結合部分(ch1cκ交叉),而對於來自共同輕鏈文庫的克隆,交叉不是必需的。與igg類似地生成和純化這些雙特異性分子。表6:分別為igg和tcb型式的新穎folr1結合物的產量和單體含量。clc:共同輕鏈實施例92+1和1+1t細胞雙特異性型式對一種共同輕鏈結合物(16d5)製備了四種不同t細胞雙特異性型式並對一種來自fab文庫的結合物(9d11)生成了三種型式以比較它們的體外殺傷特性。標準型式為早已描述的2+1倒轉型式(以2:1次序排列folr1:cd3結合模塊,其中folr1fab位於n端)。在2+1經典型式中,以2:1次序排列folr1:cd3結合模塊,其中cd3fab位於n端。還製備了兩種單價型式。1+1頭至尾具有分子的同一臂上以1:1次序排列的folr1:cd3結合模塊,其中folr1fab位於n端。在1+1經典型式中,folr1:cd3結合模塊出現一次,每種在分子的一個臂上。對於自標準fab文庫分離的9d11克隆,作為crossfab(ch1cκ交叉)生成cd3結合部分,而對於來自共同輕鏈文庫的16d5,交叉不是必需的。與標準的倒轉的t細胞雙特異性型式類似地生成並純化這些雙特異性分子。表7:不同t細胞雙特異性型式的產量和最終單體含量的匯總。構建體單體[%](sec)產量16d5folr1tcb2+1(倒轉的)96%5.4mg/l16d5folr1tcb2+1(經典的)90%4.6mg/l16d5folr1tcb1+1(頭至尾)100%5.4mg/l16d5folr1tcb1+1(經典的)100%0.7mg/l9d11folr1tcb2+1(倒轉的)100%2.6mg/l9d11folr1tcb1+1(頭至尾)100%6.1mg/l9d11folr1tcb1+1(經典的)96%1.3mg/lmov19folr1tcb2+1(倒轉的)98%3mg/lmov19folr1tcb1+1(頭至尾)100%5.2mg/l實施例10通過表面等離振子共振對folr1結合物的生化表徵通過表面等離振子共振(spr)評估作為igg或t細胞雙特異性型式的folr1結合物對不同重組葉酸受體(人folr1,2和3,鼠folr1和食蟹猴folr1;均作為fc融合物)的結合。於25℃在biacoret200上實施所有spr實驗,以hbs-ep作為運行緩衝液(0.01mhepesph7.4,0.15mnacl,3mmedta,0.005%表面活性劑p20,biacore,freiburg/germany)。單次注射首先通過單次注射分析抗folr1igg(表1)以表徵它們的交叉反應性(對人,鼠和食蟹猴folr1)和特異性(對人folr1,人folr2,人folr3)。使用標準偶聯指令(biacore,freiburg/germany)直接在sa晶片上偶聯人,食蟹猴和鼠葉酸受體1(folr1-fc)或人葉酸受體2和3(folr2-fc,folr3-fc)的重組生物素化單體fc融合物。固定化水平為約300-400ru。以500nm的濃度注射igg達60秒。因缺乏特異性而排除結合hufolr2和hufolr3的igg。大多數結合物只在人和食蟹猴folr1之間是交叉反應性的,另外的對鼠folr1的交叉反應性大多數時間伴有特異性喪失。表8:25種新的葉酸受體1結合物(作為igg)以及兩種對照igg(mov19和farletuzumab)的交叉反應性和特異性。+表示結合,-表示無結合,+/-表示弱結合。對葉酸受體1的親合力如下文所述測定抗folr1igg或t細胞雙特異性和重組葉酸受體之間的相互作用的親合力(表9)。使用標準偶聯指令(biacore,gehealthcare)直接在sa晶片上偶聯人,食蟹猴和鼠葉酸受體1的重組生物素化單體fc融合物(folr1-fc)。固定化水平為約300-400ru。抗folr1igg或t細胞雙特異性以2.1至500nm的濃度範圍以30μl/min的流速通過流動室達180秒。監測解離達600秒。通過扣除在用重組生物素化il2受體fc融合物固定化的參照流動室上獲得的響應來校正批量折射率(bulkrefractiveindex)差異。為了分析19h3igg和鼠葉酸受體1的相互作用,在hbs-ep運行緩衝液中以2.3μm的濃度添加葉酸(sigmaf7876)。自igg或t細胞雙特異性的二價結合產生的結合曲線近似1:1langmuir結合,並用該模型擬合(這是不正確的,但是給出親合力的概念)。使用bia評估軟體(gehealthcare)自擬合的速率常數推導相互作用的表觀親合常數。表9:選定folr1結合物作為igg或作為t細胞雙特異性(tcb)對人和食蟹猴folr1的二價結合(親合力及表觀kd)。1.對葉酸受體1的親和力如下文所述測定抗folr1igg或t細胞雙特異性和重組葉酸受體之間的相互作用的親和力(表10)。為了親和力測量,使用標準胺偶聯試劑盒(gehealthcare)於ph5.0在cm5晶片上實施6000-7000個共振單位(ru)左右的抗人fab特異性抗體(fab捕捉試劑盒,gehealthcare)的直接偶聯。以20nm及流速10μl/min捕捉抗folr1igg或t細胞雙特異性達20或40秒,留下參照流動室沒有捕捉。使人或食蟹猴葉酸受體1fc融合物的稀釋系列(6.17至500nm或12.35至3000nm)以30μl/min通過所有流動室達120或240秒以記錄結合期。解離期監測240秒並通過自樣品溶液轉換至hbs-ep來觸發。在每一個循環之後使用兩次注射60秒10mm甘氨酸-hclph2.1或ph1.5來再生晶片表面。通過扣除在參照流動室1上獲得的響應來校正批量折射率(bulkrefractiveindex)差異。通過使用bia評估軟體(gehealthcare)擬合至1:1langmuir結合自速率常數推導相互作用的親和力常數。表10:選定folr1結合物作為igg或作為t細胞雙特異性(tcb)對人和食蟹猴folr1的單價結合(親和力)。2.對cd3的親和力如下文所述測定抗folr1t細胞雙特異性和重組人cd3εδ-fc之間的相互作用的親和力(表11)。為了親和力測量,使用標準胺偶聯試劑盒(gehealthcare)於ph5.0在cm5晶片上實施9000個共振單位(ru)左右的抗人fab特異性抗體(fab捕捉試劑盒,gehealthcare)的直接偶聯。以20nm及流速10μl/min捕捉抗folr1t細胞雙特異性達40秒,留下參照流動室沒有捕捉。使人cd3εδ-fc融合物的稀釋系列(6.17至500nm)以30μl/min通過所有流動室達240秒以記錄結合期。解離期監測240秒並通過自樣品溶液轉換至hbs-ep來觸發。在每一個循環之後使用兩次注射60秒10mm甘氨酸-hclph2.1來再生晶片表面。通過扣除在參照流動室1上獲得的響應來校正批量折射率(bulkrefractiveindex)差異。通過使用bia評估軟體(gehealthcare)擬合至1:1langmuir結合自速率常數推導相互作用的親和常數。表11:選定folr1t細胞雙特異性(tcb)對人cd3-fc的單價結合(親和力)。配體分析物ka(1/ms)kd(1/s)kd(m)16d5tcbhucd34.25e+043.46e-038.14e-0821a5tcbhucd33.72e+043.29e-038.8e-08cd3結合部分對於所有構建體是相同的,而且親和力對於所測量的t細胞雙特異性是相似的(kd範圍在60和90nm之間)。實施例11t細胞雙特異性對葉酸受體1和cd3的同時結合如下文所述測定抗folr1t細胞雙特異性對重組葉酸受體1和重組人cd3εδ-fc的同時結合。使用標準偶聯指令(biacore,freiburg/germany)直接在sa晶片上偶聯人,食蟹猴和鼠葉酸受體1的重組生物素化單體fc融合物(folr1-fc)。固定化水平為約300-400ru。穿過流動室以流速30μl/min注射500nm抗folr1t細胞雙特異性達60秒,接著注射500nmhucd3εδ-fc達60秒。通過扣除在用重組生物素化il2受體fc融合物固定化的參照流動室上獲得的響應來校正批量折射率(bulkrefractiveindex)差異。所測試的四種t細胞雙特異性(16d5tcb,21a5tcb,51c7tcb和45d2tcb)能夠同時結合葉酸受體1和人cd3,正如預期的。實施例12表位分倉(binning)為了表位分倉,使用標準胺偶聯試劑盒(gehealthcare)於ph5.0在cm5晶片上直接固定化抗folr1igg或t細胞雙特異性,最終響應為700ru左右。然後對500nmhufolr1-fc捕捉60秒,接著對500nm不同結合物捕捉30秒。用兩次注射10mm甘氨酸ph2各30秒來再生表面。評估不同結合物是否能結合固定化結合物上捕捉的hufolr1(表12)。表12:選定folr1結合物作為igg或作為t細胞雙特異性(tcb)在人folr1上的表位表徵。+表示結合,-表示無結合,+/-表示弱結合基於這些結果和另外的固定化hufolr1上同時結合的數據,將結合物分成三個組。不清楚9d11是否具有不同的表位,因為它置換所有其它結合物。16d5和21a5看來在同一組中,而mov19,farletuzumab(coneyetal.,cancerres.1991nov15;51(22):6125-32;kallietal.,curropininvestigdrugs.2007dec;8(12):1067-73)和36f2在另一組中(表13)。然而,36f2結合與mov19和farletuzumab不同的表位,因為它結合人,食蟹猴和鼠folr1。表13:選定folr1結合物作為igg或作為t細胞雙特異性(tcb)在人folr1上的表位分組實施例13結合物的選擇通過表面等離振子共振(spr)和通過在細胞上進行的體外測定法篩選igg型式的folr1結合物以選擇最佳候選者。通過spr分析抗folr1igg以表徵它們的交叉反應性(對人,鼠和食蟹猴folr1)和特異性(對人folr1,人folr2,人folr3)。對人folr2和3的非特異性結合視為排除因素。在細胞上確認對人folr1的結合和特異性。一些結合物沒有在表達folr1的細胞上結合,儘管它們在spr中識別重組人folr1。測定聚集溫度,但是不是排除因素,因為選定結合物都是穩定的。在一項多重反應性elisa中測試選定結合物以檢查非特異性結合,這導致排除四種結合物。這一過程導致最初選擇三種結合物:36f2(fab文庫),9d11(fab文庫)和16d5(共同輕鏈)。36f2自hufolr1迅速解離,因此最初不是偏愛的。實施例14新生成的folr1結合物對人folr1陽性腫瘤細胞的特異性結合使用fab文庫或共同輕鏈文庫(其使用cd3輕鏈)任一經由噬菌體展示生成了新的folr1結合物。將所鑑定的結合物轉變成人igg1型式,並分析對folr1高表達性hela細胞的結合。作為參照分子,包括人folr1結合物mov19。在這項測定法中測試的大多數結合物顯示中等至較好的對folr1的結合,其中一些克隆與mov19同等好地結合(見圖2)。排除克隆16a3,18d3,15h7,15b6,21d1,14e4和16f12,因為不能通過流式細胞術確認對細胞上的folr1的結合。在下一個步驟中,通過排除對密切相關人folr2的結合來對選定克隆測試對人folr1的特異性。用人folr1或人folr2任一瞬時轉染hek細胞以分析特異性。自fab文庫衍生的克隆36f2和9d11和自clc文庫衍生的克隆16d5和21a5特異性結合人folr1且不結合人folr2(見圖3a-b)。所有其它測試的克隆顯示至少一些對人folr2的結合(見圖3a-b)。因此,自進一步表徵排除這些克隆。平行地,通過實施用食蟹猴folr1瞬時轉染的hek細胞結合研究來分析folr1克隆對食蟹猴folr1的交叉反應性。所有測試的克隆均能夠結合食蟹猴folr1,而且四種選定人folr1特異性克隆36f2,9d11,16d5和21a5同等好地結合人和食蟹猴folr1(圖4)。隨後,將三種人folr1特異性食蟹猴交叉反應性結合物轉變成tcb型式並測試對t細胞殺傷和t細胞活化的誘導。這些克隆是來自fab文庫的9d11和來自clc文庫的16d5和21a5。作為參照分子,在所有研究中包括mov19folr1tcb。然後使用這些folr1tcb來比較結合hela細胞上的folr1後對內在化的誘導。所有三種測試的克隆均在結合folr1後內在化,與mov19folr1tcb在結合後的內在化相當(圖5)。21a5folr1tcb因多重反應性的跡象而中止。實施例15由folr1tcb抗體誘導的對folr1表達性腫瘤靶細胞的t細胞介導的殺傷使用folr1tcb來測定t細胞介導的對表達folr1的腫瘤細胞的殺傷。通過qifikit分析使用一組潛在靶細胞系來測定folr1結合位點。所使用的該組腫瘤細胞含有folr1高,中等和低表達性腫瘤細胞和一組folr1陰性細胞系。表14:腫瘤細胞上的folr1結合位點細胞系起源folr1結合位點hela宮頸腺癌2』240』716skov3卵巢腺癌91』510ovcar5卵巢腺癌22』077ht29結直腸腺癌10』135mkn45胃腺癌54測定了三種不同folr1tcb(含有9d11,16d5和mov19結合物)對這組腫瘤細胞系的結合,顯示folr1tcb特異性結合folr1表達性腫瘤細胞且不結合folr1陰性腫瘤細胞系。結合的構建體的量與folr1表達水平成比例,而且構建體對可檢測的folr1低細胞系ht-29仍然有較好的結合。另外,陰性對照dp47tcb對任何使用的細胞系沒有結合(圖6a-e)。dp47tcb是非靶向性tcb且如wo2014/131712中所述製備。進一步使用中等表達細胞系skov3和低表達細胞系ht-29來測試t細胞介導的殺傷和t細胞活化,其中使用16d5tcb和9d11tcb;包括dp47tcb作為陰性對照。兩種細胞系均在早就很低水平的16d5tcb和9d11tcb存在下被殺死,而且兩種tcb之間活性沒有差異,儘管9d11tcb比16d5tcb更強地結合folr1。skov3細胞的總體殺傷與ht-29相比要高,ht-29反映比skov3細胞上更高表達水平的folr1(圖7a-d)。與此一致,檢測到cd4+t細胞和cd8+t細胞上活化標誌物cd25和cd69的強上調。t細胞的活化在skov3細胞和ht-29細胞存在下非常相似。陰性對照dp47tcb在所使用濃度沒有誘導任何殺傷,而且t細胞上的cd25和cd69沒有顯著上調。表15:skov3細胞的腫瘤細胞殺傷和t細胞活化的ec50值表16:ht-29細胞的腫瘤細胞殺傷和t細胞活化的ec50值實施例16全血中folr1tcb抗體對紅細胞的結合和t細胞活化為了證明在folr1表達性腫瘤細胞缺失下沒有自發活化,我們測試了是否有folr1克隆對可能潛在表達folr1的紅細胞的結合。我們未能觀察到9d11igg,16d5igg和mov19igg對紅細胞的任何特異性結合,正如包括在內的陰性對照dp47igg(圖8)。為了排除任何別的folr1tcb對血細胞的非特異性結合或經由folr1tcb的非特異性活化,將9d11tcb,16d5tcb和mov19tcb添加入全血,並通過流式細胞術分析cd4+t細胞和cd8+t細胞上cd25和cd69的上調。包括dp47tcb作為陰性對照。通過分析cd4+t細胞和cd8+t細胞上cd25和cd69的上調未能對任何測試的構建體觀察到t細胞的活化(圖9)。實施例17由不同單價和二價t細胞雙特異性型式的36f2tcb和16d5tcb誘導的t細胞殺傷評估由36f2tcb,16d5tcb,16d5tcb經典的,16d5tcb1+1和16d5tcbht抗體介導的對hela,skov-3(中等folr1,約70000-90000個拷貝)和ht-29(低folr1,約10000個)人腫瘤細胞的t細胞殺傷。包括dp47tcb抗體作為陰性對照。使用人pbmc作為效應器,並在與雙特異性抗體一起溫育24小時時檢測殺傷。簡言之,用胰蛋白酶/edta收穫靶細胞,清洗,並以25000個細胞/孔的密度鋪於平底96孔板中。讓細胞貼壁過夜。通過將自健康人供體獲得的富集淋巴細胞製備物(血沉棕黃層)進行histopaque密度離心來製備外周血單個核細胞(pbmc)。用無菌pbs稀釋新鮮血液並在histopaque梯度(sigma,#h8889)上鋪層。離心(450xg,30分鐘,室溫)後,丟棄含pbmc的界面上方的血漿並將pbmc轉移至新的falcon管,隨後裝滿50mlpbs。將混合物離心(400xg,10分鐘,室溫),丟棄上清液,用無菌pbs清洗pbmc團粒兩次(離心步驟350xg,10分鐘)。對所得pbmc群進行自動計數(vicell)並在含10%fcs和1%l-丙氨醯-l-穀氨醯胺(biochrom,k0302)的rpmi1640培養基中在細胞溫箱(37℃,5%co2)中保存直至進一步使用(不超過24小時)。對於殺傷測定法,以標示濃度添加抗體(範圍0.01pm-100nm,一式三份)。以最終e:t比率10:1將pbmc添加至靶細胞。於37℃,5%co2溫育24小時後通過對由凋亡/壞死細胞釋放入細胞上清液中的ldh進行定量(ldh檢測試劑盒,rocheappliedscience,#11644793001)來評估靶細胞殺傷。對靶細胞的最大裂解(=100%)通過將靶細胞與1%tritonx-100一起溫育來實現。最小裂解(=0%)指在沒有雙特異性構建體的情況下與效應細胞一起共溫育的靶細胞。結果顯示由36f2tcb和16d5tcb誘導的對所有三種folr1+靶細胞系的靶物特異性殺傷(圖10)。實施例18:抗tim3抗體的生成小鼠的免疫接種對nmri小鼠進行遺傳免疫接種,其使用編碼全長人tim-3的質粒表達載體通過皮內應用100ug載體dna(質粒15304_htim3-fl),接著電穿孔(2個1000v/cm矩形脈衝,持續0.1ms,間隔0.125s;接著4個287.5v/cm矩形脈衝,持續10ms,間隔0.125s)進行。小鼠在第0,14,28,42,56,70,和84天連續接受6次免疫接種。在第36,78和92天採集血液並製備血清,用於通過elisa進行的滴度測定(見下文)。選擇具有最高滴度的動物在第96天通過靜脈內注射50ug重組人tim-3人fc嵌合物進行強化,並通過在強化後3天融合脾細胞與骨髓瘤細胞系通過雜交瘤技術分離單克隆抗體。血清滴度的測定(elisa)在pbs中以0.3ug/ml,100ul/孔在96孔nuncmaxisorp板上固定化人重組tim-3人fc嵌合物,接著是:用含2%croteinc的pbs,200ul/孔封閉板;應用抗血清的連續稀釋液,一式兩份,在含0.5%croteinc的pbs中,100ul/孔;用hrp綴合的山羊抗小鼠抗體(jacksonimmunoresearch/dianova115-036-071;1/16000)檢測。對於所有步驟,將板於37℃溫育1小時。在所有步驟之間,將板用含0.05%tween20的pbs清洗3次。通過添加bmbluepod底物溶液(roche),100ul/孔來發生信號;並通過添加1mhcl,100ul/孔來終止。於450nm讀取吸光度,針對690nm作為參照。滴度定義為產生半最大信號的抗血清的稀釋度。實施例19:抗tim3抗體的表徵針對tim3的elisa將nunc-maxisorp鏈黴親合素板(microcoat#11974998/mc1099)用25μl/孔tim3-ecd-his-生物素(用bira連接酶生物素化)包被,並在400rpm旋轉的搖動下於室溫溫育1小時。清洗(3x90μl/孔pbst緩衝液)後,添加25μlatim3樣品或經過稀釋的(1:2步幅)參照抗體atim3f38-2e2(biolegend)並於室溫溫育1小時。清洗(3x90μl/孔pbst緩衝液)後,以1:9000稀釋度添加25μl/孔綿羊抗小鼠-pod(gena9310v)並在400rpm旋轉的搖動下於室溫溫育1小時。清洗(4x90μl/孔pbst緩衝液)後,添加25μl/孔tmb底物(calbiochem,#cl07)並溫育直至od1.5–2.5。然後通過添加25μl/孔1nhcl溶液來停止反應。於370/492nm進行測量。在下文匯總表17中作為ec50值[ng/ml]列出elisa結果。針對tim3的細胞elisa以1.2x10e6細胞/ml的濃度將用編碼全長人tim3的質粒15312_htim3-fl_puc_neo穩定轉染並用g418(質粒上的新黴素抗性標誌物)選擇的貼壁cho-k1細胞系接種入384孔平底板並生長過夜。在次日,添加25μl/孔tim3樣品或atim3參照抗體f38-2e2(無疊氮化物)(biolegend,354004)並於4℃溫育2小時(以避免內在化)。清洗(3x90μl/孔pbst,biotek清洗儀:程序29,1x90)後,通過彈掉殘留緩衝液並添加50μl/孔0.05%戊二醛(25%戊二醛(sigma目錄號:g5882)在1xpbs緩衝液中1:500稀釋)並於室溫溫育1小時來固定細胞。清洗(3x90μl/孔pbst,biotek清洗儀:程序21,3x90greinlysin)後,添加25μl/孔二抗進行檢測(綿羊抗小鼠-pod;辣根pod連接的f(ab′)2片段;gena9310),接著在400rpm搖動下於室溫溫育2小時。清洗(3x90μl/孔pbst,biotek清洗儀:程序21,3x90greinlysin)後,添加25μl/孔tmb底物溶液(roche11835033001)並溫育直至od1.5–2.5。然後通過添加25μl/孔1nhcl溶液來停止反應。於370/492nm進行測量。下文匯總表17中作為「ec50cho-tim3」值[ng/ml]列出細胞elisa結果。表17:例示性抗體的結合親和力(elisa和biacore)tim3抗體的biacore表徵已經使用基於表面等離振子共振(spr)的測定法來測定數種鼠tim3結合物以及商業性人tim3結合參照之間的結合的動力學參數。因此,通過胺偶聯將抗小鼠igg固定化至(biacore)cm5傳感器晶片的表面。然後捕捉樣品並使人/食蟹猴tim3-ecd結合至它們。在每個分析循環後再生傳感器晶片表面。最終通過將數據擬合至1:1langmuir相互作用模型來得到平衡常數kd。通過使用胺偶聯試劑盒(gehealthcare)於ph5.0將約12000個響應單位(ru)的30μg/ml抗小鼠igg(gehealthcare#br-1008-38)偶聯到biacoreb4000中的cm5傳感器晶片的流動室1-4的點1,2,4和5上(點1,5是活動的而點2,4是參照點)。樣品和運行緩衝液是hbs-ep+(0.01mhepes,0.15mnacl,3mmedta,0.05%v/v表面活性劑p20,ph7.4)。流動室溫度設定為25℃,而樣品隔室溫度設定為12℃。用運行緩衝液使系統準備好。樣品以200μg/ml的濃度注射30秒,並結合至每個流動室的點1和5,容許平行測量八份樣品。然後在每份樣品上注射一整套不同(單體食蟹猴,單體人和hufc融合的二聚體人tim3-ecd)濃度(見表x)240秒,接著是解離時間30/1800秒(見表1)。每個分析循環(樣品捕捉,點1和5–tim3ecd注射)之後用30秒長時間注射甘氨酸-hclph1.7來再生。對於整個運行,流速設定為30μl/min。最終,用biacoreb4000評估軟體將雙重參照數據擬合至1:1langmuir相互作用模型。所得kd值顯示於表17和18。表18:通過biacore測定的結合親和力-通過動力學spr測量得到的kd值-n.f.表示沒有可能的擬合,最有可能是由於結合無或弱。實施例20:抗tim3抗體衍生物的生成嵌合抗體衍生物產生嵌合tim3抗體,其通過經由pcr自抗tim3小鼠抗體tim3-0016,tim3-0016變體(0018),tim3-0021,tim3-0022,tim3-0026,tim3-0028,tim3-0030,和tim3-0033,tim3-0038擴增可變重和輕鏈區並將它們作為與人igg1主鏈/人ch1-鉸鏈-ch2-ch3(具有消除效應器功能的lala和pg突變)(亮氨酸234變成丙氨酸,亮氨酸235變成丙氨酸,脯氨酸329變成甘氨酸)的融合蛋白克隆入重鍊表達載體,作為與人c-κ的融合蛋白克隆入輕鍊表達載體。然後將lc和hc質粒共轉染入hek293並在7天後通過抗體純化的標準方法自上清液純化。去除糖基化位點nyt:通過將n用q或s替代來修飾tim3-0016,tim3_0016變體(命名為0018或tim3_0018)中的1個hvr-l1位置使用agilent「quickchangelightning定點誘變試劑盒」依照製造商的說明書通過體外誘變生成tim3_0016和tim3_0016變體(0018)的可變輕鏈區內的突變。通過這種方法,將輕鏈hvr-l1(seqidno:4)中的糖基化位點基序nyt的天冬醯胺(n)用穀氨醯胺(q)替換(產生seqidno:11=tim3_0016_hvr-l1變體1_nq),或者,將天冬醯胺(n)用絲氨酸(s)替換(產生seqidno:12=tim3_0016_hvr-l1變體2_ns)。在這兩個糖基化位點中成功修飾了基序nyt。然後將編碼變體的lc和hc質粒共轉染入hek293並在7天後通過抗體純化的標準方法自上清液純化。通過人tim3上的elisa,食蟹猴tim3上的elisa和表達全長人tim3的貼壁cho-k1細胞上的細胞elisa測試所生成的突變體。發現所生成的所有突變體均顯示甚至分別比親本抗體tim3_0016或tim3_0016抗體變體tim3_0018更加功能性的對人tim3(人),食蟹猴tim3(食蟹猴)或cho細胞上的人timr的結合。表19:實施例21:螢光標記經過純化的單克隆抗體使用alexafluor488單克隆抗體標記試劑盒(由invitrogen製造)依照製造商的說明書進行雜交瘤衍生的單克隆抗體的螢光標記。標記後,通過tim-3表達性rpmi-8226和pfeiffer細胞的facscalibur(由bdbiosciences製造)分析確認每種抗體是用alexafluor488(此後稱作「alexa-488」)陽性標記的。實施例22:使用基於facs的競爭測定法對結合表位組分類通過基於facs的結合競爭測定法分析所生成的抗tim3抗體和六種抗tim3參照抗體之間表位的關係。tim3參照抗體如下:us2012/189617中記載的抗體4177和8213;wo2013/06490中記載的抗體1.7e10和27.12e12;抗體344823(克隆344823,由r&dsystems製造)和抗體f38-2e2(克隆f38-2e2,由biolegend和r&dsystems製造)。簡言之,容許測試抗體與tim-3表達性rpmi-8226細胞(ccl-155tm)相互作用及結合,然後通過流式細胞術方法評估另一種抗tim-3抗體是否也能結合tim-3表達性細胞。簡言之,將人tim3表達性rpmi-8226細胞與bd人fc封閉液一起於室溫溫育10分鐘,並在兩種不同實驗設置中染色以排除所測試的抗體的親和力的差異對結合的影響:1)憑藉已公開的經過純化的抗tim3(10μg/ml,在bd染色緩衝液中於4℃0.5小時),依照製造商的說明書(molecularprobesa-20181)綴合有alexa*488,平均每個抗體有2.7個螢光團。然後添加a)未標記的(1-4)參照重組抗tim3抗體或同種型對照(10μg/ml),在bdsb中於4℃0.5小時,並在用bdsb清洗後用pe標記的抗hufcγ抗體染色(jir,109-116-098,1:200,在bd染色緩衝液中於4℃0.5小時)。或者,添加b)pe標記的(5-6)可得參照抗tim3抗體或適宜的同種型對照(10μg/ml),在bd染色緩衝液中於4℃0.5小時。在清洗和離心後,通過bdbiosciencesfacscanto流式細胞儀分析染色的rpmi-8226細胞的mfi信號。表20:表位表徵的匯總來自基於facs的表位組定位的結果顯示,tim3_0016和tim3_0016變體tim3_0018顯示與任何所測試的抗tim-3參照抗體沒有結合競爭,而且提示這些抗體識別與所有先前記載的tim3參照抗體識別的表位不同的新表位,而tim3_0022,tim3_0026,tim3_0028和tim3_0038與多種競爭者不同程度地競爭對jrpmi-8226細胞上表面表達的tim3的結合。實施例23:在混合淋巴細胞反應(mlr)中人抗tim-3抗體對細胞因子生成的影響使用混合淋巴細胞反應來展現阻斷tim-3途徑對淋巴細胞效應細胞的影響。在抗tim-3單抗存在或缺失下在該測定法中對t細胞測試活化和它們的ifn-γ分泌。使用leukosep(greinerbioone,227288)通過密度梯度離心自健康供體的外周血分離人淋巴細胞。簡言之,用三倍體積的pbs稀釋肝素化血液,並在50mlleukosep管中將稀釋血液的25ml小樣分層。於室溫以800xg離心15分鐘(無中斷)後,收穫含有淋巴細胞的級分,在pbs中清洗,並在功能測定法中直接使用,或者在冷凍介質(10%dmso,90%fcs)中以1.0e+07個細胞/ml重懸浮並在液氮中保存。在mlr測定法中使用1:1靶/響應細胞比(即每份mlr培養物在總體積200μl中含有來自每位供體的-2.0e+05個pbmc。以不同抗體濃度將抗tim3單克隆抗體tim3_0016,tim3_0016變體(tim3_0018),tim3_0021,tim3_0022,tim3_0026,tim3_0028,tim3_0030,tim3_0033,tim3_0038和f38-2e2(biolegend)添加至每份培養物。或是不添加抗體或是添加同種型對照抗體作為陰性對照,並添加重組人il-2(20eu/ml)作為陽性對照。將細胞於37℃培養6天。在第6天後,自每份培養物取出100μl培養基用於細胞因子測量。使用opteiaelisa試劑盒(bdbiosciences)測量ifn-γ的水平。結果顯示於表21(ifn-g分泌/釋放)。抗tim-3單克隆抗體以濃度依賴性方式促進t細胞活化和ifn-γ分泌。抗tim3抗體tim3_0021,tim3_0022,tim3_0028,和tim3_0038比f38-2e2抗體更多地降低炎性細胞因子ifn-γ)的釋放。tim3_0016,tim3_0016變體(tim3_0018),tim3_0033和tim3_0038顯示與f38-2e2抗體相比相似的釋放。與之對比,含有同種型對照抗體的培養物沒有顯示ifn-γ分泌升高。表21:與作為陽性對照的重組人il-2(20eu/ml)(=100%)和作為陰性對照的無抗體相比抗tim3抗體誘導的ifnγ釋放的百分比(供體實施例24:抗tim-3抗體進入tim-3表達性細胞的內在化本文中描述的tim-3特異性抗體能內在化入tim-3表達性細胞,包括tim-3表達性淋巴瘤,多發性骨髓瘤和aml細胞。例如,已公開的tim-3特異性抗體及其片段顯示出內在化入穩定表達人tim-3的重組tim3cho細胞,如通過基於細胞的elisa,流式細胞術(facs)和共焦顯微術評估的。使用新鮮培養基將穩定的tim3轉染cho-k1細胞(克隆8)(4x104個細胞/孔/100μl)接種入98孔mtp。在細胞貼壁過夜後,去除細胞培養基,將測試抗體添加至細胞(10μg/ml,在細胞培養基中),並於4℃溫育0.5小時。作為參照,使用商業性小鼠抗人抗體(tim3mab11e365,usbiological,t5469-92p)。清洗(2次,用細胞培養基)和離心後,將細胞在200μl細胞培養基中於a)4℃或b)37℃溫育3小時。典型地,內在化發生於37℃,但是不發生於4℃,這為反應提供另一項對照。然後,將細胞用100μl/孔1xpbs中的0.05%戊二醛(sigma目錄號:g5882)於室溫(rt)固定10分鐘。這之後是三個200μlpbs-t清洗步驟,並添加二抗綿羊抗小鼠-pod(辣根pod連接的f(ab′)2片段;gena9310)),於室溫1小時。最終的清洗步驟(3xpbs-t)後,添加tmb底物(roche定購號11835033001)達15分鐘,並使用1nhcl停止顯色。通過elisa讀數儀中的450/620nm處的測量來測定最終的od。將這種細胞elisa規程用於自雜交瘤上清液純化的測試抗體的內在化能力的中等通量評估。如下計算內在化的百分比:內在化[%]=(1-od樣品_37℃/od樣品_4℃)*100結果顯示於圖29a和b(內在化)。幾乎所有測試的抗tim-3單克隆抗體於37℃溫育3小時後相似好地內在化入穩定的tim3轉染cho-k1細胞(未顯示所有數據)。通過facs對選定的候選物評估ec50內在化值(時間依賴性)的測定以及依賴於單價性對二價性的內在化的動力學的比較。簡言之,使用新鮮培養基將人tim3穩定表達性cho-k1細胞接種(4x105個細胞/孔/50μl)入98孔v底mtp,並與nf液一起於室溫溫育10分鐘以封閉非特異性結合。然後添加50μl/孔選定的經過純化的抗tim3(10μg/ml,在細胞培養基中),並於4℃溫育1小時。清洗(用細胞培養基)和離心後,將細胞在200μl細胞培養基中於a)4℃或b)37℃溫育0.25,0.5,1,2,3,4,6和24小時。然後用pbs/1%bsa清洗細胞,並添加二抗alexafluor488山羊抗小鼠igg,f(ab)2,於4℃1小時。清洗和離心後,添加125μl細胞固定液(bdbioscience,1:1000),並通過bdbiosciencesfacscanto流式細胞儀分析染色的細胞的mfi信號。如下計算內在化的百分比:內在化[%]=(1-mfi樣品_37℃/mfi樣品_4℃)*100在rpmi-8226細胞(ccl-155tm)上評估抗tim3抗體tim3_0016,tim3_0016變體(tim3_0018),tim3_0021,tim3_0028,tim3_0030,tim3_0033,tim3_0038的時間依賴性內在化的實施例:當前公開的抗tim3抗體以高水平快速內在化入tim3表達性rpmi-8226細胞(ccl-155tm)。如上文所述用tim3表達性rpmi-8226細胞(ccl-155tm)代替表達hutim-3的重組chok1細胞進行實驗。結果顯示於表22。使用下述抗體作為tim3參照抗體:us2012/189617中記載的抗體8213,wo2013/06490中記載的抗體27.12e12。以人igg1嵌合型式使用tim3_0016,tim3_0016變體(tim3_0018),tim3_0038。表22:指示時間點時的百分比內在化(0分鐘設定為0百分比)結果顯示,與參照抗體相比,測試抗體在rpmi-8226細胞(ccl-155tm)上以高百分比快速內在化。實施例25:抗tim-3抗體對分離的表達tim-3的人單核細胞的結合使用ficoll-paque(gehealthcare)(見用戶手冊中的通用方案或拜訪www.miltenyibiotec.com/protocols)通過密度梯度離心自健康供體的抗凝外周血分離cd14+單核細胞,隨後經由cd14微珠進行正選擇。首先用cd14微珠磁標記cd14+細胞。然後將細胞懸浮液加載到放置在macs分離儀的磁場中的柱上。磁標記的cd14+細胞保留在柱中。未標記的細胞運行穿過,此細胞級分消減了cd14+細胞。自磁場取出柱後,可以作為正選擇的細胞級分洗脫磁保留的cd14+細胞。於室溫以200xg離心10分鐘後,收穫單核細胞,並在結合測定法中直接使用,或者以1.0e+07個細胞/ml在冷凍培養基(10%dmso,90%fcs)中重懸浮並在液氮中保存。如文獻中顯示的,單核細胞在它們的表面上組成性表達tim3。在新鮮培養基中將1x105個cd14+分離的人單核細胞(50μl/孔)放入98孔v底mtp,並與nf液一起於室溫溫育15分鐘以封閉非特異性結合。然後添加50μl/孔公開的抗tim3單抗或參照抗tim-3單抗344823(r&d)和f38-2e2(biolegend)(10μg/ml,在細胞培養基中),並於4℃溫育1小時。然後用pbs/1%bsa清洗細胞,並添加二抗pe標記的山羊抗小鼠f(ab′)2(jacksonlab115-006-072),於4℃1小時。清洗和離心後,通過bdbiosciencesfacscanto流式細胞儀分析染色的細胞的mfi信號。如下計算特異性結合:特異性結合[mfi]=幾何均值mfi樣品-幾何均值mfi同種型對照結果顯示於表8:(對人單核細胞的結合)。tim3克隆tim3_0016,tim3_0018,tim3_0020,tim3_0028和tim3_0038結合不同供體的人單核細胞,甚至好於參照抗tim-3抗體。表23:對人單核細胞的結合實施例26:抗tim-3抗體對分離的表達tim-3的食蟹猴單核細胞的結合使用ficoll-paque(gehealthcare)(見用戶手冊中的通用方案或拜訪www.miltenyibiotec.com/protocols)通過密度梯度離心自食蟹猴抗凝外周血(covance)分離cd14+單核細胞,隨後經由nhpcd14微珠進行正選擇。首先用cd14微珠磁標記cd14+細胞。然後將細胞懸浮液加載到放置在macs分離儀的磁場中的柱上。磁標記的cd14+細胞保留在柱中。未標記的細胞運行穿過,此細胞級分消減了cd14+細胞。自磁場取出柱後,可以作為正選擇的細胞級分洗脫磁保留的cd14+細胞。於室溫以200xg離心10分鐘後,收穫單核細胞,並在結合測定法中直接使用,或者以1.0e+07個細胞/ml在冷凍培養基(10%dmso,90%fcs)中重懸浮並在液氮中保存。如文獻中顯示的,單核細胞在它們的表面上組成性表達tim3。在新鮮培養基中將1x105個cd14+分離的食蟹猴單核細胞(50μl/孔)放入98孔v底mtp,並與nf液一起於室溫溫育15分鐘以封閉非特異性結合。然後添加50μl/孔alexa488標記的抗tim3(10μg/ml,在細胞培養基中),並於4℃溫育1小時。清洗和離心後,通過bdbiosciencesfacscanto流式細胞儀分析染色的細胞的mfi信號。如下計算特異性結合:特異性結合[mfi]=幾何均值mfi樣品-幾何均值mfi同種型對照結果顯示於表9(對食蟹猴單核細胞的結合)。tim3克隆tim3_0016,tim3_0018,tim3_0026,tim3_0028,和tim3_0030結合不同食蟹猴供體的食蟹猴單核細胞。表24:對食蟹猴單核細胞的結合實施例27:抗tim-3抗體對表達tim-3的nhl和mm細胞系的結合通過facs分析公開的抗tim3抗體和兩種抗tim3參照抗體克隆(1)4177和(2)8213(kyowa)的結合能力。簡言之,將人tim3表達性b細胞淋巴瘤細胞(以pfeiffer細胞例示)和多發性骨髓瘤細胞(以rpmi-8226細胞例示)與bd人fc封閉液一起於室溫溫育10分鐘以封閉非特異性結合。然後將2x105個細胞(50μl/孔)放置入98孔v底mtp,添加50μl/孔alexa488標記的抗tim3(10μg/ml,在bd染色緩衝液中),並於4℃溫育1小時。清洗和離心後,通過bdbiosciencesfacscanto流式細胞儀分析染色的細胞的mfi信號。如下計算特異性結合:特異性結合[mfi]=幾何均值mfi樣品-幾何均值mfi同種型對照結果顯示於圖2a和2b(對rpmi-8226和pfeiffer細胞的結合)。實施例10:抗tim-3抗體對tim-3表達性nhl和mm細胞的細胞毒性活性綴合有假單胞菌外毒素(pe24)的tim3特異性抗體有效殺傷tim3表達性細胞。用promegacelltiter-glo發光細胞存活力測定法分析公開的抗tim3抗體和一種可商購抗tim3參照抗體克隆11e365(可得自usbiological)的細胞毒性活性。簡言之,對5x103個(50μl/孔,在98孔mtp中,一式三份)穩定表達人tim-3的重組chok1或2x104個細胞(50μl/孔,在98孔mtp中,一式三份)人tim3表達性b細胞淋巴瘤細胞(以pfeiffer細胞例示)或多發性骨髓瘤細胞(以rpmi-8226細胞例示)添加25μl/孔公開的抗tim-3抗體的1:5連續稀釋液,最高濃度10μg/ml,或者將適宜培養基添加至未處理細胞或將同種型對照添加至非靶向處理細胞。處理的範圍為10μg/ml至1ng/ml,一式三份。以全長小鼠fcγ型式使用所有抗體。為了綴合假單胞菌外毒素,添加10μg/ml綴合有pe24的小鼠fcγ片段特異性fab,並於37℃溫育3天。作為真核細胞中的一種已知的蛋白質合成抑制劑,使用環己醯亞胺作為陽性對照。用promegacelltiter-glo發光細胞存活力測定法測量經過處理的細胞的存活力。如下計算細胞毒性活性:相對抑制[%]=(1-(e樣品-e陰性對照)/(e陽性對照-e陰性對照))*100結果顯示於表25(抗tim3單抗對tim-3表達性重組nhl和mm細胞系的細胞毒性活性,三明治格式)。表25:所有測試的tim3克隆對穩定表達人tim-3的重組chok1和表達高和中等水平tim-3的pfeiffer細胞高度有力(ic50範圍0.01-0.2nm),而且在它們的細胞毒性活性方面甚至比強內在化參照抗tim-3抗體克隆11e365,usbiological更加有力。tim3克隆0016,0018,0021,0022,0033和0038對rpmi-8226細胞(表達與重組chotim-3細胞相比低5倍的tim-3水平)也是有力的。實施例28:公開的抗tim3抗體與兩種抗tim3參照抗體1.7.e10和27-12e12(如wo2013/06490中記載的)的細胞毒性活性的比較。如上文所述用promegacelltiter-glo發光細胞存活力測定法分析公開的抗tim3抗體和兩種抗tim3參照抗體(wo2013/06490中記載的tim3參照抗體1.7e10和27.12e12)的細胞毒性活性。以包括人fcγ部分的全長人igg1格式使用所有抗體。在這項實驗中,假單胞菌外毒素的綴合經由綴合有pe24的人fcγ片段特異性fab(10μg/ml)來實現,添加並於37℃溫育5天。結果顯示於表26。表26:抗tim3單抗對tim-3表達性nhl和mm細胞系的細胞毒性活性的比較所有公開的tim3克隆對表達tim-3的pfeiffer和rpmi-8226細胞是高度有活性的(ic50範圍0,02-0,08nm),而且在它們的細胞毒性活性方面甚至比強內在化參照抗tim-3抗體克隆27-12e12更加有力。在相同條件下使用相同假單胞菌外毒素作為假單胞菌外毒素(pe24)綴合物比較所有抗體。實施例28:公開的抗tim3抗體的fab-pe24構建物對mm,nhl和aml細胞系(表達tim3,但不表達psma)的細胞毒性活性。如上文所述用promegacelltiter-glo發光細胞存活力測定法分析細胞毒性活性。將直接綴合至pe24的公開的抗tim3抗體的fab片段的1:5連續稀釋液(最高濃度50μg/ml)或適宜培養基(對未處理細胞)或非結合性抗psmafab-pe24對照(對非靶向處理細胞)與7.5x103個pfeiffer細胞或2x103個rpmi-8226細胞(50μl/孔,在98孔mtp中)一起於37℃溫育4天。處理的範圍為50μg/ml至8ng/ml,一式三份。使用環己醯亞胺作為陽性對照。結果顯示於表27。表27:公開的抗tim3抗體的fab-pe24構建物對mm,nhl和aml細胞系的細胞毒性活性所有測試的公開的抗tim3抗體的fab-pe24構建物對表達中等水平tim-3的mm(rpmi-8226)和nhl(karpas-299)細胞是高度有力的(ic50範圍1-10nm),而且對表達很低水平tim-3的aml細胞系(cmk,tf-1,molm-13)展現顯著的細胞毒性活性。實施例29:公開的抗tim3的免疫綴合物(假單胞菌外毒素a綴合物)(fab-pe24構建物)對來自復發性/頑固性患者的原代白血病幹/祖aml細胞的細胞毒性活性來自復發性/頑固性患者外周血的cd34+細胞是自allcell,llc,alameda,ca獲得的。確認所有樣品的純度和存活力(純度範圍84-94%和存活力範圍95-99%)後,如實施例7中所述使用抗tim-3單抗344823(r&d)通過facs評估tim-3表達水平(見圖31)。所有測試的(4/4)來自復發性/頑固性患者的原代白血病幹/祖(cd34+)aml樣品以不同水平展現均質tim-3表達。為了評估公開的抗tim3克隆0016和0022的fab-pe24構建物對原代cd34+aml細胞的細胞毒性活性,將1x104個細胞(50μl/孔,在98孔mtp中,一式三份)與fab片段的1:5連續稀釋液(最高濃度50μg/ml)或適宜培養基(對未處理細胞)或非結合性抗psmafab-pe24對照(對非靶向處理細胞)一起於37℃溫育3天。使用環己醯亞胺作為陽性對照。如上文實施例28中所述用promegacelltiter-glo發光細胞存活力測定法分析細胞毒性活性。結果顯示於表28(公開的抗tim3抗體的fab-pe24構建物對原代cd34+aml細胞的細胞毒性活性)。表28:公開的抗tim3抗體的fab-pe24構建物對原代cd34+aml細胞的細胞毒性活性抗tim3抗體tim3_0016和tim3_0022的fab-pe24構建物對(2/4)原代aml樣品(pb0142和pb0135)是高度有力的(ic50範圍30-116nm),而且對所有(4/4)表達不同水平tim-3的原代白血病幹/祖(cd34+)aml細胞展現顯著的細胞毒性活性。實施例30:選定的抗tim3抗體的fab-pe24構建物對nhl和mm細胞系的效力的比較如上文實施例28中描述的用promegacelltiter-glo發光細胞存活力測定法分析選定的公開的抗tim3抗體的分選酶偶聯的fab-pe24構建物的細胞毒性活性的評估。結果顯示於表29。表29:選定的抗tim3抗體fab-pe24構建物對nhl和mm細胞的細胞毒性活性所有選定的公開的抗tim3抗體的fab-pe24構建物對表達中等水平tim-3的nhl(pfeiffer)和mm(rpmi-8226)細胞展現高細胞毒性效力(ic50範圍0.3-5nm)。對公開的抗tim3抗體tim3_0016和tim3_0038的fab-pe24構建物觀察到最高細胞毒性活性。實施例31:公開的抗tim-3抗體的相同克隆的fab-pe24構建物與整個igg-鵝膏蕈毒素綴合物對pfeiffer細胞的細胞毒性活性的比較如上文實施例12中描述的用promegacelltiter-glo發光細胞存活力測定法分析公開的抗tim3克隆0016的綴合的fab-pe24構建物與綴合有鵝膏蕈毒素的相同克隆的整個igg(依照wo2012/041504中記載的規程,經由鵝膏蕈毒素胺基酸4的6′c原子綴合,特別是經由結合至鵝膏蕈毒素胺基酸6′c原子的氧原子,且其中該tim3抗體是經由脲模塊通過接頭連接的)的細胞毒性活性的評估。結果顯示於表30。表30:抗tim3克隆0016的fab-pe24構建物與整個igg-鵝膏蕈毒素綴合物對nhl細胞的細胞毒性活性鵝膏蕈鹼綴合的抗tim-3克隆0016(ic500.8nm)對表達中等水平tim-3的nhl(pfeiffer)細胞的細胞毒性活性與相同克隆的fab-pe24構建物的細胞毒性活性(ic500.3nm)相當。實施例32患者和腫瘤樣品加工自34名具有非小細胞肺癌的患者,7名具有卵巢癌的患者和1名具有腎細胞癌(rcc)的患者收集新鮮切除的實體瘤損害和惡性滲出液。機械剝離實體瘤損害並在切除後直接使用accutase(paa),膠原酶iv(worthington),透明質酸酶(sigma),和iv型dna酶(sigma)消化。製備單細胞懸浮液。使用histopaque-1119(sigma)通過密度梯度離心分離惡性滲出液的細胞級分。所有樣品保存於液氮中直至進一步使用。研究得到了當地倫理審查委員會(ethikkommissionnordwestschweiz)的批准。實施例33腫瘤樣品表徵通過多色流式細胞術全面表徵所有腫瘤樣品。使用下述抗體進行流式細胞術分析:α-cd4-pe,α-cd8-pe-cy7,α-cd11b-percp-efluor710,α-cd45-pe-cy7,α-cd45-percp-cy5.5,α-cd137-fitc,α-btla-生物素,α-ctla-4-pe,α-icos-fitc,α-ifn-γ-fitc,α-lag-3-apc(均ebioscience),α-cd3-pecf594,α-cd25-bv605,α-cd69-fitc,α-epcam-fitc,α-粒酶b-pe,α-活性胱天蛋白酶3-pe,α-pd-1-bv605,鏈黴親合素-bv711(均bdbioscience),α-cd45ra-bv421,α-ccr7-alexafluor647,α-foxp3-alexafluor647,α-tim-3-bv421,α-tim-3-bv605(均biolegend)。用可固定近ir死細胞染色試劑盒或可固定藍色死細胞染色試劑盒(invitrogen)對死細胞染色。對於細胞內染色,使用來自ebioscience的固定和透化緩衝液。在bdlsrfortessa上獲取樣品進行流式細胞術分析。人il-2,ifn-γ和tnfelisa套組均得自bdbioscience。對cd8+和cd4+t細胞(cd45+cd3+)表徵表面標誌物pd-1,tim-3,ctla-4,lag-3,btla,cd25,cd69,cd137,icos,cd45ra和ccr7的表達。對腫瘤細胞(cd45-epcam+)表徵folr1的表達,與它的匹配同種型對照比較folr1特異性抗體的結合。只有對folr1表達呈陽性的樣品用於folr1-tcb的處理,而且只有表達epcam的樣品用於catumaxomab的處理。實施例34folr1-tcb對腫瘤樣品的離體處理將folr1陽性腫瘤消化物或惡性滲出液融化,清洗,並在完全培養基(dmem+丙酮酸鈉(1mm)+mem非必需aa(1x)+l-glutamin(2mm)+青黴素/鏈黴素(100ng/ml)+2-巰基乙醇(50nm)+ciproxin(1mg/ml)+10%人血清)中以3x105個細胞/200μl/孔的密度分配入96孔平底細胞培養板(bdfalcon)。樣品在濃度為2nm的folr1-tcb或dp47tcb存在或缺失下培養24小時。通過測量細胞表面標誌物cd25,cd69,cd137,icos,pd-1和tim-3的表達,通過多色流式細胞術測定folr1-tcb處理後cd8+和cd4+t細胞(cd45+cd3+)的活化。另外,通過細胞內染色測定粒酶b和ifn-γ的表達。通過elisa(人il-2elisa套組,bdopteia)遵循製造商的用法說明書測量細胞培養物上清液中il-2的濃度。實施例35卡妥索單抗(catumaxomab)對腫瘤樣品的離體處理三功能tcb卡妥索單抗得自fresenius。實驗條件與上文關於folr1-tcb指出的相似。簡言之,epcam陽性腫瘤消化物或惡性滲出液在濃度為10ng/ml的卡妥索單抗存在或缺失下培養24小時。如上文描述的那樣實施對cd8+和cd4+陽性t細胞(cd45+cd3+)的分析。實施例36殺傷測定法為了測定folr1-tcb誘導的腫瘤細胞殺傷,3x104個cfse標記的skov3細胞與腫瘤樣品一起在濃度為2nm的folr1-tcb存在或缺失下在96孔平底細胞培養板中共培養24小時。在每個孔中將e:t比(e:效應cd45+cd3+細胞;t:來自腫瘤的靶folr1+細胞和添加的skov3細胞)調整至1:1,並依照之前通過流式細胞術進行的表徵為每份樣品計算添加的腫瘤樣品的細胞數。通過測量活化的胱天蛋白酶3和活/死標誌物live/dead-近ir,通過流式細胞術測定skov3細胞的細胞死亡。一式三份實施測定法。依照下述方程計算folr1-tcb介導的殺傷:%特異性殺傷=100–[(folr1-tcb處理樣品中skov3活細胞的%/未處理樣品中skov3活細胞的%)x100]。為了在腫瘤樣品之間比較folr1-tcb誘導的t細胞殺傷能力及排除別的遏制t細胞功能性的因素,諸如腫瘤細胞上pd-l1的表達,我們對腫瘤消化物外源添加cfse標記的folr1+skov3細胞,並將e:t比調整至1:1,本質上如上文描述的。然後我們測量folr1-tcb誘導的cfse標記的skov3細胞殺傷,這還容許我們在分析中包括folr1-腫瘤樣品。由於一些來自初始分組的腫瘤不能用於表徵tcb介導的腫瘤細胞殺傷(由於效應細胞的量很低),因此分析一個分開的分組,來自15名非小細胞肺癌(nsclc)和2名上皮卵巢癌(eoc)患者的12份腫瘤消化物和5份惡性滲出液。對所有樣品表徵它們的cd3+效應細胞和folr1+靶細胞含量(圖39)。比較來自患者的cd3+t細胞的腫瘤細胞殺傷與來自健康供體的pbmc衍生的t細胞。24小時之後觀察到患者個體之間腫瘤細胞殺傷的實質性異質性(26±11.8%)(圖12o)。注意,來自健康供體的cd3+t細胞誘導比til顯著更好的殺傷(42.8±9.7%,p=0.013)。對不結合腫瘤抗原的對照tcb(dp47-tcb)的暴露沒有誘導任何腫瘤細胞殺傷。實施例37抗cd3/cd28抗體的多克隆刺激將96孔平底板用0.5ug/ml抗cd3ε(克隆okt3,biolegend)於37℃預包被2小時。之後,去除抗體溶液,並充分清洗板。將冷凍的腫瘤懸浮液融化,清洗,並以3x105個細胞/200μl/孔在含2μg/ml抗cd28抗體(克隆28.2,ebioscience)的完全培養基中培養24小時。溫育24小時之後,收集細胞,清洗,並通過流式細胞術分析cd8+t細胞上活化標誌物(例如cd25)的表達和t細胞效應器功能(例如粒酶b和ifn-γ)。收集上清液進行il-2,ifn-γ和tnf-αelisa,依照製造商的用法說明書實施。實施例38通過pd-1阻斷恢復t細胞功能如上文描述的那樣在每孔10μg/ml抗pd-1抗體(mdx5c4)存在或缺失下通過激動性抗cd3和抗cd28抗體刺激腫瘤消化物,並溫育24小時。24小時後,收集細胞,清洗,並通過流式細胞術分析。收集上清液進行il-2,ifn-γ和tnf-αelisa,依照製造商的用法說明書實施。實施例39腫瘤消化物和惡性滲出液中folr1tcb對t細胞的活化嚙合cd3和葉酸受體1的t細胞雙特異性抗體(基於mov19的folr1-tcb)和對照抗體dp47-tcb由rocheglycart提供。抗pd-1抗體5c4是美國專利no.8,008,449中描述的。使用抗tim3抗體f38-2el。對於folr1表達的流式細胞術表徵,使用來自lifespanbiosciences的抗體抗folr1-apc(aa25-233)和它的匹配同種型對照(biolegend)。對來自15名具有folr1+腫瘤的患者的腫瘤損害表徵由folr1tcb誘導的t細胞活化。樣品由衍生自具有nsclc(n=7),卵巢癌(n=7),和腎細胞癌(n=1)的患者的9份單細胞懸浮液和6份惡性滲出液組成。cd3+t細胞和folr1+腫瘤細胞的量在患者之間高度可變(cd3+:均值33.9%±標準偏差16.6%,folr1+:17.1%±16.8%)。t細胞上抑制性受體pd-1,tim-3,ctla-4,lag-和btla表達的表徵揭示了患者間極大的異質性(圖11a-b)。雖然腫瘤浸潤性cd8+t細胞顯示高水平的pd-1,tim-3和ctla-4(分別為31.6%±25%;22.2%±20.8%和18.7%±14.4%),但是lag-3和btla只在這個分組的所有患者中的少數細胞上表達(分別為3.5%±4.9%和2.3%±1.7%)。cd4+t細胞上的抑制性受體的分布相似,ctla-4有略微更加突出的表達。為了測定folr1-tcb誘導的t細胞活化,在folr1-tcb或對照tcbdp-47存在或缺失下培養腫瘤樣品。然後,通過多色流式細胞術對t細胞表徵活化標誌物的表達和t細胞效應器功能,如上文描述的。圖12a-o揭示了患者之間folr1-tcb誘導的t細胞活化中極大的異質性。特別是,雖然絕大多數患者在基線時就表達cd69,但是分別觀察到9-80%,2.5-50%和3.5-71%變化的cd25,cd137,和icos上調。觀察到效應器功能(諸如ifn-γ分泌,cd107脫粒和粒酶b表達)的獲得,範圍分別為3.7-59%,倍數變化1-7或1.3-64(圖12a-i)。作為folr1-tcb處理後活化的一項標誌物,抑制性受體pd-1和tim-3進一步上調,不管它們的基線表達。對tcbdp-47的暴露沒有誘導任何t細胞活化。由folr1-tcb刺激誘導的cd25和icos上調在來自健康供體的外周cd8+t細胞中比腫瘤衍生的cd8+細胞顯著更強(分別為p=0.002和p<0.001;圖12j,圖12l,圖12m)。folr1-tcb刺激後t細胞效應器細胞因子ifn-γ,il-2,和tnf的分泌在大多數腫瘤中的til中與來自健康供體的pbmc相比大大降低(分別為p=0.0047,p15%)細胞的患者細胞群體沒有能力分泌這些細胞因子。相反,在大多數具有更低量的pd-1高表達性(大約<15%)細胞的患者細胞群體中能誘導細胞因子分泌(圖27a-c)。在後一組中,在folr1-tcb刺激的刺激後添加針對pd-1的阻斷性抗體或組合阻斷pd-1和tim-3提高il-2,ifn-γ和tnf-α的生成(圖28a-f)。因此pd-1高表達性子集可展現更加耗竭的表型,它看來對單獨的pd-1阻斷是有抗性的。如此,t細胞效應器功能諸如il-2,ifn-γ和tnf-α的生成在來自一些nsclc患者的til中能恢復,而在其他患者中僅僅能實現t細胞功能的邊緣性恢復。將與pd-1阻斷性抗體組合暴露於抗cd3/cd28刺激後細胞因子生成的升高與來自每名患者的pd-1陽性群體的pd-1高cd8+t細胞的百分比比較。pd-1阻斷後細胞因子表達的升高與pd-1高t細胞的百分比逆相關,指示表達大數目的pd-1高t細胞的患者對單獨的pd-1阻斷響應較差(圖24a-c)。因為t細胞功能障礙與多種抑制性受體的表達(即具有高ir得分的患者)有關,而且對pd-1定向療法的響應與cd8+t細胞上pd-1的表達水平有關,所以我們進一步分析pd-1高和pd-1中cd8+t細胞中tim-3,ctla-4,lag-3和btla的表達。引人注目的是,pd-1高t細胞表達與pd-1中子集相比顯著更高水平的另外的受體(圖34)。如此,pd-1高和pd-1中可鑑定兩種獨特t細胞群體,其中pd-1高t細胞可展現更加耗竭的表型,它不能通過單獨的pd-1阻斷來恢復。本文中呈現的數據第一次提供來自nsclc患者的腫瘤浸潤性cd8+t細胞的全面表型和功能分析。數據顯示這些細胞主要擁有效應記憶表型(ccr7-cd45ra低),而且顯示抑制性受體諸如pd-1,tim-3,ctla-4,lag-3和btla表達的較大異質性。無論如何,觀察到來自晚期階段腫瘤的腫瘤浸潤性淋巴細胞(til)上表達的受體的數目的清楚增加,這反映了腫瘤形成期間t細胞功能障礙的進展。本文中呈現的數據顯示til的效應器功能在絕大多數患者中是受損的,而且損害與抑制性受體的表達有關。為了在臨床相關設置中恢復t細胞功能,我們組合了多克隆t細胞刺激與抗體介導的對pd-1的抑制。pd-1阻斷對t細胞功能性的影響在來自不同患者的til之間變化,但是能通過評估以高水平表達pd-1的cd8+t細胞的百分比來預測。這裡,我們能證明til的功能性能與抑制性受體的數目和表達水平關聯起來且受到大大影響。值得注意的是,甚至表達低水平的抑制性受體的t細胞顯示一些程度的受損的功能性,因為絕大多數患者中il-2的分泌是受損的。總體上,cd8+t細胞的活化和效應器功能與抑制性受體的累積表達逆相關,指示nsclc中不同抑制性途徑對t細胞功能障礙的直接貢獻。我們對腫瘤浸潤性cd8+t細胞上的五種抑制性受體的分析顯示來自呈現腫瘤陽性淋巴結和高級腫瘤階段的nsclc患者的腫瘤組織中這些抑制性受體的單一和累積表達的清楚升高。ctla-4的表達不同於其它四種受體(在早期階段具有最高百分比的陽性細胞),這可能指示ctla-4在調節t細胞免疫中的獨特作用(topalianetal.,safety,activity,andimmunecorrelatesofanti-pd-1antibodyincancer.n.engl.j.med.366,2443(jun28,2012))。單一細胞上另外的抑制性受體的共表達分析相對於一種給定受體的表達顯示逐漸表達,分別具有pd-1和btla的早期和晚期上調。這可能反映t細胞耗竭的動態過程。本文中呈現的發現強調了nsclc腫瘤進展期間的抑制性受體表達的臨床相關性,它與對腫瘤生長的免疫控制的逐漸失敗有關。我們在這裡記錄了cd8+腫瘤浸潤性t細胞的兩種群體,其特徵在於不同水平的pd-1表達(pd-1高和pd-1中子集)。pd-1高t細胞的發生與pd-1表達的百分比沒有關聯。有趣的是,我們觀察到pd-1阻斷的效果與pd-1表達的水平有關,對具有高比例的pd-1高亞群的til的響應性的影響最小。這些發現與鼠慢性lcmv感染模型中的實驗一致,其中pd-1中dbgp33-特異性cd8+t細胞子集能在pd-1阻斷後得到恢復。相反,pd-1高子集看來更加「耗竭」,即展現功能性耗竭的跡象,而且對pd-1阻斷的響應較差。如此,pd-1表達的水平可能代表定義人癌症中的獨特t細胞子集的一種新穎標誌物,而且可充當對pd-1阻斷性抗體治療的響應的預報器。實施例47folr1-tcb對來自健康供體和癌症患者的t細胞的活化為了評估folr1-tcb對t細胞活化的影響,將來自健康供體的外周血單個核細胞(pbmc)與folr1+卵巢癌細胞系skov3共培養(圖40a)。暴露於範圍為0.6pm至2nm的漸增濃度的folr1-tcb達24小時後,我們觀察到cd8+t細胞的強活化及cd25,cd137,和icos的上調。另外,t細胞分泌il-2,ifn-γ,和tnf。暴露於dp47-tcb(一種針對無關抗原的tcb)沒有誘導任何t細胞活化(圖40b和c)。實施例48腫瘤浸潤性cd8+t細胞中的抑制性受體表達是高度多樣的因為腫瘤駐留性t細胞頻繁展示高度功能障礙性表現,在folr1-tcb刺激後在不同患者間觀察到的t細胞活化的異質性可能是由於受損的til功能性。慢性病毒感染和腫瘤二者中功能障礙性t細胞的一項標誌是抑制性受體的過表達。為此,我們測定了所有腫瘤樣品中腫瘤浸潤性cd8+t細胞上免疫檢查點pd-1,tim-3,ctla-4,lag-3,和btla的表達。我們觀察到不同腫瘤間這些受體的頻率和組合表達的高多樣性;發現pd-1是最突出的抑制性受體,具有最高百分比的表達的(60.2±30%),接著是tim-3(29.5±24.4%),ctla-4(24.6±17.6%),lag-3(7.0±5.9%),和btla(3.9±2.6%)(圖35f)。如先前在鼠慢性病毒感染模型中描述的(blackburnetal.,procnatlacadsciusa2008;105(39):15016-21)及如本文在人腫瘤中顯示的,pd-1+群體可以分成pd-1高和pd-1中表達亞群(圖35a)。對這些特定子集上表達的另外的抑制性受體的分析顯示pd-1高亞群中所有其它抑制性受體(包括tim-3,ctla-4,lag-3,和btla)的表達與pd-1中和pd-1陰性子集中這些受體的表達相比顯著更高(圖36a-d)。因此,我們使用cd8+子集中pd-1高t細胞的百分比作為抑制性受體的累積表達的替代標誌物。腫瘤樣品依照pd-1高細胞的頻率分成分別具有高(pd-1高豐富的腫瘤)和低(pd-1高貧乏的腫瘤)頻率的pd-1高表達性t細胞的兩組。選擇30%pd-1高表達的截留值來分開這兩組。pd-1高細胞的百分比的範圍,pd-1高豐富的組中為39.1-60.5%(49.5±7.9%),pd-1高貧乏的組中為2.65-19.5%(8.4±5.7%;圖36e)。在具有相似pd-1高細胞頻率分布的14名nsclc和2名卵巢癌患者的第二分組中驗證了截留值,其中我們在抗cd3/抗cd28抗體的多克隆刺激後觀察到相當的結果(圖39)。實施例49folr1-tcb誘導的t細胞活化大大依賴於cd8+t細胞上pd-1表達的水平我們分析了抑制性受體的表達是否能與folr1-tcb處理後降低的t細胞功能性關聯起來。與上文實施例41中描述的結果一致,與pd-1高貧乏的腫瘤相比,folr1-tcb誘導的t細胞活化(以cd25,cd137,和icos表達例示,分別為p=0.028,p<0.001,和p=0.008)和t細胞效應器功能(以ifn-γ,il-2,tnf,以及穿孔素分泌指示)在pd-1高豐富的腫瘤中顯著受損(分別為p=0.019,p=0.007,p=0.028,和p=0.029;圖37a-g)。類似地,pd-1高豐富的腫瘤在folr1-tcb刺激後展示顯著降低的細胞毒性,而在大多數pd-1高貧乏的腫瘤中能觀察到強腫瘤細胞殺傷(p=0.021;圖37h)。實施例50pd-1阻斷只在pd-1高貧乏的腫瘤中恢復folr1-tcb誘導的t細胞功能由於til上pd-1表達的水平與folr1-tcb的功效有關,我們分析了與folr1-tcb處理組合阻斷pd-1/pd-l1軸是否可能能夠恢復t細胞功能。我們發現在用folr1-tcb和pd-1阻斷性抗體nivolumab(mdx5c4)組合處理後效應器細胞因子ifn-γ,tnf,和il-2以及穿孔素的分泌只在一些pd-1高貧乏的腫瘤中能升高。相反,在pd-1高豐富的腫瘤中,pd-1阻斷未能引發任何響應(圖38a-d)。值得注意的是,在來自pd-1高貧乏的或pd-1高豐富的腫瘤的t細胞中均不能通過另外的pd-1阻斷來改善細胞毒性腫瘤細胞殺傷(圖38e)。本文中給出的例子描述了cd3xfolr1特異性tcb在來自具有非小細胞肺癌(nsclc),上皮卵巢癌(eoc)和腎細胞癌(rcc)的患者的原發性癌症損害中的免疫調控能力。與來自健康供體的完全功能性的外周t細胞相比,我們觀察到不同人腫瘤樣品間folr1-tcb誘導的腫瘤細胞殺傷和t細胞活化的實質性異質性,導致對大多數患者中t細胞功能的部分或完全損害。對腫瘤內t細胞的細胞表面上的抑制性受體表達的全面分析揭示了folr1-tcb的t細胞活化的功效與pd-1的表達水平逆相關。具有pd-1高豐富的腫瘤的患者在folr1-tcb處理後展示受損的t細胞活化和效應器功能。另外,這些患者不響應pd-1阻斷,與它們的pd-1高貧乏的表達對應物形成對比。如此,雙特異性抗體的生物活性受到t細胞功能障礙的可觀妨礙,這至少部分伴有持久且高度多樣的抑制性受體表達。我們在來自健康供體的pbmc中在folr1-tcb刺激後觀察到t細胞活化標誌物,效應器細胞因子分泌和腫瘤細胞殺傷的強上調(圖40)。恰恰相反,然而,t細胞效應器功能大大變化,而且在腫瘤內t細胞中一般降低。特別是,在大多數腫瘤中il-2生成完全喪失和tnf和ifn-γ分泌嚴重受損的til中的殺傷能力和效應器細胞因子生成顯著更低。我們記錄了腫瘤內cd8+t細胞上抑制性受體pd-1,tim-3,ctla-4,lag-3,和btla的表達。pd-1展示所有分析的抑制性受體中最廣泛的表達。blackburn得出的來自慢性鼠lcmv感染的觀察結果提示功能上不同的pd-1陽性t細胞子集的存在,它們可以使用流式細胞術基於mfi水平分開(blackburnetal.,pnas105(39):15016(2008))。值得注意的是,pd-1高t細胞子集展示tim-3和ctla-4的高共表達及lag-3和btla的程度較低的共表達,而它們的pd-1中對應物只表達低水平的其它抑制性受體,與pd-1陰性t細胞相當。pd-1高cd8+t細胞的頻率在患者間大大不同,而且容許我們區分pd-1高豐富的和貧乏的腫瘤。與具有pd-1高貧乏表型的患者形成對比,展示pd-1高豐富表型的腫瘤中folr1-tcb介導的t細胞活化和腫瘤細胞殺傷顯著受損。這些數據延伸及確認先前的觀察結果,即cd8+t細胞的活化和效應器功能與多種免疫檢查點的共表達有關(sakuishietal.,jexpmed2010;207(10):2187-94;fourcadeetal.,jexpmed2010;207(10):2175-86;grossoetal.,jimmunol2009;182(11):6659-69;matsuzakietal.,procnatlacadsciusa2010;107(17):7875-80;fourcadeetal.,cancerres2012;72(4):887-96)。因此pd-1高t細胞的頻率可能作為tcb活化後til功能性的替代標誌物是有用的以及充當針對tcb處理的治療性響應的預測標誌物。這種免疫概況能指導選擇很可能響應免疫療法諸如tcb的患者。它與臨床好處的關聯有待在前瞻性臨床幹預中確定。改善tcb的治療功效的一條有希望的路徑是阻斷t細胞上的抑制性信號。因為pd-1是所有分析的腫瘤中最突出表達的抑制性受體,我們評估了pd-1阻斷是否能在tcb活化後增強t細胞效應器功能。值得注意的是,我們在組合folr1-tcb和抗pd-1處理後觀察到升高的效應器細胞因子分泌,儘管只在pd-1高貧乏的腫瘤中。如此,顯然需要利用pd-1高轉變成pd-1中t細胞來提高對pd-1/pd-l1阻斷的易感性的新穎治療策略。引人注目的是,我們在伴隨pd-1阻斷後在所有腫瘤樣品中沒有觀察到腫瘤細胞殺傷的改善。如此,阻斷單一免疫檢查點可能不足以恢復til的溶胞能力。然而,在小鼠腫瘤模型中,阻斷pd-1/pd-l1軸已經顯示出提高t細胞浸潤入腫瘤中(curranetal.,procnatlacadsciusa2010;107(9):4275-80),這種處理的這種特徵是我們的體外辦法無法解決的。如此,pd-1阻斷的體內治療效果可能不僅源自改善殘留的腫瘤內t細胞的t細胞細胞毒性,而且源自新浸潤的t細胞的持久功能性。tcb誘導的t細胞活化已經顯示出上調pd-1表達,這在腫瘤細胞和浸潤性免疫細胞二者上表達的pd-l1存在下可導致繼發抗性(secondaryresistance),正如最近用her2特異性tcb和癌胚抗原(cea)特異性tcb二者證明的(junttilaetal.,cancerres2014;74(19):5561-71;osadaetal.,cancerimmunolimmunother2015)。重要的是,阻斷pd-1/pd-l1軸在體外及在小鼠腫瘤模型中均能完全恢復tcb誘導的t細胞功能。這些觀察結果指示共施用檢查點抑制劑能夠預防繼發抗性,它可能疊加til的功能障礙性狀態及限制tcb的治療功效。顯然需要進一步的工作來確定檢查點抑制劑和tcb的最佳組合方案。鑑定具有非冗餘功能的抑制性和活化性t細胞受體作為潛在治療靶也會是至關緊要的。我們的發現清楚地指示雙特異性抗體諸如folr1-tcb能夠引起t細胞上調共刺激分子,生成炎性細胞因子,及獲取溶胞功能。我們觀察到不同狀態的t細胞功能障礙,它們至少部分伴有抑制性受體的表達,而且在一些情況中降低tcb的有效性。因為pd-1阻斷只能部分恢復folr1-tcb誘導的效應器功能,我們的結果提示一種有點複雜的免疫調節,它利用多種且最終無冗餘的途徑來維持腫瘤環境內的t細胞功能障礙。序列例示性實施方案的胺基酸序列1)在共同輕鏈型式中有用的folr結合物,可變重鏈2)cd3結合物,共同輕鏈(clc)3)cd3結合物,重鏈4)對於crossfab型式有用的folr結合物5)在crossfab型式中有用的cd3結合物6)cd3-folr雙特異性抗體2+1倒轉的crossmab型式的例示性胺基酸序列7)具有共同輕鏈的cd3-folr雙特異性抗體的例示性胺基酸序列8)具有降低的親和力的例示性16d5變體a.具有降低的親和力的例示性輕鏈變體b.具有降低的親和力的例示性重鏈變體9)自噬菌體展示文庫生成的另外的例示性實施方案(cdr標有下劃線)10)9d11糖位點變體:例示性實施方案的可變輕鏈(cdr標有下劃線)11)脫氨變體12)例示性實施方案的基於mov19的folr1tcb(cdr標有下劃線)13)具有中等親和力結合物的另外的folr1tcb(依照kabat的cdr標有下劃線)14)抗原序列2)例示性實施方案的核苷酸序列例示性抗pd-1拮抗劑序列例示性抗tim3抗體序列如下,下文序列表中列出了例示性抗tim3抗體胺基酸序列和例示性tim3序列:儘管為了理解清楚的目的已經通過例示和實施例較為詳細地描述了前述發明,但是該描述和實施例不應解釋為限制本發明的範圍。通過提述明確完整收錄本文中引用的所有專利和科學文獻的公開內容。序列表豪夫邁·羅氏有限公司(f.hoffmann-larocheag)t細胞活化性雙特異性抗原結合分子cd3abd葉酸受體1(folr1)和pd-1軸結合拮抗劑的組合療法32401ep15167173.22015-05-11ep15152141.62015-01-22ep14194136.92014-11-20430patentinversion3.51120prt人工序列來源/註解="人工序列的描述:合成的多肽"1glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrtyralaglyvalthrpropheasptyrtrpglygln100105110glythrleuvalthrvalserser1151202120prt人工序列來源/註解="人工序列的描述:合成的多肽"2glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrtyrthrglyglyserseralapheasptyrtrpgly100105110glnglythrleuvalthrvalser1151203120prt人工序列來源/註解="人工序列的描述:合成的多肽"3glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrtyrleupheserthrserpheasptyrtrpglygln100105110glythrleuvalthrvalserser1151204120prt人工序列來源/註解="人工序列的描述:合成的多肽"4glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrtyrileglyilevalpropheasptyrtrpglygln100105110glythrleuvalthrvalserser1151205120prt人工序列來源/註解="人工序列的描述:合成的多肽"5glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrtyrvalglyvalserpropheasptyrtrpglygln100105110glythrleuvalthrvalserser1151206120prt人工序列來源/註解="人工序列的描述:合成的多肽"6glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasnphethrvalleuargvalpropheasptyrtrpglygln100105110glythrleuvalthrvalserser1151207120prt人工序列來源/註解="人工序列的描述:合成的多肽"7glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrtyrileglyvalvalthrpheasptyrtrpglygln100105110glythrleuvalthrvalserser11512085prt人工序列來源/註解="人工序列的描述:合成的肽"8sertyrtyrmethis15917prt人工序列來源/註解="人工序列的描述:合成的肽"9ileileasnproserglyglyserthrsertyralaglnlysphegln151015gly1011prt人工序列來源/註解="人工序列的描述:合成的肽"10asntyrtyrileglyvalvalthrpheasptyr151011120prt人工序列來源/註解="人工序列的描述:合成的多肽"11glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyglutrpargargtyrthrserpheasptyrtrpglygln100105110glythrleuvalthrvalserser1151201211prt人工序列來源/註解="人工序列的描述:合成的肽"12glyglutrpargargtyrthrserpheasptyr151013120prt人工序列來源/註解="人工序列的描述:合成的多肽"13glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyglytrpileargtrpgluhispheasptyrtrpglygln100105110glythrleuvalthrvalserser1151201411prt人工序列來源/註解="人工序列的描述:合成的肽"14glyglytrpileargtrpgluhispheasptyr151015120prt人工序列來源/註解="人工序列的描述:合成的多肽"15gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserser115120165prt人工序列來源/註解="人工序列的描述:合成的肽"16asnalatrpmetser151719prt人工序列來源/註解="人工序列的描述:合成的肽"17argilelysserlysthraspglyglythrthrasptyralaalapro151015vallysgly189prt人工序列來源/註解="人工序列的描述:合成的肽"18protrpglutrpsertrptyrasptyr1519120prt人工序列來源/註解="人工序列的描述:合成的多肽"19gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertyrpheasptyrtrpglygln100105110glythrleuvalthrvalserser115120209prt人工序列來源/註解="人工序列的描述:合成的肽"20protrpglutrpsertyrpheasptyr1521120prt人工序列來源/註解="人工序列的描述:合成的多肽"21gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpalatrppheasptyrtrpglygln100105110glythrleuvalthrvalserser115120229prt人工序列來源/註解="人工序列的描述:合成的肽"22protrpglutrpalatrppheasptyr1523120prt人工序列來源/註解="人工序列的描述:合成的多肽"23gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpalatyrpheasptyrtrpglygln100105110glythrleuvalthrvalserser115120249prt人工序列來源/註解="人工序列的描述:合成的肽"24protrpglutrpalatyrpheasptyr1525120prt人工序列來源/註解="人工序列的描述:合成的多肽"25glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargthrglytrpserargtrpglytyrmetasptyrtrpglygln100105110glythrleuvalthrvalserser1151202611prt人工序列來源/註解="人工序列的描述:合成的肽"26thrglytrpserargtrpglytyrmetasptyr151027120prt人工序列來源/註解="人工序列的描述:合成的多肽"27glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyglutrpileargtyrtyrhispheasptyrtrpglygln100105110glythrleuvalthrvalserser1151202811prt人工序列來源/註解="人工序列的描述:合成的肽"28glyglutrpileargtyrtyrhispheasptyr151029120prt人工序列來源/註解="人工序列的描述:合成的多肽"29glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargvalglytrptyrargtrpglytyrmetasptyrtrpglygln100105110glythrleuvalthrvalserser1151203011prt人工序列來源/註解="人工序列的描述:合成的肽"30valglytrptyrargtrpglytyrmetasptyr151031109prt人工序列來源/註解="人工序列的描述:合成的多肽"31glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleu1001053214prt人工序列來源/註解="人工序列的描述:合成的肽"32glyserserthrglyalavalthrthrserasntyralaasn1510337prt人工序列來源/註解="人工序列的描述:合成的肽"33glythrasnlysargalapro15349prt人工序列來源/註解="人工序列的描述:合成的肽"34alaleutrptyrserasnleutrpval1535215prt人工序列來源/註解="人工序列的描述:合成的多肽"35glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleuglyglnpro100105110lysalaalaproservalthrleupheproproserserglugluleu115120125glnalaasnlysalathrleuvalcysleuileseraspphetyrpro130135140glyalavalthrvalalatrplysalaaspserserprovallysala145150155160glyvalgluthrthrthrproserlysglnserasnasnlystyrala165170175alasersertyrleuserleuthrprogluglntrplysserhisarg180185190sertyrsercysglnvalthrhisgluglyserthrvalglulysthr195200205valalaprothrglucysser21021536125prt人工序列來源/註解="人工序列的描述:合成的多肽"36gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserser115120125375prt人工序列來源/註解="人工序列的描述:合成的肽"37thrtyralametasn153819prt人工序列來源/註解="人工序列的描述:合成的肽"38argileargserlystyrasnasntyralathrtyrtyralaaspser151015vallysgly3914prt人工序列來源/註解="人工序列的描述:合成的肽"39hisglyasnpheglyasnsertyrvalsertrpphealatyr151040228prt人工序列來源/註解="人工序列的描述:合成的多肽"40gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserseralaserthr115120125lysglyproservalpheproleualaproserserlysserthrser130135140glyglythralaalaleuglycysleuvallysasptyrpheproglu145150155160provalthrvalsertrpasnserglyalaleuthrserglyvalhis165170175thrpheproalavalleuglnserserglyleutyrserleuserser180185190valvalthrvalproserserserleuglythrglnthrtyrilecys195200205asnvalasnhislysproserasnthrlysvalasplyslysvalglu210215220prolyssercys22541121prt人工序列來源/註解="人工序列的描述:合成的多肽"41glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglyglythrphesersertyr202530alailesertrpvalargglnalaproglyglnglyleuglutrpmet354045glyglyileileproilepheglythralaasntyralaglnlysphe505560glnglyargvalthrilethralaasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargalavalphetyrargalatrptyrserpheasptyrtrpgly100105110glnglythrthrvalthrvalserser115120425prt人工序列來源/註解="人工序列的描述:合成的肽"42sertyralaileser154317prt人工序列來源/註解="人工序列的描述:合成的肽"43glyileileproilepheglythralaasntyralaglnlysphegln151015gly4412prt人工序列來源/註解="人工序列的描述:合成的肽"44alavalphetyrargalatrptyrserpheasptyr151045107prt人工序列來源/註解="人工序列的描述:合成的多肽"45aspileglnmetthrglnserproserthrleuseralaservalgly151015aspargvalthrilethrcysargalaserglnserilesersertrp202530leualatrptyrglnglnlysproglylysalaprolysleuleuile354045tyraspalaserserleugluserglyvalproserargphesergly505560serglyserglythrgluphethrleuthrileserserleuglnpro65707580aspaspphealathrtyrtyrcysglnglntyrthrserpropropro859095thrpheglyglnglythrlysvalgluilelys1001054611prt人工序列來源/註解="人工序列的描述:合成的肽"46argalaserglnserilesersertrpleuala1510477prt人工序列來源/註解="人工序列的描述:合成的肽"47aspalaserserleugluser15489prt人工序列來源/註解="人工序列的描述:合成的肽"48glnglntyrthrserproproprothr1549119prt人工序列來源/註解="人工序列的描述:合成的多肽"49glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrhisaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargserphephethrglyphehisleuasptyrtrpglyglngly100105110thrleuvalthrvalserser1155010prt人工序列來源/註解="人工序列的描述:合成的肽"50serphephethrglyphehisleuasptyr151051109prt人工序列來源/註解="人工序列的描述:合成的多肽"51gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglntyrthrasngluhis859095tyrtyrthrpheglyglnglythrlysvalgluilelys1001055212prt人工序列來源/註解="人工序列的描述:合成的肽"52argalaserglnservalsersersertyrleuala1510537prt人工序列來源/註解="人工序列的描述:合成的肽"53glyalaserserargalathr155410prt人工序列來源/註解="人工序列的描述:合成的肽"54glnglntyrthrasngluhistyrtyrthr151055117prt人工序列來源/註解="人工序列的描述:合成的多肽"55glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyprothrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyaspphealatrpleuasptyrtrpglyglnglythrleu100105110valthrvalserser1155617prt人工序列來源/註解="人工序列的描述:合成的肽"56ileileasnproserglyglyprothrsertyralaglnlysphegln151015gly578prt人工序列來源/註解="人工序列的描述:合成的肽"57glyaspphealatrpleuasptyr1558112prt人工序列來源/註解="人工序列的描述:合成的多肽"58aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetasnargthrpheglyglnglythrlysvalgluilelys1001051105916prt人工序列來源/註解="人工序列的描述:合成的肽"59argserserglnserleuleuhisserasnglytyrasntyrleuasp151015607prt人工序列來源/註解="人工序列的描述:合成的肽"60leuglyserasnargalaser15619prt人工序列來源/註解="人工序列的描述:合成的肽"61metglnalaserilemetasnargthr1562112prt人工序列來源/註解="人工序列的描述:合成的多肽"62aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetserargthrpheglyglnglythrlysvalgluilelys100105110639prt人工序列來源/註解="人工序列的描述:合成的肽"63metglnalaserilemetserargthr1564112prt人工序列來源/註解="人工序列的描述:合成的多肽"64aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetglnargthrpheglyglnglythrlysvalgluilelys100105110659prt人工序列來源/註解="人工序列的描述:合成的肽"65metglnalaserilemetglnargthr1566112prt人工序列來源/註解="人工序列的描述:合成的多肽"66aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetasnargalapheglyglnglythrlysvalgluilelys100105110679prt人工序列來源/註解="人工序列的描述:合成的肽"67metglnalaserilemetasnargala1568112prt人工序列來源/註解="人工序列的描述:合成的多肽"68aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetasnargasnpheglyglnglythrlysvalgluilelys100105110699prt人工序列來源/註解="人工序列的描述:合成的肽"69metglnalaserilemetasnargasn1570116prt人工序列來源/註解="人工序列的描述:合成的多肽"70glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargsertyrileaspmetasptyrtrpglyglnglythrleuval100105110thrvalserser115717prt人工序列來源/註解="人工序列的描述:合成的肽"71sertyrileaspmetasptyr1572107prt人工序列來源/註解="人工序列的描述:合成的多肽"72gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnaspasntrpserpro859095thrpheglyglnglythrlysvalgluilelys100105738prt人工序列來源/註解="人工序列的描述:合成的肽"73glnglnaspasntrpserprothr1574116prt人工序列來源/註解="人工序列的描述:合成的多肽"74glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargsertyrvalaspmetasptyrtrpglyglnglythrleuval100105110thrvalserser115757prt人工序列來源/註解="人工序列的描述:合成的肽"75sertyrvalaspmetasptyr1576107prt人工序列來源/註解="人工序列的描述:合成的多肽"76gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnaspiletrpserpro859095thrpheglyglnglythrlysvalgluilelys100105778prt人工序列來源/註解="人工序列的描述:合成的肽"77glnglnaspiletrpserprothr1578121prt人工序列來源/註解="人工序列的描述:合成的多肽"78gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alalysaspsersertyrvalglutrptyralapheasptyrtrpgly100105110glnglythrleuvalthrvalserser115120795prt人工序列來源/註解="人工序列的描述:合成的肽"79sertyralametser158017prt人工序列來源/註解="人工序列的描述:合成的肽"80alaileserglyserglyglyserthrtyrtyralaaspservallys151015gly8112prt人工序列來源/註解="人工序列的描述:合成的肽"81aspsersertyrvalglutrptyralapheasptyr151082108prt人工序列來源/註解="人工序列的描述:合成的多肽"82gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspserthrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnprothrserserpro859095ilethrpheglyglnglythrlysvalgluilelys100105839prt人工序列來源/註解="人工序列的描述:合成的肽"83glnglnprothrserserproilethr1584103prt人工序列來源/註解="人工序列的描述:合成的多肽"84alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercys10085103prt人工序列來源/註解="人工序列的描述:合成的多肽"85alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercys10086214prt人工序列來源/註解="人工序列的描述:合成的多肽"86glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleuserserala100105110serthrlysglyproservalpheproleualaproserserlysser115120125thrserglyglythralaalaleuglycysleuvallysasptyrphe130135140progluprovalthrvalsertrpasnserglyalaleuthrsergly145150155160valhisthrpheproalavalleuglnserserglyleutyrserleu165170175serservalvalthrvalproserserserleuglythrglnthrtyr180185190ilecysasnvalasnhislysproserasnthrlysvalasplyslys195200205valgluprolyssercys21087232prt人工序列來源/註解="人工序列的描述:合成的多肽"87gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserseralaserval115120125alaalaproservalpheilepheproproseraspgluglnleulys130135140serglythralaservalvalcysleuleuasnasnphetyrproarg145150155160glualalysvalglntrplysvalaspasnalaleuglnserglyasn165170175serglngluservalthrgluglnaspserlysaspserthrtyrser180185190leuserserthrleuthrleuserlysalaasptyrglulyshislys195200205valtyralacysgluvalthrhisglnglyleuserserprovalthr210215220lysserpheasnargglyglucys22523088105prt人工序列來源/註解="人工序列的描述:合成的多肽"88valalaalaproservalpheilepheproproseraspgluglnleu151015lysserglythralaservalvalcysleuleuasnasnphetyrpro202530argglualalysvalglntrplysvalaspasnalaleuglnsergly354045asnserglngluservalthrgluglnaspserlysaspserthrtyr505560serleuserserthrleuthrleuserlysalaasptyrglulyshis65707580lysvaltyralacysgluvalthrhisglnglyleuserserproval859095thrlysserpheasnargglyglucys10010589689prt人工序列來源/註解="人工序列的描述:合成的多肽"89gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220glyglyglyglyserglyglyglyglysergluvalglnleuleuglu225230235240serglyglyglyleuvalglnproglyglyserleuargleusercys245250255alaalaserglyphethrpheserthrtyralametasntrpvalarg260265270glnalaproglylysglyleuglutrpvalserargileargserlys275280285tyrasnasntyralathrtyrtyralaaspservallysglyargphe290295300thrileserargaspaspserlysasnthrleutyrleuglnmetasn305310315320serleuargalagluaspthralavaltyrtyrcysvalarghisgly325330335asnpheglyasnsertyrvalsertrpphealatyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys90450prt人工序列來源/註解="人工序列的描述:合成的多肽"90gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220lysthrhisthrcysproprocysproalaproglualaalaglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserhisglu260265270aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglntyrasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysalaleuglyalaproileglu325330335lysthrileserlysalalysglyglnproarggluproglnvalcys340345350thrleuproproserargaspgluleuthrlysasnglnvalserleu355360365sercysalavallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleuvalserlysleuthrvalasp405410415lysserargtrpglnglnglyasnvalphesercysservalmethis420425430glualaleuhisasnargphethrglnlysserleuserleuserpro435440445glylys45091689prt人工序列來源/註解="人工序列的描述:合成的多肽"91gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserseralaserthr115120125lysglyproservalpheproleualaproserserlysserthrser130135140glyglythralaalaleuglycysleuvallysasptyrpheproglu145150155160provalthrvalsertrpasnserglyalaleuthrserglyvalhis165170175thrpheproalavalleuglnserserglyleutyrserleuserser180185190valvalthrvalproserserserleuglythrglnthrtyrilecys195200205asnvalasnhislysproserasnthrlysvalasplyslysvalglu210215220prolyssercysaspglyglyglyglyserglyglyglyglyserglu225230235240valglnleuvalgluserglyglyglyleuvallysproglyglyser245250255leuargleusercysalaalaserglyphethrpheserasnalatrp260265270metsertrpvalargglnalaproglylysglyleuglutrpvalgly275280285argilelysserlysthraspglyglythrthrasptyralaalapro290295300vallysglyargphethrileserargaspaspserlysasnthrleu305310315320tyrleuglnmetasnserleulysthrgluaspthralavaltyrtyr325330335cysthrthrprotrpglutrpsertrptyrasptyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys92455prt人工序列來源/註解="人工序列的描述:合成的多肽"92gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserseralaserthr115120125lysglyproservalpheproleualaproserserlysserthrser130135140glyglythralaalaleuglycysleuvallysasptyrpheproglu145150155160provalthrvalsertrpasnserglyalaleuthrserglyvalhis165170175thrpheproalavalleuglnserserglyleutyrserleuserser180185190valvalthrvalproserserserleuglythrglnthrtyrilecys195200205asnvalasnhislysproserasnthrlysvalasplyslysvalglu210215220prolyssercysasplysthrhisthrcysproprocysproalapro225230235240glualaalaglyglyproservalpheleupheproprolysprolys245250255aspthrleumetileserargthrprogluvalthrcysvalvalval260265270aspvalserhisgluaspprogluvallyspheasntrptyrvalasp275280285glyvalgluvalhisasnalalysthrlysproargglugluglntyr290295300asnserthrtyrargvalvalservalleuthrvalleuhisglnasp305310315320trpleuasnglylysglutyrlyscyslysvalserasnlysalaleu325330335glyalaproileglulysthrileserlysalalysglyglnproarg340345350gluproglnvaltyrthrleuproprocysargaspgluleuthrlys355360365asnglnvalserleutrpcysleuvallysglyphetyrproserasp370375380ilealavalglutrpgluserasnglyglnprogluasnasntyrlys385390395400thrthrproprovalleuaspseraspglyserphepheleutyrser405410415lysleuthrvalasplysserargtrpglnglnglyasnvalpheser420425430cysservalmethisglualaleuhisasnhistyrthrglnlysser435440445leuserleuserproglylys45045593227prt人工序列來源/註解="人工序列的描述:合成的多肽"93asplysthrhisthrcysproprocysproalaprogluleuleugly151015glyproservalpheleupheproprolysprolysaspthrleumet202530ileserargthrprogluvalthrcysvalvalvalaspvalserhis354045gluaspprogluvallyspheasntrptyrvalaspglyvalgluval505560hisasnalalysthrlysproargglugluglntyrasnserthrtyr65707580argvalvalservalleuthrvalleuhisglnasptrpleuasngly859095lysglutyrlyscyslysvalserasnlysalaleuproalaproile100105110glulysthrileserlysalalysglyglnproarggluproglnval115120125cysthrleuproproserargaspgluleuthrlysasnglnvalser130135140leusercysalavallysglyphetyrproseraspilealavalglu145150155160trpgluserasnglyglnprogluasnasntyrlysthrthrpropro165170175valleuaspseraspglyserphepheleuvalserlysleuthrval180185190asplysserargtrpglnglnglyasnvalphesercysservalmet195200205hisglualaleuhisasnargphethrglnlysserleuserleuser210215220proglylys22594690prt人工序列來源/註解="人工序列的描述:合成的多肽"94glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyprothrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyaspphealatrpleuasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysaspglyglygly210215220glyserglyglyglyglysergluvalglnleuleugluserglygly225230235240glyleuvalglnproglyglyserleuargleusercysalaalaser245250255glyphethrpheserthrtyralametasntrpvalargglnalapro260265270glylysglyleuglutrpvalserargileargserlystyrasnasn275280285tyralathrtyrtyralaaspservallysglyargphethrileser290295300argaspaspserlysasnthrleutyrleuglnmetasnserleuarg305310315320alagluaspthralavaltyrtyrcysvalarghisglyasnphegly325330335asnsertyrvalsertrpphealatyrtrpglyglnglythrleuval340345350thrvalserseralaservalalaalaproservalpheilephepro355360365proseraspgluglnleulysserglythralaservalvalcysleu370375380leuasnasnphetyrproargglualalysvalglntrplysvalasp385390395400asnalaleuglnserglyasnserglngluservalthrgluglnasp405410415serlysaspserthrtyrserleuserserthrleuthrleuserlys420425430alaasptyrglulyshislysvaltyralacysgluvalthrhisgln435440445glyleuserserprovalthrlysserpheasnargglyglucysasp450455460lysthrhisthrcysproprocysproalaproglualaalaglygly465470475480proservalpheleupheproprolysprolysaspthrleumetile485490495serargthrprogluvalthrcysvalvalvalaspvalserhisglu500505510aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis515520525asnalalysthrlysproargglugluglntyrasnserthrtyrarg530535540valvalservalleuthrvalleuhisglnasptrpleuasnglylys545550555560glutyrlyscyslysvalserasnlysalaleuglyalaproileglu565570575lysthrileserlysalalysglyglnproarggluproglnvaltyr580585590thrleuproprocysargaspgluleuthrlysasnglnvalserleu595600605trpcysleuvallysglyphetyrproseraspilealavalglutrp610615620gluserasnglyglnprogluasnasntyrlysthrthrproproval625630635640leuaspseraspglyserphepheleutyrserlysleuthrvalasp645650655lysserargtrpglnglnglyasnvalphesercysservalmethis660665670glualaleuhisasnhistyrthrglnlysserleuserleuserpro675680685glylys69095447prt人工序列來源/註解="人工序列的描述:合成的多肽"95glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyprothrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyaspphealatrpleuasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysasplysthrhis210215220thrcysproprocysproalaproglualaalaglyglyproserval225230235240pheleupheproprolysprolysaspthrleumetileserargthr245250255progluvalthrcysvalvalvalaspvalserhisgluaspproglu260265270vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys275280285thrlysproargglugluglntyrasnserthrtyrargvalvalser290295300valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys305310315320cyslysvalserasnlysalaleuglyalaproileglulysthrile325330335serlysalalysglyglnproarggluproglnvalcysthrleupro340345350proserargaspgluleuthrlysasnglnvalserleusercysala355360365vallysglyphetyrproseraspilealavalglutrpgluserasn370375380glyglnprogluasnasntyrlysthrthrproprovalleuaspser385390395400aspglyserphepheleuvalserlysleuthrvalasplysserarg405410415trpglnglnglyasnvalphesercysservalmethisglualaleu420425430hisasnhistyrthrglnlysserleuserleuserproglylys43544044596219prt人工序列來源/註解="人工序列的描述:合成的多肽"96aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetasnargthrpheglyglnglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys21021597648dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"修飾的鹼基(603)..(603)a,c,t,g,未知或其它97gaaatcgtgttaacgcagtctccaggcaccctgtctttgtctccaggggaaagagccacc60ctctcttgcagggccagtcagagtgttagcagcagctact標籤cctggtaccagcagaaa120cctggccaggctcccaggctcctcatctatggagcatccagcagggccactggcatccca180gacaggttcagtggcagtggatccgggacagacttcactctcaccatcagcagactggag240cctgaagattttgcagtgtattactgtcagcagtataccaacgaacattattatacgttc300ggccaggggaccaaagtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttc360ccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataac420ttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaac480tcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcacc540ctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccat600canggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt64898459prt人工序列來源/註解="人工序列的描述:合成的多肽"98gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserseralaserval115120125alaalaproservalpheilepheproproseraspgluglnleulys130135140serglythralaservalvalcysleuleuasnasnphetyrproarg145150155160glualalysvalglntrplysvalaspasnalaleuglnserglyasn165170175serglngluservalthrgluglnaspserlysaspserthrtyrser180185190leuserserthrleuthrleuserlysalaasptyrglulyshislys195200205valtyralacysgluvalthrhisglnglyleuserserprovalthr210215220lysserpheasnargglyglucysasplysthrhisthrcyspropro225230235240cysproalaproglualaalaglyglyproservalpheleuphepro245250255prolysprolysaspthrleumetileserargthrprogluvalthr260265270cysvalvalvalaspvalserhisgluaspprogluvallyspheasn275280285trptyrvalaspglyvalgluvalhisasnalalysthrlysproarg290295300glugluglntyrasnserthrtyrargvalvalservalleuthrval305310315320leuhisglnasptrpleuasnglylysglutyrlyscyslysvalser325330335asnlysalaleuglyalaproileglulysthrileserlysalalys340345350glyglnproarggluproglnvaltyrthrleuproprocysargasp355360365gluleuthrlysasnglnvalserleutrpcysleuvallysglyphe370375380tyrproseraspilealavalglutrpgluserasnglyglnproglu385390395400asnasntyrlysthrthrproprovalleuaspseraspglyserphe405410415pheleutyrserlysleuthrvalasplysserargtrpglnglngly420425430asnvalphesercysservalmethisglualaleuhisasnhistyr435440445thrglnlysserleuserleuserproglylys45045599689prt人工序列來源/註解="人工序列的描述:合成的多肽"99gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220glyglyglyglyserglyglyglyglysergluvalglnleuleuglu225230235240serglyglyglyleuvalglnproglyglyserleuargleusercys245250255alaalaserglyphethrpheserthrtyralametasntrpvalarg260265270glnalaproglylysglyleuglutrpvalserargileargserlys275280285tyrasnasntyralathrtyrtyralaaspservallysglyargphe290295300thrileserargaspaspserlysasnthrleutyrleuglnmetasn305310315320serleuargalagluaspthralavaltyrtyrcysvalarghisgly325330335asnpheglyalasertyrvalsertrpphealatyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys100689prt人工序列來源/註解="人工序列的描述:合成的多肽"100gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220glyglyglyglyserglyglyglyglysergluvalglnleuleuglu225230235240serglyglyglyleuvalglnproglyglyserleuargleusercys245250255alaalaserglyphethrpheserthrtyralametasntrpvalarg260265270glnalaproglylysglyleuglutrpvalserargileargserlys275280285tyrasnasntyralathrtyrtyralaaspservallysglyargphe290295300thrileserargaspaspserlysasnthrleutyrleuglnmetasn305310315320serleuargalagluaspthralavaltyrtyrcysvalarghisgly325330335asnpheglyasnalatyrvalsertrpphealatyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys101441prt人工序列來源/註解="人工序列的描述:合成的多肽"101glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleuserserala100105110serthrlysglyproservalpheproleualaproserserlysser115120125thrserglyglythralaalaleuglycysleuvallysasptyrphe130135140progluprovalthrvalsertrpasnserglyalaleuthrsergly145150155160valhisthrpheproalavalleuglnserserglyleutyrserleu165170175serservalvalthrvalproserserserleuglythrglnthrtyr180185190ilecysasnvalasnhislysproserasnthrlysvalasplyslys195200205valgluprolyssercysasplysthrhisthrcysproprocyspro210215220alaproglualaalaglyglyproservalpheleupheproprolys225230235240prolysaspthrleumetileserargthrprogluvalthrcysval245250255valvalaspvalserhisgluaspprogluvallyspheasntrptyr260265270valaspglyvalgluvalhisasnalalysthrlysproarggluglu275280285glntyrasnserthrtyrargvalvalservalleuthrvalleuhis290295300glnasptrpleuasnglylysglutyrlyscyslysvalserasnlys305310315320alaleuglyalaproileglulysthrileserlysalalysglygln325330335proarggluproglnvaltyrthrleuproproserargaspgluleu340345350thrlysasnglnvalserleuthrcysleuvallysglyphetyrpro355360365seraspilealavalglutrpgluserasnglyglnprogluasnasn370375380tyrlysthrthrproprovalleuaspseraspglyserphepheleu385390395400tyrserlysleuthrvalasplysserargtrpglnglnglyasnval405410415phesercysservalmethisglualaleuhisasnhistyrthrgln420425430lysserleuserleuserproglylys435440102227prt人工序列來源/註解="人工序列的描述:合成的多肽"102gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaservalalaalaproserval115120125pheilepheproproseraspgluglnleulysserglythralaser130135140valvalcysleuleuasnasnphetyrproargglualalysvalgln145150155160trplysvalaspasnalaleuglnserglyasnserglngluserval165170175thrgluglnaspserlysaspserthrtyrserleuserserthrleu180185190thrleuserlysalaasptyrglulyshislysvaltyralacysglu195200205valthrhisglnglyleuserserprovalthrlysserpheasnarg210215220glyglucys225103231prt人工序列來源/註解="人工序列的描述:合成的多肽"103gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnsertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserseralaserpro115120125lysalaalaproservalthrleupheproproserserglugluleu130135140glnalaasnlysalathrleuvalcysleuileseraspphetyrpro145150155160glyalavalthrvalalatrplysalaaspserserprovallysala165170175glyvalgluthrthrthrproserlysglnserasnasnlystyrala180185190alasersertyrleuserleuthrprogluglntrplysserhisarg195200205sertyrsercysglnvalthrhisgluglyserthrvalglulysthr210215220valalaprothrglucysser225230104118prt人工序列來源/註解="人工序列的描述:合成的多肽"104glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyglyserglyglyserpheasptyrtrpglyglnglythr100105110leuvalthrvalserser115105118prt人工序列來源/註解="人工序列的描述:合成的多肽"105glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglyglythrphesersertyr202530alailesertrpvalargglnalaproglyglnglyleuglutrpmet354045glyglyileileproilepheglythralaasntyralaglnlysphe505560glnglyargvalthrilethralaasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyglyserglyglysermetaspalatrpglyglnglythr100105110thrvalthrvalserser115106120prt人工序列來源/註解="人工序列的描述:合成的多肽"106gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrglyglyserglyglyserpheasptyrtrpglygln100105110glythrleuvalthrvalserser115120107118prt人工序列來源/註解="人工序列的描述:合成的多肽"107gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alalysglyglyserglyglyserpheasptyrtrpglyglnglythr100105110leuvalthrvalserser115108117prt人工序列來源/註解="人工序列的描述:合成的多肽"108glnvalglnleuglngluserglyproglyleuvallysproserglu151015thrleuserleuthrcysthrvalserglyglyserilesersertyr202530tyrtrpsertrpileargglnproproglylysglyleuglutrpile354045glytyriletyrtyrserglyserthrasntyrasnproserleulys505560serargvalthrileservalaspthrserlysasnglnpheserleu65707580lysleuserservalthralaalaaspthralavaltyrtyrcysala859095argglyglyserglyglyserpheasptyrtrpglyglnglythrleu100105110valthrvalserser115109118prt人工序列來源/註解="人工序列的描述:合成的多肽"109gluvalglnleuvalglnserglyalagluvallyslysproglyglu151015serleulysilesercyslysglyserglytyrserphethrsertyr202530trpileglytrpvalargglnmetproglylysglyleuglutrpmet354045glyileiletyrproglyaspseraspthrargtyrserproserphe505560glnglyglnvalthrileseralaasplysserileserthralatyr65707580leuglntrpserserleulysalaseraspthralamettyrtyrcys859095alaargglyglyserglyglyserpheasptyrtrpglyglnglythr100105110leuvalthrvalserser115110109prt人工序列來源/註解="人工序列的描述:合成的多肽"110glnthrvalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleu100105111107prt人工序列來源/註解="人工序列的描述:合成的多肽"111aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnserilesersertyr202530leuasntrptyrglnglnlysproglylysalaprolysleuleuile354045tyralaalaserserleuglnserglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglnsertyrserthrproleu859095thrpheglyglyglythrlysvalgluilelys100105112109prt人工序列來源/註解="人工序列的描述:合成的多肽"112glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleu100105113109prt人工序列來源/註解="人工序列的描述:合成的多肽"113glnthrvalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglnlysproglyglnalaproarggly354045leuileglyglythrasnalaargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyval65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleu100105114109prt人工序列來源/註解="人工序列的描述:合成的多肽"114glnthrvalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglnlysproglyglnalaproarggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyval65707580glnprogluaspglualaglutyrtyrcysalaleutrptyralaasn859095leutrpvalpheglyglyglythrlysleuthrvalleu100105115122prt人工序列來源/註解="人工序列的描述:合成的多肽"115gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmethistrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120116122prt人工序列來源/註解="人工序列的描述:合成的多肽"116gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045serargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120117122prt人工序列來源/註解="人工序列的描述:合成的多肽"117gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyserilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120118122prt人工序列來源/註解="人工序列的描述:合成的多肽"118gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotyrglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120119122prt人工序列來源/註解="人工序列的描述:合成的多肽"119gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutyrsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120120122prt人工序列來源/註解="人工序列的描述:合成的多肽"120glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrthrilevalvalserpropheasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120121122prt人工序列來源/註解="人工序列的描述:合成的多肽"121glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargasntyrpheileglyservalalametasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120122119prt人工序列來源/註解="人工序列的描述:合成的多肽"122glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyleuthrtyrsermetasptyrtrpglyglnglythrleu100105110valthrvalserseralaser115123114prt人工序列來源/註解="人工序列的描述:合成的多肽"123aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095leuglnileproasnthrpheglyglnglythrlysvalgluilelys100105110argthr124118prt人工序列來源/註解="人工序列的描述:合成的多肽"124gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alalystyralatyralaleuasptyrtrpglyglnglythrleuval100105110thrvalserseralaser115125109prt人工序列來源/註解="人工序列的描述:合成的多肽"125gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglnhisglyserserser859095thrpheglyglnglythrlysvalgluilelysargthr100105126122prt人工序列來源/註解="人工序列的描述:合成的多肽"126glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyasppheseralaglyargleumetasptyrtrpglygln100105110glythrleuvalthrvalserseralaser115120127115prt人工序列來源/註解="人工序列的描述:合成的多肽"127aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095leuglnthrproproilethrpheglyglnglythrlysvalgluile100105110lysargthr115128119prt人工序列來源/註解="人工序列的描述:合成的多肽"128glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyasptyrasnalapheasptyrtrpglyhisglythrleu100105110valthrvalserseralaser115129113prt人工序列來源/註解="人工序列的描述:合成的多肽"129aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095trphisserprothrpheglyglnglythrlysvalgluilelysarg100105110thr130119prt人工序列來源/註解="人工序列的描述:合成的多肽"130glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyalathrtyrthrmetasptyrtrpglyglnglythrleu100105110valthrvalserseralaser115131114prt人工序列來源/註解="人工序列的描述:合成的多肽"131aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095leuglnthrproilethrpheglyglnglythrlysvalgluilelys100105110argthr132112prt人工序列來源/註解="人工序列的描述:合成的多肽"132aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetserargthrpheglyglnglythrlysvalgluilelys100105110133112prt人工序列來源/註解="人工序列的描述:合成的多肽"133aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetglnargthrpheglyglnglythrlysvalgluilelys100105110134112prt人工序列來源/註解="人工序列的描述:合成的多肽"134aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetasnargalapheglyglnglythrlysvalgluilelys100105110135112prt人工序列來源/註解="人工序列的描述:合成的多肽"135aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetasnargasnpheglyglnglythrlysvalgluilelys100105110136448prt人工序列來源/註解="人工序列的描述:合成的多肽"136glnvalglnleuglnglnserglyalagluleuvallysproglyala151015servallysilesercyslysalaserglytyrserphethrglytyr202530phemetasntrpvallysglnserhisglylysserleuglutrpile354045glyargilehisprotyraspglyaspthrphetyrasnglnasnphe505560lysasplysalathrleuthrvalasplysserserasnthralahis65707580metgluleuleuserleuthrsergluaspphealavaltyrtyrcys859095thrargtyraspglyserargalametasptyrtrpglyglnglythr100105110thrvalthrvalserseralaserthrlysglyproservalphepro115120125leualaproserserlysserthrserglyglythralaalaleugly130135140cysleuvallysasptyrpheprogluprovalthrvalsertrpasn145150155160serglyalaleuthrserglyvalhisthrpheproalavalleugln165170175serserglyleutyrserleuserservalvalthrvalproserser180185190serleuglythrglnthrtyrilecysasnvalasnhislysproser195200205asnthrlysvalasplyslysvalgluprolyssercysasplysthr210215220histhrcysproprocysproalaproglualaalaglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserhisgluasppro260265270gluvallyspheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglntyrasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysalaleuglyalaproileglulysthr325330335ileserlysalalysglyglnproarggluproglnvalcysthrleu340345350proproserargaspgluleuthrlysasnglnvalserleusercys355360365alavallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleuvalserlysleuthrvalasplysser405410415argtrpglnglnglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserproglylys435440445137691prt人工序列來源/註解="人工序列的描述:合成的多肽"137glnvalglnleuglnglnserglyalagluleuvallysproglyala151015servallysilesercyslysalaserglytyrserphethrglytyr202530phemetasntrpvallysglnserhisglylysserleuglutrpile354045glyargilehisprotyraspglyaspthrphetyrasnglnasnphe505560lysasplysalathrleuthrvalasplysserserasnthralahis65707580metgluleuleuserleuthrsergluaspphealavaltyrtyrcys859095thrargtyraspglyserargalametasptyrtrpglyglnglythr100105110thrvalthrvalserseralaserthrlysglyproservalphepro115120125leualaproserserlysserthrserglyglythralaalaleugly130135140cysleuvallysasptyrpheprogluprovalthrvalsertrpasn145150155160serglyalaleuthrserglyvalhisthrpheproalavalleugln165170175serserglyleutyrserleuserservalvalthrvalproserser180185190serleuglythrglnthrtyrilecysasnvalasnhislysproser195200205asnthrlysvalasplyslysvalgluprolyssercysaspglygly210215220glyglyserglyglyglyglysergluvalglnleuvalglusergly225230235240glyglyleuvalglnprolysglyserleulysleusercysalaala245250255serglyphethrpheasnthrtyralametasntrpvalargglnala260265270proglylysglyleuglutrpvalalaargileargserlystyrasn275280285asntyralathrtyrtyralaaspservallysaspargphethrile290295300serargaspaspserglnserileleutyrleuglnmetasnasnleu305310315320lysthrgluaspthralamettyrtyrcysvalarghisglyasnphe325330335glyasnsertyrvalsertrpphealatyrtrpglyglnglythrleu340345350valthrvalseralaalaservalalaalaproservalpheilephe355360365proproseraspgluglnleulysserglythralaservalvalcys370375380leuleuasnasnphetyrproargglualalysvalglntrplysval385390395400aspasnalaleuglnserglyasnserglngluservalthrglugln405410415aspserlysaspserthrtyrserleuserserthrleuthrleuser420425430lysalaasptyrglulyshislysvaltyralacysgluvalthrhis435440445glnglyleuserserprovalthrlysserpheasnargglyglucys450455460asplysthrhisthrcysproprocysproalaproglualaalagly465470475480glyproservalpheleupheproprolysprolysaspthrleumet485490495ileserargthrprogluvalthrcysvalvalvalaspvalserhis500505510gluaspprogluvallyspheasntrptyrvalaspglyvalgluval515520525hisasnalalysthrlysproargglugluglntyrasnserthrtyr530535540argvalvalservalleuthrvalleuhisglnasptrpleuasngly545550555560lysglutyrlyscyslysvalserasnlysalaleuglyalaproile565570575glulysthrileserlysalalysglyglnproarggluproglnval580585590tyrthrleuproprocysargaspgluleuthrlysasnglnvalser595600605leutrpcysleuvallysglyphetyrproseraspilealavalglu610615620trpgluserasnglyglnprogluasnasntyrlysthrthrpropro625630635640valleuaspseraspglyserphepheleutyrserlysleuthrval645650655asplysserargtrpglnglnglyasnvalphesercysservalmet660665670hisglualaleuhisasnhistyrthrglnlysserleuserleuser675680685proglylys690138218prt人工序列來源/註解="人工序列的描述:合成的多肽"138aspilegluleuthrglnserproalaserleualavalserleugly151015glnargalaileilesercyslysalaserglnservalserpheala202530glythrserleumethistrptyrhisglnlysproglyglnglnpro354045lysleuleuiletyrargalaserasnleuglualaglyvalprothr505560argpheserglyserglyserlysthraspphethrleuasnilehis65707580provalgluglugluaspalaalathrtyrtyrcysglnglnserarg859095glutyrprotyrthrpheglyglyglythrlysleugluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215139257prt人(homosapiens)139metalaglnargmetthrthrglnleuleuleuleuleuvaltrpval151015alavalvalglyglualaglnthrargilealatrpalaargthrglu202530leuleuasnvalcysmetasnalalyshishislysglulysprogly354045progluasplysleuhisgluglncysargprotrparglysasnala505560cyscysserthrasnthrserglnglualahislysaspvalsertyr65707580leutyrargpheasntrpasnhiscysglyglumetalaproalacys859095lysarghispheileglnaspthrcysleutyrglucysserproasn100105110leuglyprotrpileglnglnvalaspglnsertrparglysgluarg115120125valleuasnvalproleucyslysgluaspcysgluglntrptrpglu130135140aspcysargthrsertyrthrcyslysserasntrphislysglytrp145150155160asntrpthrserglypheasnlyscysalavalglyalaalacysgln165170175prophehisphetyrpheprothrprothrvalleucysasngluile180185190trpthrhissertyrlysvalserasntyrserargglyserglyarg195200205cysileglnmettrppheaspproalaglnglyasnproasngluglu210215220valalaargphetyralaalaalametserglyalaglyprotrpala225230235240alatrppropheleuleuserleualaleumetleuleutrpleuleu245250255ser140468prt人工序列來源/註解="人工序列的描述:合成的多肽"140argilealatrpalaargthrgluleuleuasnvalcysmetasnala151015lyshishislysglulysproglyprogluasplysleuhisglugln202530cysargprotrparglysasnalacyscysserthrasnthrsergln354045glualahislysaspvalsertyrleutyrargpheasntrpasnhis505560cysglyglumetalaproalacyslysarghispheileglnaspthr65707580cysleutyrglucysserproasnleuglyprotrpileglnglnval859095aspglnsertrparglysgluargvalleuasnvalproleucyslys100105110gluaspcysgluglntrptrpgluaspcysargthrsertyrthrcys115120125lysserasntrphislysglytrpasntrpthrserglypheasnlys130135140cysalavalglyalaalacysglnprophehisphetyrpheprothr145150155160prothrvalleucysasngluiletrpthrhissertyrlysvalser165170175asntyrserargglyserglyargcysileglnmettrppheasppro180185190alaglnglyasnproasnglugluvalalaargphetyralaalaala195200205metvalaspgluglnleutyrpheglnglyglyserprolysserala210215220asplysthrhisthrcysproprocysproalaprogluleuleugly225230235240glyproservalpheleupheproprolysprolysaspthrleumet245250255ileserargthrprogluvalthrcysvalvalvalaspvalserhis260265270gluaspprogluvallyspheasntrptyrvalaspglyvalgluval275280285hisasnalalysthrlysproargglugluglntyrasnserthrtyr290295300argvalvalservalleuthrvalleuhisglnasptrpleuasngly305310315320lysglutyrlyscyslysvalserasnlysalaleuproalaproile325330335glulysthrileserlysalalysglyglnproarggluproglnval340345350tyrthrleuproprocysargaspgluleuthrlysasnglnvalser355360365leutrpcysleuvallysglyphetyrproseraspilealavalglu370375380trpgluserasnglyglnprogluasnasntyrlysthrthrpropro385390395400valleuaspseraspglyserphepheleutyrserlysleuthrval405410415asplysserargtrpglnglnglyasnvalphesercysservalmet420425430hisglualaleuhisasnhistyrthrglnlysserleuserleuser435440445proglylysserglyglyleuasnaspilepheglualaglnlysile450455460glutrphisglu465141227prt人工序列來源/註解="人工序列的描述:合成的多肽"141asplysthrhisthrcysproprocysproalaprogluleuleugly151015glyproservalpheleupheproprolysprolysaspthrleumet202530ileserargthrprogluvalthrcysvalvalvalaspvalserhis354045gluaspprogluvallyspheasntrptyrvalaspglyvalgluval505560hisasnalalysthrlysproargglugluglntyrasnserthrtyr65707580argvalvalservalleuthrvalleuhisglnasptrpleuasngly859095lysglutyrlyscyslysvalserasnlysalaleuproalaproile100105110glulysthrileserlysalalysglyglnproarggluproglnval115120125cysthrleuproproserargaspgluleuthrlysasnglnvalser130135140leusercysalavallysglyphetyrproseraspilealavalglu145150155160trpgluserasnglyglnprogluasnasntyrlysthrthrpropro165170175valleuaspseraspglyserphepheleuvalserlysleuthrval180185190asplysserargtrpglnglnglyasnvalphesercysservalmet195200205hisglualaleuhisasnargphethrglnlysserleuserleuser210215220proglylys225142255prt小鼠(musmusculus)142metalahisleumetthrvalglnleuleuleuleuvalmettrpmet151015alaglucysalaglnserargalathrargalaargthrgluleuleu202530asnvalcysmetaspalalyshishislysglulysproglyproglu354045aspasnleuhisaspglncysserprotrplysthrasnsercyscys505560serthrasnthrserglnglualahislysaspilesertyrleutyr65707580argpheasntrpasnhiscysglythrmetthrserglucyslysarg859095hispheileglnaspthrcysleutyrglucysserproasnleugly100105110protrpileglnglnvalaspglnsertrparglysgluargileleu115120125aspvalproleucyslysgluaspcysglnglntrptrpgluaspcys130135140glnserserphethrcyslysserasntrphislysglytrpasntrp145150155160serserglyhisasnglucysprovalglyalasercyshisprophe165170175thrphetyrpheprothrseralaalaleucysglugluiletrpser180185190hissertyrlysleuserasntyrserargglyserglyargcysile195200205glnmettrppheaspproalaglnglyasnproasnglugluvalala210215220argphetyralaglualametserglyalaglyleuhisglythrtrp225230235240proleuleucysserleuserleuvalleuleutrpvalileser245250255143466prt人工序列來源/註解="人工序列的描述:合成的多肽"143thrargalaargthrgluleuleuasnvalcysmetaspalalyshis151015hislysglulysproglyprogluaspasnleuhisaspglncysser202530protrplysthrasnsercyscysserthrasnthrserglngluala354045hislysaspilesertyrleutyrargpheasntrpasnhiscysgly505560thrmetthrserglucyslysarghispheileglnaspthrcysleu65707580tyrglucysserproasnleuglyprotrpileglnglnvalaspgln859095sertrparglysgluargileleuaspvalproleucyslysgluasp100105110cysglnglntrptrpgluaspcysglnserserphethrcyslysser115120125asntrphislysglytrpasntrpserserglyhisasnglucyspro130135140valglyalasercyshisprophethrphetyrpheprothrserala145150155160alaleucysglugluiletrpserhissertyrlysleuserasntyr165170175serargglyserglyargcysileglnmettrppheaspproalagln180185190glyasnproasnglugluvalalaargphetyralaglualametval195200205aspgluglnleutyrpheglnglyglyserprolysseralaasplys210215220thrhisthrcysproprocysproalaprogluleuleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserhisgluasp260265270progluvallyspheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglntyrasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysalaleuproalaproileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproprocysargaspgluleuthrlysasnglnvalserleutrp355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserlysleuthrvalasplys405410415serargtrpglnglnglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserprogly435440445lysserglyglyleuasnaspilepheglualaglnlysileglutrp450455460hisglu465144257prt食蟹猴(macacafascicularis)144metalaglnargmetthrthrglnleuleuleuleuleuvaltrpval151015alavalvalglyglualaglnthrargthralaargalaargthrglu202530leuleuasnvalcysmetasnalalyshishislysglulysprogly354045progluasplysleuhisgluglncysargprotrplyslysasnala505560cyscysserthrasnthrserglnglualahislysaspvalsertyr65707580leutyrargpheasntrpasnhiscysglyglumetalaproalacys859095lysarghispheileglnaspthrcysleutyrglucysserproasn100105110leuglyprotrpileglnglnvalaspglnsertrparglysgluarg115120125valleuasnvalproleucyslysgluaspcysgluargtrptrpglu130135140aspcysargthrsertyrthrcyslysserasntrphislysglytrp145150155160asntrpthrserglypheasnlyscysprovalglyalaalacysgln165170175prophehisphetyrpheprothrprothrvalleucysasngluile180185190trpthrtyrsertyrlysvalserasntyrserargglyserglyarg195200205cysileglnmettrppheaspproalaglnglyasnproasngluglu210215220valalaargphetyralaalaalametserglyalaglyprotrpala225230235240alatrpproleuleuleuserleualaleuthrleuleutrpleuleu245250255ser145468prt人工序列來源/註解="人工序列的描述:合成的多肽"145argthralaargalaargthrgluleuleuasnvalcysmetasnala151015lyshishislysglulysproglyprogluasplysleuhisglugln202530cysargprotrplyslysasnalacyscysserthrasnthrsergln354045glualahislysaspvalsertyrleutyrargpheasntrpasnhis505560cysglyglumetalaproalacyslysarghispheileglnaspthr65707580cysleutyrglucysserproasnleuglyprotrpileglnglnval859095aspglnsertrparglysgluargvalleuasnvalproleucyslys100105110gluaspcysgluglntrptrpgluaspcysargthrsertyrthrcys115120125lysserasntrphislysglytrpasntrpthrserglypheasnlys130135140cysprovalglyalaalacysglnprophehisphetyrpheprothr145150155160prothrvalleucysasngluiletrpthrtyrsertyrlysvalser165170175asntyrserargglyserglyargcysileglnmettrppheasppro180185190alaglnglyasnproasnglugluvalalaargphetyralaalaala195200205metvalaspgluglnleutyrpheglnglyglyserprolysserala210215220asplysthrhisthrcysproprocysproalaprogluleuleugly225230235240glyproservalpheleupheproprolysprolysaspthrleumet245250255ileserargthrprogluvalthrcysvalvalvalaspvalserhis260265270gluaspprogluvallyspheasntrptyrvalaspglyvalgluval275280285hisasnalalysthrlysproargglugluglntyrasnserthrtyr290295300argvalvalservalleuthrvalleuhisglnasptrpleuasngly305310315320lysglutyrlyscyslysvalserasnlysalaleuproalaproile325330335glulysthrileserlysalalysglyglnproarggluproglnval340345350tyrthrleuproprocysargaspgluleuthrlysasnglnvalser355360365leutrpcysleuvallysglyphetyrproseraspilealavalglu370375380trpgluserasnglyglnprogluasnasntyrlysthrthrpropro385390395400valleuaspseraspglyserphepheleutyrserlysleuthrval405410415asplysserargtrpglnglnglyasnvalphesercysservalmet420425430hisglualaleuhisasnhistyrthrglnlysserleuserleuser435440445proglylysserglyglyleuasnaspilepheglualaglnlysile450455460glutrphisglu465146255prt人(homosapiens)146metvaltrplystrpmetproleuleuleuleuleuvalcysvalala151015thrmetcysseralaglnaspargthraspleuleuasnvalcysmet202530aspalalyshishislysthrlysproglyprogluasplysleuhis354045aspglncysserprotrplyslysasnalacyscysthralaserthr505560serglngluleuhislysaspthrserargleutyrasnpheasntrp65707580asphiscysglylysmetgluproalacyslysarghispheilegln859095aspthrcysleutyrglucysserproasnleuglyprotrpilegln100105110glnvalasnglnsertrparglysgluargpheleuaspvalproleu115120125cyslysgluaspcysglnargtrptrpgluaspcyshisthrserhis130135140thrcyslysserasntrphisargglytrpasptrpthrserglyval145150155160asnlyscysproalaglyalaleucysargthrpheglusertyrphe165170175prothrproalaalaleucysgluglyleutrpserhissertyrlys180185190valserasntyrserargglyserglyargcysileglnmettrpphe195200205aspseralaglnglyasnproasnglugluvalalaargphetyrala210215220alaalamethisvalasnalaglyglumetleuhisglythrglygly225230235240leuleuleuserleualaleumetleuglnleutrpleuleugly245250255147472prt人工序列來源/註解="人工序列的描述:合成的多肽"147thrmetcysseralaglnaspargthraspleuleuasnvalcysmet151015aspalalyshishislysthrlysproglyprogluasplysleuhis202530aspglncysserprotrplyslysasnalacyscysthralaserthr354045serglngluleuhislysaspthrserargleutyrasnpheasntrp505560asphiscysglylysmetgluproalacyslysarghispheilegln65707580aspthrcysleutyrglucysserproasnleuglyprotrpilegln859095glnvalasnglnsertrparglysgluargpheleuaspvalproleu100105110cyslysgluaspcysglnargtrptrpgluaspcyshisthrserhis115120125thrcyslysserasntrphisargglytrpasptrpthrserglyval130135140asnlyscysproalaglyalaleucysargthrpheglusertyrphe145150155160prothrproalaalaleucysgluglyleutrpserhissertyrlys165170175valserasntyrserargglyserglyargcysileglnmettrpphe180185190aspseralaglnglyasnproasnglugluvalalaargphetyrala195200205alaalamethisvalvalaspgluglnleutyrpheglnglyglyser210215220prolysseralaasplysthrhisthrcysproprocysproalapro225230235240gluleuleuglyglyproservalpheleupheproprolysprolys245250255aspthrleumetileserargthrprogluvalthrcysvalvalval260265270aspvalserhisgluaspprogluvallyspheasntrptyrvalasp275280285glyvalgluvalhisasnalalysthrlysproargglugluglntyr290295300asnserthrtyrargvalvalservalleuthrvalleuhisglnasp305310315320trpleuasnglylysglutyrlyscyslysvalserasnlysalaleu325330335proalaproileglulysthrileserlysalalysglyglnproarg340345350gluproglnvaltyrthrleuproprocysargaspgluleuthrlys355360365asnglnvalserleutrpcysleuvallysglyphetyrproserasp370375380ilealavalglutrpgluserasnglyglnprogluasnasntyrlys385390395400thrthrproprovalleuaspseraspglyserphepheleutyrser405410415lysleuthrvalasplysserargtrpglnglnglyasnvalpheser420425430cysservalmethisglualaleuhisasnhistyrthrglnlysser435440445leuserleuserproglylysserglyglyleuasnaspilepheglu450455460alaglnlysileglutrphisglu465470148243prt人(homosapiens)148metalatrpglnmetmetglnleuleuleuleualaleuvalthrala151015alaglyseralaglnproargseralaargalaargthraspleuleu202530asnvalcysmetasnalalyshishislysthrglnproserproglu354045aspgluleutyrglyglncysserprotrplyslysasnalacyscys505560thralaserthrserglngluleuhislysaspthrserargleutyr65707580asnpheasntrpasphiscysglylysmetgluprothrcyslysarg859095hispheileglnaspsercysleutyrglucysserproasnleugly100105110protrpileargglnvalasnglnsertrparglysgluargileleu115120125asnvalproleucyslysgluaspcysgluargtrptrpgluaspcys130135140argthrsertyrthrcyslysserasntrphislysglytrpasntrp145150155160thrserglyileasnglucysproalaglyalaleucysserthrphe165170175glusertyrpheprothrproalaalaleucysgluglyleutrpser180185190hisserphelysvalserasntyrserargglyserglyargcysile195200205glnmettrppheaspseralaglnglyasnproasnglugluvalala210215220lysphetyralaalaalametasnalaglyalaproserargglyile225230235240ileaspser149479prt人工序列來源/註解="人工序列的描述:合成的多肽"149seralaargalaargthraspleuleuasnvalcysmetasnalalys151015hishislysthrglnproserprogluaspgluleutyrglyglncys202530serprotrplyslysasnalacyscysthralaserthrserglnglu354045leuhislysaspthrserargleutyrasnpheasntrpasphiscys505560glylysmetgluprothrcyslysarghispheileglnaspsercys65707580leutyrglucysserproasnleuglyprotrpileargglnvalasn859095glnsertrparglysgluargileleuasnvalproleucyslysglu100105110aspcysgluargtrptrpgluaspcysargthrsertyrthrcyslys115120125serasntrphislysglytrpasntrpthrserglyileasnglucys130135140proalaglyalaleucysserthrpheglusertyrpheprothrpro145150155160alaalaleucysgluglyleutrpserhisserphelysvalserasn165170175tyrserargglyserglyargcysileglnmettrppheaspserala180185190glnglyasnproasnglugluvalalalysphetyralaalaalamet195200205asnalaglyalaproserargglyileileaspservalaspglugln210215220leutyrpheglnglyglyserprolysseralaasplysthrhisthr225230235240cysproprocysproalaprogluleuleuglyglyproservalphe245250255leupheproprolysprolysaspthrleumetileserargthrpro260265270gluvalthrcysvalvalvalaspvalserhisgluaspprogluval275280285lyspheasntrptyrvalaspglyvalgluvalhisasnalalysthr290295300lysproargglugluglntyrasnserthrtyrargvalvalserval305310315320leuthrvalleuhisglnasptrpleuasnglylysglutyrlyscys325330335lysvalserasnlysalaleuproalaproileglulysthrileser340345350lysalalysglyglnproarggluproglnvaltyrthrleupropro355360365cysargaspgluleuthrlysasnglnvalserleutrpcysleuval370375380lysglyphetyrproseraspilealavalglutrpgluserasngly385390395400glnprogluasnasntyrlysthrthrproprovalleuaspserasp405410415glyserphepheleutyrserlysleuthrvalasplysserargtrp420425430glnglnglyasnvalphesercysservalmethisglualaleuhis435440445asnhistyrthrglnlysserleuserleuserproglylyssergly450455460glyleuasnaspilepheglualaglnlysileglutrphisglu465470475150207prt人(homosapiens)150metglnserglythrhistrpargvalleuglyleucysleuleuser151015valglyvaltrpglyglnaspglyasngluglumetglyglyilethr202530glnthrprotyrlysvalserileserglythrthrvalileleuthr354045cysproglntyrproglysergluileleutrpglnhisasnasplys505560asnileglyglyaspgluaspasplysasnileglyseraspgluasp65707580hisleuserleulysgluphesergluleugluglnserglytyrtyr859095valcystyrproargglyserlysprogluaspalaasnphetyrleu100105110tyrleuargalaargvalcysgluasncysmetglumetaspvalmet115120125servalalathrilevalilevalaspilecysilethrglyglyleu130135140leuleuleuvaltyrtyrtrpserlysasnarglysalalysalalys145150155160provalthrargglyalaglyalaglyglyargglnargglyglnasn165170175lysgluargproproprovalproasnproasptyrgluproilearg180185190lysglyglnargaspleutyrserglyleuasnglnargargile195200205151360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"151caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300tacgctggtgttactccgttcgactattggggtcaaggcaccctcgtaacggtttcttct360152360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"152caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300tacatcggtgttgttactttcgactattggggtcaaggcaccctcgtaacggtttcttct360153363dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"153caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300tacactggtggttcttctgctttcgactattggggtcaaggcaccctcgtaacggtttct360tct363154360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"修飾的鹼基(47)..(47)a,c,t,g,未知或其它154caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgnttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgaa300tggcgtcgttacacttctttcgactattggggtcaaggcaccctcgtaacggtttcttct360155360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"155caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtggt300tggatccgttgggaacatttcgactattggggtcaaggcaccctcgtaacggtttcttct360156360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"156caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300tacctgttctctacttctttcgactattggggtcaaggcaccctcgtaacggtttcttct360157360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"157caggtgcaattggttcaatctggtgctgaggtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300tacatcggtatcgttccgttcgactattggggtcaaggcaccctcgtaacggtttcttct360158360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"158gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360159360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"修飾的鹼基(53)..(53)a,c,t,g,未知或其它159gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttcccngcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaaccgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttacttcgattattggggccagggcacgctggttacggtgtcttcc360160360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"160caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300tacgttggtgtttctccgttcgactattggggtcaaggcaccctcgtaacggtttcttct360161360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"修飾的鹼基(47)..(47)a,c,t,g,未知或其它修飾的鹼基(177)..(177)a,c,t,g,未知或其它161caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgnttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcntac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaacttc300actgttctgcgtgttccgttcgactattggggtcaaggcaccctcgtaacggtttcttct360162360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"162gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatgggcttggttcgattattggggccagggcacgctggttacggtgtcttcc360163360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"163gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaaccgaagacaccgcagtctactactgtactacc300ccttgggaatgggcttacttcgattattggggccagggcacgctggttacggtgtcttcc360164360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"164caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcactggt300tggtctcgttggggttacatggactattggggccaaggcaccctcgtaacggtttcttct360165360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"165caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgaa300tggatccgttactaccatttcgactattggggtcaaggcaccctcgtaacggtttcttct360166360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"166caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcgttggt300tggtaccgttggggttacatggactattggggtcaaggcaccctcgtaacggtttcttct360167363dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"167caggtgcaattggtgcagtctggggctgaggtgaagaagcctgggtcctcggtgaaggtc60tcctgcaaggcctccggaggcacattcagcagctacgctataagctgggtgcgacaggcc120cctggacaagggctcgagtggatgggagggatcatccctatctttggtacagcaaactac180gcacagaagttccagggcagggtaaccattactgcagacaaatccacgagcacagcctac240atggagctgagcagcctgagatctgaggacaccgccgtgtattactgtgcgagagctgtt300ttctaccgtgcttggtactctttcgactactggggccaagggaccaccgtgaccgtctcc360tca363168321dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"168gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagaccgtgtcacc60atcacttgccgtgccagtcagagtattagtagctggttggcctggtatcagcagaaacca120gggaaagcccctaagctcctgatctatgatgcctccagtttggaaagtggggtcccatca180cgtttcagcggcagtggatccgggacagaattcactctcaccatcagcagcttgcagcct240gatgattttgcaacttattactgccaacagtataccagcccaccaccaacgtttggccag300ggcaccaaagtcgagatcaag321169357dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"169caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccatgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgctctttc300ttcactggtttccatctggactattggggtcaaggcaccctcgtaacggtttcttct357170327dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"170gaaatcgtgttaacgcagtctccaggcaccctgtctttgtctccaggggaaagagccacc60ctctcttgcagggccagtcagagtgttagcagcagctact標籤cctggtaccagcagaaa120cctggccaggctcccaggctcctcatctatggagcatccagcagggccactggcatccca180gacaggttcagtggcagtggatccgggacagacttcactctcaccatcagcagactggag240cctgaagattttgcagtgtattactgtcagcagtataccaacgaacattattatacgttc300ggccaggggaccaaagtggaaatcaaa327171351dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"171caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggccctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttcgcttggctggactattggggtcaaggcaccctcgtaacggtttcttct351172336dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"172gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgaac300cggacttttggtcaaggcaccaaggtcgaaattaaa336173336dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"173gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgagc300cggacttttggtcaaggcaccaaggtcgaaattaaa336174336dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"174gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgcag300cggacttttggtcaaggcaccaaggtcgaaattaaa336175336dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"175gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgaac300cgggcttttggtcaaggcaccaaggtcgaaattaaa336176336dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"176gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgaac300cggaattttggtcaaggcaccaaggtcgaaattaaa336177348dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"177caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgctcttac300atcgacatggactattggggtcaaggcaccctcgtaacggtttcttct348178321dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"178gaaatcgtgttaacgcagtctccaggcaccctgtctttgtctccaggggaaagagccacc60ctctcttgcagggccagtcagagtgttagcagcagctact標籤cctggtaccagcagaaa120cctggccaggctcccaggctcctcatctatggagcatccagcagggccactggcatccca180gacaggttcagtggcagtggatccgggacagacttcactctcaccatcagcagactggag240cctgaagattttgcagtgtattactgtcagcaggataactggagcccaacgttcggccag300gggaccaaagtggaaatcaaa321179348dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"179caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgctcttac300gttgacatggactattggggtcaaggcaccctcgtaacggtttcttct348180321dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"180gaaatcgtgttaacgcagtctccaggcaccctgtctttgtctccaggggaaagagccacc60ctctcttgcagggccagtcagagtgttagcagcagctacc標籤cctggtaccagcagaaa120cctggccaggctcccaggctcctcatctatggagcatccagcagggccactggcatccca180gacaggttcagtggcagtggatccgggacagacttcactctcaccatcagcagactggag240cctgaagattttgcagtgtattactgtcagcaggatatttggagcccaacgttcggccag300gggaccaaagtggaaatcaaa321181363dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"181gaggtgcaattgttggagtctgggggaggcttggtacagcctggggggtccctgagactc60tcctgtgcagcctccggattcacctttagcagttatgccatgagctgggtccgccaggct120ccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactac180gcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtat240ctgcagatgaacagcctgagagccgaggacacggccgtatattactgtgcgaaagactct300tcttacgttgaatggtacgctttcgactactggggccaaggaaccctggtcaccgtctcg360agt363182324dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"182gaaatcgtgttaacgcagtctccaggcaccctgtctttgtctccaggggaaagagccacc60ctctcttgcagggccagtcagagtgttagcagcagctact標籤cctggtaccagcagaaa120cctggccaggctcccaggctcctcatctatggagcatccagcagggccactggcatccca180gacaggttcagtggcagtggatccgggacagactccactctcaccatcagcagactggag240cctgaagattttgcagtgtattactgtcagcagccaaccagcagcccaattacgttcggc300caggggaccaaagtggaaatcaaa324183684dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"183gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaacagctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcaagcgctagtaccaagggccccagcgtgttccccctggcacccagcagc420aagagcacatctggcggaacagccgctctgggctgtctggtgaaagactacttccccgag480cccgtgaccgtgtcttggaactctggcgccctgaccagcggcgtgcacacctttccagcc540gtgctgcagagcagcggcctgtactccctgtcctccgtggtcaccgtgccctctagctcc600ctgggaacacagacatatatctgtaatgtcaatcacaagccttccaacaccaaagtcgat660aagaaagtcgagcccaagagctgc684184696dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"184gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaacagctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcaagcgctagtgtggccgctccctccgtgtttatctttcccccatccgat420gaacagctgaaaagcggcaccgcctccgtcgtgtgtctgctgaacaatttttaccctagg480gaagctaaagtgcagtggaaagtggataacgcactgcagtccggcaactcccaggaatct540gtgacagaacaggactccaaggacagcacctactccctgtcctccaccctgacactgtct600aaggctgattatgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagc660tcgcccgtcacaaagagcttcaacaggggagagtgt69618536dna人工序列來源/註解="人工序列的描述:合成的引物"185gcaggcaagcattatgcagcggacttttggtcaagg3618635dna人工序列來源/註解="人工序列的描述:合成的引物"186caggcaagcattatgagccggacttttggtcaagg3518737dna人工序列來源/註解="人工序列的描述:合成的引物"187cattatgaaccgggcttttggtcaaggcaccaaggtc3718837dna人工序列來源/註解="人工序列的描述:合成的引物"188cattatgaaccggaattttggtcaaggcaccaaggtc371892067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"189gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcacaaagggccctagcgtgttccctctggcccccagcagcaagagcacaagcggc420ggaacagccgccctgggctgcctcgtgaaggactacttccccgagcccgtgacagtgtct480tggaacagcggagccctgacaagcggcgtgcacactttccctgccgtgctgcagagcagc540ggcctgtactccctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagccc660aagagctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaa720tctggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggc780ttcaccttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaa840tgggtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtg900aagggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaac960agcctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaac1020agctatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20671901350dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"190gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcaccaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggc420ggcacagccgctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcc480tggaacagcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttct540ggcctgtatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagccc660aagagctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcaggggga720ccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccct780gaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactgg840tacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaac900agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag960gagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctcc1020aaagccaaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgag1080ctgaccaagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatc1140gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg1200ctggactccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtgg1260cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccgcttcacg1320cagaagagcctctccctgtctccgggtaaa1350191645dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"191caggccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcaggaa120aagcccggccaggccttcagaggactgatcggcggcaccaacaagagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgcc240cagccagaagatgaggccgagtactactgcgccctgtggtacagcaacctgtgggtgttc300ggcggaggcaccaagctgacagtcctaggtcaacccaaggctgcccccagcgtgaccctg360ttcccccccagcagcgaggaactgcaggccaacaaggccaccctggtctgcctgatcagc420gacttctacccaggcgccgtgaccgtggcctggaaggccgacagcagccccgtgaaggcc480ggcgtggagaccaccacccccagcaagcagagcaacaacaagtacgccgccagcagctac540ctgagcctgacccccgagcagtggaagagccacaggtcctacagctgccaggtgacccac600gagggcagcaccgtggagaaaaccgtggcccccaccgagtgcagc6451922067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"192gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaacagctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcatctgctagcacaaagggccctagcgtgttccctctggcccccagcagc420aagagcacaagcggcggaacagccgccctgggctgcctcgtgaaggactacttccccgag480cccgtgacagtgtcttggaacagcggagccctgacaagcggcgtgcacaccttccctgcc540gtgctgcagagcagcggcctgtactccctgagcagcgtggtcaccgtgcc標籤cagcagc600ctgggcacccagacctacatctgcaacgtgaaccacaagcccagcaacaccaaagtggac660aagaaggtggagcccaagagctgtgatggcggaggagggtccggaggcggaggatccgag720gtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctgagc780tgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggccccg840ggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacggat900tacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacactctg960tatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactaccccg1020tgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtctagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20671931365dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"193gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaacagctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcatctgctagcaccaagggcccatcggtcttccccctggcaccctcctcc420aagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaa480ccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggct540gtcctacagtcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagc600ttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggac660aagaaagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacct720gaagctgcagggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatg780atctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgag840gtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgg900gaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggac960tggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcggcgcccccatc1020gagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgccc1080ccatgccgggatgagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttc1140tatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaag1200accacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtg1260gacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctg1320cacaaccactacacgcagaagagcctctccctgtctccgggtaaa1365194681dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"194gacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtc60ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca120tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac180ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac240cgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaag300tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaa360gggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctgaccaag420aaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgccgtggag480tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc540gacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcagcagggg600aacgtcttctcatgctccgtgatgcatgaggctctgcacaaccgcttcacgcagaagagc660ctctccctgtctccgggtaaa6811952070dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"195caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggccctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttcgcttggctggactattggggtcaaggcaccctcgtaacggtttcttctgctagcaca360aagggccccagcgtgttccctctggcccctagcagcaagagcacatctggcggaacagcc420gccctgggctgcctcgtgaaggactactttcccgagcctgtgaccgtgtcctggaactct480ggcgccctgacaagcggcgtgcacacctttccagccgtgctgcagagcagcggcctgtac540tctctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacctacatctgc600aacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagcccaagagctgt660gatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaatctggcggc720ggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggcttcaccttc780agcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaatgggtgtcc840cggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtgaagggccgg900ttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaacagcctgcgg960gccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaacagctatgtg1020tcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgc標籤tgtggcc1080gctccctccgtgtttatctttcccccatccgatgaacagctgaaaagcggcaccgcctcc1140gtcgtgtgtctgctgaacaatttttaccctagggaagctaaagtgcagtggaaagtggat1200aacgcactgcagtccggcaactcccaggaatctgtgacagaacaggactccaaggacagc1260acctactccctgtcctccaccctgacactgtctaaggctgattatgagaaacacaaagtc1320tacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacagg1380ggagagtgtgacaagacccacacctgtcccccttgtcctgcccctgaagctgctggcggc1440ccttctgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccggaccccc1500gaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattgg1560tacgtggacggcgtggaagtgcacaacgccaagacaaagccgcgggaggagcagtacaac1620agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag1680gagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctcc1740aaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgag1800ctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatc1860gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg1920ctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtgg1980cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacg2040cagaagagcctctccctgtctccgggtaaa20701961341dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"196caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggccctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttcgcttggctggactattggggtcaaggcaccctcgtaacggtttcttctgctagcacc360aagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggcggcacagcc420gctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcctggaacagc480ggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttctggcctgtat540agcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacctacatctgc600aacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagcccaagagctgc660gacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccgtcagtc720ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca780tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac840ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac900cgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaag960tgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaagccaaa1020gggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctgaccaag1080aaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgccgtggag1140tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc1200gacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcagcagggg1260aacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagc1320ctctccctgtctccgggtaaa1341197657dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"197gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgaac300cggacttttggtcaaggcaccaaggtcgaaattaaacgtacggtggctgcaccatctgtc360ttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctg420ctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaa480tcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctc540agcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaa600gtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt657198642dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"198caggccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcaggaa120aagcccggccaggccttcagaggactgatcggcggcaccaacaagagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgcc240cagccagaagatgaggccgagtactactgcgccctgtggtacagcaacctgtgggtgttc300ggcggaggcaccaagctgacagtgctgagcagcgcttccaccaaaggcccttccgtgttt360cctctggctcctagctccaagtccacctctggaggcaccgctgctctcggatgcctcgtg420aaggattattttcctgagcctgtgacagtgtcctggaatagcggagcactgacctctgga480gtgcatactttccccgctgtgctgcagtcctctggactgtacagcctgagcagcgtggtg540acagtgcccagcagcagcctgggcacccagacctacatctgcaacgtgaaccacaagccc600agcaacaccaaggtggacaagaaggtggaacccaagtcttgt6421991377dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"199gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaacagctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcatctgctagcgtggccgctccctccgtgtttatctttcccccatccgat420gaacagctgaaaagcggcaccgcctccgtcgtgtgtctgctgaacaatttttaccctagg480gaagctaaagtgcagtggaaagtggataacgcactgcagtccggcaactcccaggaatct540gtgacagaacaggactccaaggacagcacctactccctgtcctccaccctgacactgtct600aaggctgattatgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagc660tcgcccgtcacaaagagcttcaacaggggagagtgtgacaagacccacacctgtccccct720tgtcctgcccctgaagctgctggcggcccttctgtgttcctgttccccccaaagcccaag780gacaccctgatgatcagccggacccccgaagtgacctgcgtggtggtggatgtgtcccac840gaggaccctgaagtgaagttcaattggtacgtggacggcgtggaagtgcacaacgccaag900acaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtc960ctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctc1020ggcgcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtg1080tacaccctgcccccatgccgggatgagctgaccaagaaccaggtcagcctgtggtgcctg1140gtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggag1200aacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagc1260aagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatg1320catgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaa13772002067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"200gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcacaaagggccctagcgtgttccctctggcccccagcagcaagagcacaagcggc420ggaacagccgccctgggctgcctcgtgaaggactacttccccgagcccgtgacagtgtct480tggaacagcggagccctgacaagcggcgtgcacactttccctgccgtgctgcagagcagc540ggcctgtactccctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagccc660aagagctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaa720tctggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggc780ttcaccttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaa840tgggtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtg900aagggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaac960agcctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcgcc1020agctatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20672012067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"201gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcacaaagggccctagcgtgttccctctggcccccagcagcaagagcacaagcggc420ggaacagccgccctgggctgcctcgtgaaggactacttccccgagcccgtgacagtgtct480tggaacagcggagccctgacaagcggcgtgcacactttccctgccgtgctgcagagcagc540ggcctgtactccctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagccc660aagagctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaa720tctggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggc780ttcaccttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaa840tgggtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtg900aagggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaac960agcctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaac1020gcctatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20672021323dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"202caggccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcaggaa120aagcccggccaggccttcagaggactgatcggcggcaccaacaagagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgcc240cagccagaagatgaggccgagtactactgcgccctgtggtacagcaacctgtgggtgttc300ggcggaggcaccaagctgacagtgctgagcagcgctagcaccaagggcccatcggtcttc360cccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtc420aaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggc480gtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtg540accgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagccc600agcaacaccaaggtggacaagaaagttgagcccaaatcttgtgacaaaactcacacatgc660ccaccgtgcccagcacctgaagctgcagggggaccgtcagtcttcctcttccccccaaaa720cccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtg780agccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataat840gccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctc900accgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaa960gccctcggcgcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaacca1020caggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacc1080tgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcag1140ccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctc1200tacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctcc1260gtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggt1320aaa1323203681dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"203gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcgtggccgctccctccgtgttcatcttcccaccttccgacgagcagctgaagtcc420ggcaccgcttctgtcgtgtgcctgctgaacaacttctacccccgcgaggccaaggtgcag480tggaaggtggacaacgccctgcagtccggcaacagccaggaatccgtgaccgagcaggac540tccaaggacagcacctactccctgtcctccaccctgaccctgtccaaggccgactacgag600aagcacaaggtgtacgcctgcgaagtgacccaccagggcctgtctagccccgtgaccaag660tctttcaaccggggcgagtgc681204693dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"204gaagtgcagctgctggaatccggcggaggactggtgcagcctggcggatctctgagactg60tcttgtgccgcctccggcttcaccttctccacctacgccatgaactgggtgcgacaggct120cctggcaagggcctggaatgggtgtcccggatcagatccaagtacaacaactacgccacc180tactacgccgactccgtgaagggccggttcaccatctctcgggacgactccaagaacacc240ctgtacctgcagatgaactccctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaactcctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcatctgctagccccaaggctgcccccagcgtgaccctgtttccccccagc420agcgaggaactgcaggccaacaaggccaccctggtctgcctgatcagcgacttctaccca480ggcgccgtgaccgtggcctggaaggccgacagcagccccgtgaaggccggcgtggagacc540accacccccagcaagcagagcaacaacaagtacgccgccagcagctacctgagcctgacc600cccgagcagtggaagagccacaggtcctacagctgccaggtgacccacgagggcagcacc660gtggagaaaaccgtggcccccaccgagtgcagc693205327dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"205cagaccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcagcag120aagccaggccaggctcccagaggactgatcggcggcaccaacgccagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgtg240cagcctgaagatgaggccgagtactactgcgccctgtggtacagcaacctgtgggtgttc300ggcggaggcaccaagctgacagtccta327206327dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"206cagaccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcagcag120aagccaggccaggctcccagaggactgatcggcggcaccaacaagagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgtg240cagcctgaagatgaggccgagtactactgcgccctgtggtacgccaacctgtgggtgttc300ggcggaggcaccaagctgacagtccta327207366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"207gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgcactgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggacggatcaagagcaagaccgatggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctgggagtggtcttggtacgactattggggccagggcaccctcgtgaccgtgtcctct360gctagc366208366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"208gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgtcccggatcaagagcaagaccgatggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctgggagtggtcttggtacgactattggggccagggcaccctcgtgaccgtgtcctct360gctagc366209366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"209gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggatctatcaagagcaagaccgacggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctgggagtggtcttggtacgactattggggccagggcaccctcgtgaccgtgtcctct360gctagc366210366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"210gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggacggatcaagagcaagaccgatggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctacgagtggtcttggtacgactactggggccagggcaccctcgtgaccgtgtcatct360gctagc366211366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"211gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggacggatcaagagcaagaccgatggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctgggagtactcttggtacgactactggggccagggcaccctcgtgaccgtgtcatct360gctagc366212366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"212caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300actatcgttgtttctccgttcgactattggggtcaaggcaccctcgtaacggtttcttct360gctagc366213366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"213caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcaactac300ttcatcggttctgttgctatggactattggggtcaaggcaccctcgtaacggtttcttct360gctagc366214357dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"214caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtctg300acttactctatggactattggggtcaaggcaccctcgtaacggtttcttctgctagc357215342dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"215gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcactgcagattcca300aacacttttggtcaaggcaccaaggtcgaaattaaacgtacg342216354dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"216gaggtgcaattgttggagtctgggggaggcttggtacagcctggggggtccctgagactc60tcctgtgcagcctccggattcacctttagcagttatgccatgagctgggtccgccaggct120ccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactac180gcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtat240ctgcagatgaacagcctgagagccgaggacacggccgtatattactgtgcgaaatacgct300tacgctctggactactggggccaaggaaccctggtcaccgtctcgagtgc標籤c354217327dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"217gaaatcgtgttaacgcagtctccaggcaccctgtctttgtctccaggggaaagagccacc60ctctcttgcagggccagtcagagtgttagcagcagctact標籤cctggtaccagcagaaa120cctggccaggctcccaggctcctcatctatggagcatccagcagggccactggcatccca180gacaggttcagtggcagtggatccgggacagacttcactctcaccatcagcagactggag240cctgaagattttgcagtgtattactgtcagcagcatggcagcagcagcacgttcggccag300gggaccaaagtggaaatcaaacgtacg327218366dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"218caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttctctgctggtcgtctgatggactattggggtcaaggcaccctcgtaacggtttcttct360gctagc366219345dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"219gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcactgcagacccca300ccaattacctttggtcaaggcaccaaggtcgaaattaaacgtacg345220357dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"220caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300tacaacgctttcgactattggggtcacggcaccctcgtaacggtttcttctgctagc357221339dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"221gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcatggcatagccca300acttttggtcaaggcaccaaggtcgaaattaaacgtacg339222357dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"222caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgct300acttacactatggactattggggtcaaggcaccctcgtaacggtttcttctgctagc357223342dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"223gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcactgcagacccca300attacttttggtcaaggcaccaaggtcgaaattaaacgtacg3422241344dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"224caggtgcagctgcagcagtctggcgccgagctcgtgaaacctggcgcctccgtgaagatc60agctgcaaggccagcggctacagcttcaccggctacttcatgaactgggtcaagcagagc120cacggcaagagcctggaatggatcggcagaatccacccctacgacggcgacaccttctac180aaccagaacttcaaggacaaggccaccctgaccgtggacaagagcagcaacaccgcccac240atggaactgctgagcctgaccagcgaggacttcgccgtgtactactgcaccagatacgac300ggcagccgggccatggattattggggccagggcaccaccgtgacagtgtccagcgctagc360accaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggcggcaca420gccgctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcctggaac480agcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttctggcctg540tatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacctacatc600tgcaacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagcccaagagc660tgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccgtca720gtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtc780acatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtg840gacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacg900taccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtac960aagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaagcc1020aaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctgacc1080aagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgccgtg1140gagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggac1200tccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcagcag1260gggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaag1320agcctctccctgtctccgggtaaa13442252073dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"225caggtgcagctgcagcagtctggcgccgagctcgtgaaacctggcgcctccgtgaagatc60agctgcaaggccagcggctacagcttcaccggctacttcatgaactgggtcaagcagagc120cacggcaagagcctggaatggatcggcagaatccacccctacgacggcgacaccttctac180aaccagaacttcaaggacaaggccaccctgaccgtggacaagagcagcaacaccgcccac240atggaactgctgagcctgaccagcgaggacttcgccgtgtactactgcaccagatacgac300ggcagccgggccatggattattggggccagggcaccaccgtgacagtgtccagcgctagc360acaaagggccccagcgtgttccctctggcccctagcagcaagagcacatctggcggaaca420gccgccctgggctgcctcgtgaaggactactttcccgagcctgtgaccgtgtcctggaac480tctggcgccctgacaagcggcgtgcacacctttccagccgtgctgcagagcagcggcctg540tactctctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacctacatc600tgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagcccaagagc660tgtgatggcggaggagggtccggaggcggaggatccgaagtgcagctggtggaaagcggc720ggaggcctggtgcagcctaagggctctctgaagctgagctgtgccgccagcggcttcacc780ttcaacacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaatgggtg840gcccggatcagaagcaagtacaacaattacgccacctactacgccgacagcgtgaaggac900cggttcaccatcagccgggacgacagccagagcatcctgtacctgcagatgaacaacctg960aaaaccgaggacaccgccatgtactactgcgtgcggcacggcaacttcggcaacagctat1020gtgtcttggtttgcctactggggccagggcaccctcgtgacagtgtctgctgctagcgtg1080gccgctccctccgtgtttatctttcccccatccgatgaacagctgaaaagcggcaccgcc1140tccgtcgtgtgtctgctgaacaatttttaccctagggaagctaaagtgcagtggaaagtg1200gataacgcactgcagtccggcaactcccaggaatctgtgacagaacaggactccaaggac1260agcacctactccctgtcctccaccctgacactgtctaaggctgattatgagaaacacaaa1320gtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaac1380aggggagagtgtgacaagacccacacctgtcccccttgtcctgcccctgaagctgctggc1440ggcccttctgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccggacc1500cccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaat1560tggtacgtggacggcgtggaagtgcacaacgccaagacaaagccgcgggaggagcagtac1620aacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggc1680aaggagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatc1740tccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggat1800gagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgac1860atcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctccc1920gtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcagg1980tggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactac2040acgcagaagagcctctccctgtctccgggtaaa2073226654dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"226gacatcgagctgacccagagccctgcctctctggccgtgtctctgggacagagagccatc60atcagctgcaaggccagccagagcgtgtcctttgccggcacctctctgatgcactggtat120caccagaagcccggccagcagcccaagctgctgatctacagagccagcaacctggaagcc180ggcgtgcccacaagattttccggcagcggcagcaagaccgacttcaccctgaacatccac240cccgtggaagaagaggacgccgccacctactactgccagcagagcagagagtacccctac300accttcggcggaggcaccaagctggaaatcaagcgtacggtggctgcaccatctgtcttc360atcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctg420aataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcg480ggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagc540agcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtc600acccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt654227209prt人(homosapiens)227argilealatrpalaargthrgluleuleuasnvalcysmetasnala151015lyshishislysglulysproglyprogluasplysleuhisglugln202530cysargprotrparglysasnalacyscysserthrasnthrsergln354045glualahislysaspvalsertyrleutyrargpheasntrpasnhis505560cysglyglumetalaproalacyslysarghispheileglnaspthr65707580cysleutyrglucysserproasnleuglyprotrpileglnglnval859095aspglnsertrparglysgluargvalleuasnvalproleucyslys100105110gluaspcysgluglntrptrpgluaspcysargthrsertyrthrcys115120125lysserasntrphislysglytrpasntrpthrserglypheasnlys130135140cysalavalglyalaalacysglnprophehisphetyrpheprothr145150155160prothrvalleucysasngluiletrpthrhissertyrlysvalser165170175asntyrserargglyserglyargcysileglnmettrppheasppro180185190alaglnglyasnproasnglugluvalalaargphetyralaalaala195200205met228214prt人(homosapiens)228thrmetcysseralaglnaspargthraspleuleuasnvalcysmet151015aspalalyshishislysthrlysproglyprogluasplysleuhis202530aspglncysserprotrplyslysasnalacyscysthralaserthr354045serglngluleuhislysaspthrserargleutyrasnpheasntrp505560asphiscysglylysmetgluproalacyslysarghispheilegln65707580aspthrcysleutyrglucysserproasnleuglyprotrpilegln859095glnvalasnglnsertrparglysgluargpheleuaspvalproleu100105110cyslysgluaspcysglnargtrptrpgluaspcyshisthrserhis115120125thrcyslysserasntrphisargglytrpasptrpthrserglyval130135140asnlyscysproalaglyalaleucysargthrpheglusertyrphe145150155160prothrproalaalaleucysgluglyleutrpserhissertyrlys165170175valserasntyrserargglyserglyargcysileglnmettrpphe180185190aspseralaglnglyasnproasnglugluvalalaargphetyrala195200205alaalamethisvalasn210229220prt人(homosapiens)229seralaargalaargthraspleuleuasnvalcysmetasnalalys151015hishislysthrglnproserprogluaspgluleutyrglyglncys202530serprotrplyslysasnalacyscysthralaserthrserglnglu354045leuhislysaspthrserargleutyrasnpheasntrpasphiscys505560glylysmetgluprothrcyslysarghispheileglnaspsercys65707580leutyrglucysserproasnleuglyprotrpileargglnvalasn859095glnsertrparglysgluargileleuasnvalproleucyslysglu100105110aspcysgluargtrptrpgluaspcysargthrsertyrthrcyslys115120125serasntrphislysglytrpasntrpthrserglyileasnglucys130135140proalaglyalaleucysserthrpheglusertyrpheprothrpro145150155160alaalaleucysgluglyleutrpserhisserphelysvalserasn165170175tyrserargglyserglyargcysileglnmettrppheaspserala180185190glnglyasnproasnglugluvalalalysphetyralaalaalamet195200205asnalaglyalaproserargglyileileaspser210215220230208prt小鼠(musmusculus)230thrargalaargthrgluleuleuasnvalcysmetaspalalyshis151015hislysglulysproglyprogluaspasnleuhisaspglncysser202530protrplysthrasnsercyscysserthrasnthrserglngluala354045hislysaspilesertyrleutyrargpheasntrpasnhiscysgly505560thrmetthrserglucyslysarghispheileglnaspthrcysleu65707580tyrglucysserproasnleuglyprotrpileglnglnvalaspgln859095sertrparglysgluargileleuaspvalproleucyslysgluasp100105110cysglnglntrptrpgluaspcysglnserserphethrcyslysser115120125asntrphislysglytrpasntrpserserglyhisasnglucyspro130135140valglyalasercyshisprophethrphetyrpheprothrserala145150155160alaleucysglugluiletrpserhissertyrlysleuserasntyr165170175serargglyserglyargcysileglnmettrppheaspproalagln180185190glyasnproasnglugluvalalaargphetyralaglualametser195200205231213prt食蟹猴(macacafascicularis)231glualaglnthrargthralaargalaargthrgluleuleuasnval151015cysmetasnalalyshishislysglulysproglyprogluasplys202530leuhisgluglncysargprotrplyslysasnalacyscysserthr354045asnthrserglnglualahislysaspvalsertyrleutyrargphe505560asntrpasnhiscysglyglumetalaproalacyslysarghisphe65707580ileglnaspthrcysleutyrglucysserproasnleuglyprotrp859095ileglnglnvalaspglnsertrparglysgluargvalleuasnval100105110proleucyslysgluaspcysgluargtrptrpgluaspcysargthr115120125sertyrcyslysserasntrphislysglytrpasntrpthrsergly130135140pheasnlyscysprovalglyalaalacysglnprophehisphetyr145150155160pheprothrprothrvalleucysasngluiletrpthrtyrsertyr165170175lysvalserasntyrserargglyserglyargcysileglnmettrp180185190pheaspproalaglnglyasnproasnglugluvalalaargphetyr195200205alaalaalametser2102329prt人工序列來源/註解="人工序列的描述:合成的肽"232protrpglutyrsertrptyrasptyr1523311prt人工序列來源/註解="人工序列的描述:合成的肽"233asntyrthrilevalvalserpropheasptyr151023411prt人工序列來源/註解="人工序列的描述:合成的肽"234asntyrpheileglyservalalametasptyr15102358prt人工序列來源/註解="人工序列的描述:合成的肽"235glyleuthrtyrsermetasptyr152369prt人工序列來源/註解="人工序列的描述:合成的肽"236metglnalaleuglnileproasnthr152377prt人工序列來源/註解="人工序列的描述:合成的肽"237tyralatyralaleuasptyr152388prt人工序列來源/註解="人工序列的描述:合成的肽"238glnglnhisglyserserserthr1523911prt人工序列來源/註解="人工序列的描述:合成的肽"239glyasppheseralaglyargleumetasptyr151024010prt人工序列來源/註解="人工序列的描述:合成的肽"240metglnalaleuglnthrproproilethr15102418prt人工序列來源/註解="人工序列的描述:合成的肽"241glyasptyrasnalapheasptyr152428prt人工序列來源/註解="人工序列的描述:合成的肽"242metglnalatrphisserprothr152438prt人工序列來源/註解="人工序列的描述:合成的肽"243glyalathrtyrthrmetasptyr152449prt人工序列來源/註解="人工序列的描述:合成的肽"244metglnalaleuglnthrproilethr15245227prt人工序列來源/註解="人工序列的描述:合成的多肽"245asplysthrhisthrcysproprocysproalaprogluleuleugly151015glyproservalpheleupheproprolysprolysaspthrleumet202530ileserargthrprogluvalthrcysvalvalvalaspvalserhis354045gluaspprogluvallyspheasntrptyrvalaspglyvalgluval505560hisasnalalysthrlysproargglugluglntyrasnserthrtyr65707580argvalvalservalleuthrvalleuhisglnasptrpleuasngly859095lysglutyrlyscyslysvalserasnlysalaleuproalaproile100105110glulysthrileserlysalalysglyglnproarggluproglnval115120125tyrthrleuproproserargaspgluleuthrlysasnglnvalser130135140leuthrcysleuvallysglyphetyrproseraspilealavalglu145150155160trpgluserasnglyglnprogluasnasntyrlysthrthrpropro165170175valleuaspseraspglyserphepheleutyrserlysleuthrval180185190asplysserargtrpglnglnglyasnvalphesercysservalmet195200205hisglualaleuhisasnhistyrthrglnlysserleuserleuser210215220proglylys2252462076dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"246caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccatgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgctctttc300ttcactggtttccatctggactattggggtcaaggcaccctcgtaacggtttcttctgct360agcacaaagggccccagcgtgttccctctggcccctagcagcaagagcacatctggcgga420acagccgccctgggctgcctcgtgaaggactactttcccgagcctgtgaccgtgtcctgg480aactctggcgccctgacaagcggcgtgcacacctttccagccgtgctgcagagcagcggc540ctgtactctctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacctac600atctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagcccaag660agctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaatct720ggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggcttc780accttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaatgg840gtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtgaag900ggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaacagc960ctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaacagc1020tatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgctagt1080gtggccgctccctccgtgtttatctttcccccatccgatgaacagctgaaaagcggcacc1140gcctccgtcgtgtgtctgctgaacaatttttaccctagggaagctaaagtgcagtggaaa1200gtggataacgcactgcagtccggcaactcccaggaatctgtgacagaacaggactccaag1260gacagcacctactccctgtcctccaccctgacactgtctaaggctgattatgagaaacac1320aaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttc1380aacaggggagagtgtgacaagacccacacctgtcccccttgtcctgcccctgaagctgct1440ggcggcccttctgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccgg1500acccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttc1560aattggtacgtggacggcgtggaagtgcacaacgccaagacaaagccgcgggaggagcag1620tacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaat1680ggcaaggagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaacc1740atctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgg1800gatgagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagc1860gacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcct1920cccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagc1980aggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccac2040tacacgcagaagagcctctccctgtctccgggtaaa20762471347dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"247caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccatgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgctctttc300ttcactggtttccatctggactattggggtcaaggcaccctcgtaacggtttcttctgct360agcaccaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggcggc420acagccgctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcctgg480aacagcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttctggc540ctgtatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacctac600atctgcaacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagcccaag660agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg720tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag780gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac840gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc900acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag960tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1020gccaaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctg1080accaagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgcc1140gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1200gactccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcag1260caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag1320aagagcctctccctgtctccgggtaaa1347248120prt人工序列來源/註解="人工序列的描述:合成的多肽"248gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthrgluglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserser115120249120prt人工序列來源/註解="人工序列的描述:合成的多肽"249gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthrglnglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserser115120250125prt人工序列來源/註解="人工序列的描述:合成的多肽"250gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyalasertyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserser115120125251125prt人工序列來源/註解="人工序列的描述:合成的多肽"251gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheserthrtyr202530alametasntrpvalargglnalaproglylysglyleuglutrpval354045serargileargserlystyrasnasntyralathrtyrtyralaasp505560servallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleuargalagluaspthralavaltyr859095tyrcysvalarghisglyasnpheglyasnalatyrvalsertrpphe100105110alatyrtrpglyglnglythrleuvalthrvalserser115120125252689prt人工序列來源/註解="人工序列的描述:合成的多肽"252gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220glyglyglyglyserglyglyglyglysergluvalglnleuleuglu225230235240serglyglyglyleuvalglnproglyglyserleuargleusercys245250255alaalaserglyphethrpheserthrtyralametasntrpvalarg260265270glnalaproglylysglyleuglutrpvalserargileargserlys275280285tyrasnasntyralathrtyrtyralaaspservallysglyargphe290295300thrileserargaspaspserlysasnthrleutyrleuglnmetasn305310315320serleuargalagluaspthralavaltyrtyrcysvalarghisgly325330335asnpheglyalasertyrvalsertrpphealatyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys253450prt人工序列來源/註解="人工序列的描述:合成的多肽"253gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220lysthrhisthrcysproprocysproalaproglualaalaglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserhisglu260265270aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglntyrasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysalaleuglyalaproileglu325330335lysthrileserlysalalysglyglnproarggluproglnvalcys340345350thrleuproproserargaspgluleuthrlysasnglnvalserleu355360365sercysalavallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleuvalserlysleuthrvalasp405410415lysserargtrpglnglnglyasnvalphesercysservalmethis420425430glualaleuhisasnargphethrglnlysserleuserleuserpro435440445glylys450254215prt人工序列來源/註解="人工序列的描述:合成的多肽"254glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleuglyglnpro100105110lysalaalaproservalthrleupheproproserserglugluleu115120125glnalaasnlysalathrleuvalcysleuileseraspphetyrpro130135140glyalavalthrvalalatrplysalaaspserserprovallysala145150155160glyvalgluthrthrthrproserlysglnserasnasnlystyrala165170175alasersertyrleuserleuthrprogluglntrplysserhisarg180185190sertyrsercysglnvalthrhisgluglyserthrvalglulysthr195200205valalaprothrglucysser210215255689prt人工序列來源/註解="人工序列的描述:合成的多肽"255gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthraspglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotrpglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220glyglyglyglyserglyglyglyglysergluvalglnleuleuglu225230235240serglyglyglyleuvalglnproglyglyserleuargleusercys245250255alaalaserglyphethrpheserthrtyralametasntrpvalarg260265270glnalaproglylysglyleuglutrpvalserargileargserlys275280285tyrasnasntyralathrtyrtyralaaspservallysglyargphe290295300thrileserargaspaspserlysasnthrleutyrleuglnmetasn305310315320serleuargalagluaspthralavaltyrtyrcysvalarghisgly325330335asnpheglyasnalatyrvalsertrpphealatyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys256690prt人工序列來源/註解="人工序列的描述:合成的多肽"256glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyprothrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyaspphealatrpleuasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysaspglyglygly210215220glyserglyglyglyglysergluvalglnleuleugluserglygly225230235240glyleuvalglnproglyglyserleuargleusercysalaalaser245250255glyphethrpheserthrtyralametasntrpvalargglnalapro260265270glylysglyleuglutrpvalserargileargserlystyrasnasn275280285tyralathrtyrtyralaaspservallysglyargphethrileser290295300argaspaspserlysasnthrleutyrleuglnmetasnserleuarg305310315320alagluaspthralavaltyrtyrcysvalarghisglyasnphegly325330335alasertyrvalsertrpphealatyrtrpglyglnglythrleuval340345350thrvalserseralaservalalaalaproservalpheilephepro355360365proseraspgluglnleulysserglythralaservalvalcysleu370375380leuasnasnphetyrproargglualalysvalglntrplysvalasp385390395400asnalaleuglnserglyasnserglngluservalthrgluglnasp405410415serlysaspserthrtyrserleuserserthrleuthrleuserlys420425430alaasptyrglulyshislysvaltyralacysgluvalthrhisgln435440445glyleuserserprovalthrlysserpheasnargglyglucysasp450455460lysthrhisthrcysproprocysproalaproglualaalaglygly465470475480proservalpheleupheproprolysprolysaspthrleumetile485490495serargthrprogluvalthrcysvalvalvalaspvalserhisglu500505510aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis515520525asnalalysthrlysproargglugluglntyrasnserthrtyrarg530535540valvalservalleuthrvalleuhisglnasptrpleuasnglylys545550555560glutyrlyscyslysvalserasnlysalaleuglyalaproileglu565570575lysthrileserlysalalysglyglnproarggluproglnvaltyr580585590thrleuproprocysargaspgluleuthrlysasnglnvalserleu595600605trpcysleuvallysglyphetyrproseraspilealavalglutrp610615620gluserasnglyglnprogluasnasntyrlysthrthrproproval625630635640leuaspseraspglyserphepheleutyrserlysleuthrvalasp645650655lysserargtrpglnglnglyasnvalphesercysservalmethis660665670glualaleuhisasnhistyrthrglnlysserleuserleuserpro675680685glylys690257447prt人工序列來源/註解="人工序列的描述:合成的多肽"257glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyprothrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyaspphealatrpleuasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysasplysthrhis210215220thrcysproprocysproalaproglualaalaglyglyproserval225230235240pheleupheproprolysprolysaspthrleumetileserargthr245250255progluvalthrcysvalvalvalaspvalserhisgluaspproglu260265270vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys275280285thrlysproargglugluglntyrasnserthrtyrargvalvalser290295300valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys305310315320cyslysvalserasnlysalaleuglyalaproileglulysthrile325330335serlysalalysglyglnproarggluproglnvalcysthrleupro340345350proserargaspgluleuthrlysasnglnvalserleusercysala355360365vallysglyphetyrproseraspilealavalglutrpgluserasn370375380glyglnprogluasnasntyrlysthrthrproprovalleuaspser385390395400aspglyserphepheleuvalserlysleuthrvalasplysserarg405410415trpglnglnglyasnvalphesercysservalmethisglualaleu420425430hisasnhistyrthrglnlysserleuserleuserproglylys435440445258219prt人工序列來源/註解="人工序列的描述:合成的多肽"258aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095serilemetglnargthrpheglyglnglythrlysvalgluilelys100105110argthrvalalaalaproservalpheilepheproproseraspglu115120125glnleulysserglythralaservalvalcysleuleuasnasnphe130135140tyrproargglualalysvalglntrplysvalaspasnalaleugln145150155160serglyasnserglngluservalthrgluglnaspserlysaspser165170175thrtyrserleuserserthrleuthrleuserlysalaasptyrglu180185190lyshislysvaltyralacysgluvalthrhisglnglyleuserser195200205provalthrlysserpheasnargglyglucys210215259214prt人工序列來源/註解="人工序列的描述:合成的多肽"259glnalavalvalthrglngluproserleuthrvalserproglygly151015thrvalthrleuthrcysglyserserthrglyalavalthrthrser202530asntyralaasntrpvalglnglulysproglyglnalaphearggly354045leuileglyglythrasnlysargalaproglythrproalaargphe505560serglyserleuleuglyglylysalaalaleuthrleuserglyala65707580glnprogluaspglualaglutyrtyrcysalaleutrptyrserasn859095leutrpvalpheglyglyglythrlysleuthrvalleuserserala100105110serthrlysglyproservalpheproleualaproserserlysser115120125thrserglyglythralaalaleuglycysleuvallysasptyrphe130135140progluprovalthrvalsertrpasnserglyalaleuthrsergly145150155160valhisthrpheproalavalleuglnserserglyleutyrserleu165170175serservalvalthrvalproserserserleuglythrglnthrtyr180185190ilecysasnvalasnhislysproserasnthrlysvalasplyslys195200205valgluprolyssercys210260690prt人工序列來源/註解="人工序列的描述:合成的多肽"260glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyprothrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyaspphealatrpleuasptyrtrpglyglnglythrleu100105110valthrvalserseralaserthrlysglyproservalpheproleu115120125alaproserserlysserthrserglyglythralaalaleuglycys130135140leuvallysasptyrpheprogluprovalthrvalsertrpasnser145150155160glyalaleuthrserglyvalhisthrpheproalavalleuglnser165170175serglyleutyrserleuserservalvalthrvalproserserser180185190leuglythrglnthrtyrilecysasnvalasnhislysproserasn195200205thrlysvalasplyslysvalgluprolyssercysaspglyglygly210215220glyserglyglyglyglysergluvalglnleuleugluserglygly225230235240glyleuvalglnproglyglyserleuargleusercysalaalaser245250255glyphethrpheserthrtyralametasntrpvalargglnalapro260265270glylysglyleuglutrpvalserargileargserlystyrasnasn275280285tyralathrtyrtyralaaspservallysglyargphethrileser290295300argaspaspserlysasnthrleutyrleuglnmetasnserleuarg305310315320alagluaspthralavaltyrtyrcysvalarghisglyasnphegly325330335asnalatyrvalsertrpphealatyrtrpglyglnglythrleuval340345350thrvalserseralaservalalaalaproservalpheilephepro355360365proseraspgluglnleulysserglythralaservalvalcysleu370375380leuasnasnphetyrproargglualalysvalglntrplysvalasp385390395400asnalaleuglnserglyasnserglngluservalthrgluglnasp405410415serlysaspserthrtyrserleuserserthrleuthrleuserlys420425430alaasptyrglulyshislysvaltyralacysgluvalthrhisgln435440445glyleuserserprovalthrlysserpheasnargglyglucysasp450455460lysthrhisthrcysproprocysproalaproglualaalaglygly465470475480proservalpheleupheproprolysprolysaspthrleumetile485490495serargthrprogluvalthrcysvalvalvalaspvalserhisglu500505510aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis515520525asnalalysthrlysproargglugluglntyrasnserthrtyrarg530535540valvalservalleuthrvalleuhisglnasptrpleuasnglylys545550555560glutyrlyscyslysvalserasnlysalaleuglyalaproileglu565570575lysthrileserlysalalysglyglnproarggluproglnvaltyr580585590thrleuproprocysargaspgluleuthrlysasnglnvalserleu595600605trpcysleuvallysglyphetyrproseraspilealavalglutrp610615620gluserasnglyglnprogluasnasntyrlysthrthrproproval625630635640leuaspseraspglyserphepheleutyrserlysleuthrvalasp645650655lysserargtrpglnglnglyasnvalphesercysservalmethis660665670glualaleuhisasnhistyrthrglnlysserleuserleuserpro675680685glylys690261360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"261gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgagggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360262360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"262gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactcagggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360263375dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"263gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcgccagctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcaagc375264375dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"264gaggtgcagctgctggaatctggcggcggactggtgcagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcacctacgccatgaactgggtgcgccaggcc120cctggcaaaggcctggaatgggtgtcccggatcagaagcaagtacaacaactacgccacc180tactacgccgacagcgtgaagggccggttcaccatcagccgggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactattgtgtgcgg300cacggcaacttcggcaacgcctatgtgtcttggtttgcctactggggccagggcaccctc360gtgaccgtgtcaagc3752652067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"265gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcacaaagggccctagcgtgttccctctggcccccagcagcaagagcacaagcggc420ggaacagccgccctgggctgcctcgtgaaggactacttccccgagcccgtgacagtgtct480tggaacagcggagccctgacaagcggcgtgcacactttccctgccgtgctgcagagcagc540ggcctgtactccctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagccc660aagagctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaa720tctggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggc780ttcaccttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaa840tgggtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtg900aagggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaac960agcctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcgcc1020agctatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20672661350dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"266gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcaccaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggc420ggcacagccgctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcc480tggaacagcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttct540ggcctgtatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagccc660aagagctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcaggggga720ccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccct780gaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactgg840tacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaac900agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag960gagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctcc1020aaagccaaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgag1080ctgaccaagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatc1140gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg1200ctggactccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtgg1260cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccgcttcacg1320cagaagagcctctccctgtctccgggtaaa1350267645dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"267caggccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcaggaa120aagcccggccaggccttcagaggactgatcggcggcaccaacaagagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgcc240cagccagaagatgaggccgagtactactgcgccctgtggtacagcaacctgtgggtgttc300ggcggaggcaccaagctgacagtcctaggtcaacccaaggctgcccccagcgtgaccctg360ttcccccccagcagcgaggaactgcaggccaacaaggccaccctggtctgcctgatcagc420gacttctacccaggcgccgtgaccgtggcctggaaggccgacagcagccccgtgaaggcc480ggcgtggagaccaccacccccagcaagcagagcaacaacaagtacgccgccagcagctac540ctgagcctgacccccgagcagtggaagagccacaggtcctacagctgccaggtgacccac600gagggcagcaccgtggagaaaaccgtggcccccaccgagtgcagc6452682067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"268gaggtgcaattggttgaatctggtggtggtctggtaaaaccgggcggttccctgcgtctg60agctgcgcggcttccggattcaccttctccaacgcgtggatgagctgggttcgccaggcc120ccgggcaaaggcctcgagtgggttggtcgtatcaagtctaaaactgacggtggcaccacg180gattacgcggctccagttaaaggtcgttttaccatttcccgcgacgatagcaaaaacact240ctgtatctgcagatgaactctctgaaaactgaagacaccgcagtctactactgtactacc300ccgtgggaatggtcttggtacgattattggggccagggcacgctggttacggtgtcttcc360gctagcacaaagggccctagcgtgttccctctggcccccagcagcaagagcacaagcggc420ggaacagccgccctgggctgcctcgtgaaggactacttccccgagcccgtgacagtgtct480tggaacagcggagccctgacaagcggcgtgcacactttccctgccgtgctgcagagcagc540ggcctgtactccctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagccc660aagagctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaa720tctggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggc780ttcaccttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaa840tgggtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtg900aagggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaac960agcctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaac1020gcctatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20672692070dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"269caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggccctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttcgcttggctggactattggggtcaaggcaccctcgtaacggtttcttctgctagcaca360aagggccccagcgtgttccctctggcccctagcagcaagagcacatctggcggaacagcc420gccctgggctgcctcgtgaaggactactttcccgagcctgtgaccgtgtcctggaactct480ggcgccctgacaagcggcgtgcacacctttccagccgtgctgcagagcagcggcctgtac540tctctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacctacatctgc600aacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagcccaagagctgt660gatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaatctggcggc720ggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggcttcaccttc780agcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaatgggtgtcc840cggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtgaagggccgg900ttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaacagcctgcgg960gccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcgccagctatgtg1020tcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgc標籤tgtggcc1080gctccctccgtgtttatctttcccccatccgatgaacagctgaaaagcggcaccgcctcc1140gtcgtgtgtctgctgaacaatttttaccctagggaagctaaagtgcagtggaaagtggat1200aacgcactgcagtccggcaactcccaggaatctgtgacagaacaggactccaaggacagc1260acctactccctgtcctccaccctgacactgtctaaggctgattatgagaaacacaaagtc1320tacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacagg1380ggagagtgtgacaagacccacacctgtcccccttgtcctgcccctgaagctgctggcggc1440ccttctgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccggaccccc1500gaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattgg1560tacgtggacggcgtggaagtgcacaacgccaagacaaagccgcgggaggagcagtacaac1620agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag1680gagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctcc1740aaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgag1800ctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatc1860gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg1920ctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtgg1980cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacg2040cagaagagcctctccctgtctccgggtaaa20702701341dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"270caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggccctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttcgcttggctggactattggggtcaaggcaccctcgtaacggtttcttctgctagcacc360aagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggcggcacagcc420gctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcctggaacagc480ggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttctggcctgtat540agcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacctacatctgc600aacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagcccaagagctgc660gacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccgtcagtc720ttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcaca780tgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggac840ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtac900cgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaag960tgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaagccaaa1020gggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctgaccaag1080aaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgccgtggag1140tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc1200gacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcagcagggg1260aacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagc1320ctctccctgtctccgggtaaa1341271657dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"271gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcaagcattatgcag300cggacttttggtcaaggcaccaaggtcgaaattaaacgtacggtggctgcaccatctgtc360ttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctg420ctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaa480tcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctc540agcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaa600gtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt657272642dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"272caggccgtcgtgacccaggaacccagcctgacagtgtctcctggcggcaccgtgaccctg60acatgtggcagttctacaggcgccgtgaccaccagcaactacgccaactgggtgcaggaa120aagcccggccaggccttcagaggactgatcggcggcaccaacaagagagcccctggcacc180cctgccagattcagcggatctctgctgggaggaaaggccgccctgacactgtctggcgcc240cagccagaagatgaggccgagtactactgcgccctgtggtacagcaacctgtgggtgttc300ggcggaggcaccaagctgacagtgctgagcagcgcttccaccaaaggcccttccgtgttt360cctctggctcctagctccaagtccacctctggaggcaccgctgctctcggatgcctcgtg420aaggattattttcctgagcctgtgacagtgtcctggaatagcggagcactgacctctgga480gtgcatactttccccgctgtgctgcagtcctctggactgtacagcctgagcagcgtggtg540acagtgcccagcagcagcctgggcacccagacctacatctgcaacgtgaaccacaagccc600agcaacaccaaggtggacaagaaggtggaacccaagtcttgt6422732070dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"273caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggccctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300ttcgcttggctggactattggggtcaaggcaccctcgtaacggtttcttctgctagcaca360aagggccccagcgtgttccctctggcccctagcagcaagagcacatctggcggaacagcc420gccctgggctgcctcgtgaaggactactttcccgagcctgtgaccgtgtcctggaactct480ggcgccctgacaagcggcgtgcacacctttccagccgtgctgcagagcagcggcctgtac540tctctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacctacatctgc600aacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagcccaagagctgt660gatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaatctggcggc720ggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggcttcaccttc780agcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaatgggtgtcc840cggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtgaagggccgg900ttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaacagcctgcgg960gccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaacgcctatgtg1020tcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgc標籤tgtggcc1080gctccctccgtgtttatctttcccccatccgatgaacagctgaaaagcggcaccgcctcc1140gtcgtgtgtctgctgaacaatttttaccctagggaagctaaagtgcagtggaaagtggat1200aacgcactgcagtccggcaactcccaggaatctgtgacagaacaggactccaaggacagc1260acctactccctgtcctccaccctgacactgtctaaggctgattatgagaaacacaaagtc1320tacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacagg1380ggagagtgtgacaagacccacacctgtcccccttgtcctgcccctgaagctgctggcggc1440ccttctgtgttcctgttccccccaaagcccaaggacaccctgatgatcagccggaccccc1500gaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaagttcaattgg1560tacgtggacggcgtggaagtgcacaacgccaagacaaagccgcgggaggagcagtacaac1620agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag1680gagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctcc1740aaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgag1800ctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatc1860gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg1920ctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtgg1980cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacg2040cagaagagcctctccctgtctccgggtaaa2070274440prt人工序列來源/註解="人工序列的描述:合成的多肽"274glnvalglnleuvalgluserglyglyglyvalvalglnproglyarg151015serleuargleuaspcyslysalaserglyilethrpheserasnser202530glymethistrpvalargglnalaproglylysglyleuglutrpval354045alavaliletrptyraspglyserlysargtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleuphe65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alathrasnaspasptyrtrpglyglnglythrleuvalthrvalser100105110seralaserthrlysglyproservalpheproleualaprocysser115120125argserthrsergluserthralaalaleuglycysleuvallysasp130135140tyrpheprogluprovalthrvalsertrpasnserglyalaleuthr145150155160serglyvalhisthrpheproalavalleuglnserserglyleutyr165170175serleuserservalvalthrvalproserserserleuglythrlys180185190thrtyrthrcysasnvalasphislysproserasnthrlysvalasp195200205lysargvalgluserlystyrglyproprocysproprocysproala210215220proglupheleuglyglyproservalpheleupheproprolyspro225230235240lysaspthrleumetileserargthrprogluvalthrcysvalval245250255valaspvalserglngluaspprogluvalglnpheasntrptyrval260265270aspglyvalgluvalhisasnalalysthrlysproarggluglugln275280285pheasnserthrtyrargvalvalservalleuthrvalleuhisgln290295300asptrpleuasnglylysglutyrlyscyslysvalserasnlysgly305310315320leuproserserileglulysthrileserlysalalysglyglnpro325330335arggluproglnvaltyrthrleuproproserglngluglumetthr340345350lysasnglnvalserleuthrcysleuvallysglyphetyrproser355360365aspilealavalglutrpgluserasnglyglnprogluasnasntyr370375380lysthrthrproprovalleuaspseraspglyserphepheleutyr385390395400serargleuthrvalasplysserargtrpglngluglyasnvalphe405410415sercysservalmethisglualaleuhisasnhistyrthrglnlys420425430serleuserleuserleuglylys435440275214prt人工序列來源/註解="人工序列的描述:合成的多肽"275gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalsersertyr202530leualatrptyrglnglnlysproglyglnalaproargleuleuile354045tyraspalaserasnargalathrglyileproalaargphesergly505560serglyserglythraspphethrleuthrileserserleuglupro65707580gluaspphealavaltyrtyrcysglnglnserserasntrpproarg859095thrpheglyglnglythrlysvalgluilelysargthrvalalaala100105110proservalpheilepheproproseraspgluglnleulyssergly115120125thralaservalvalcysleuleuasnasnphetyrproarggluala130135140lysvalglntrplysvalaspasnalaleuglnserglyasnsergln145150155160gluservalthrgluglnaspserlysaspserthrtyrserleuser165170175serthrleuthrleuserlysalaasptyrglulyshislysvaltyr180185190alacysgluvalthrhisglnglyleuserserprovalthrlysser195200205pheasnargglyglucys210276447prt人工序列來源/註解="人工序列的描述:合成的多肽"276glnvalglnleuvalglnserglyvalgluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrasntyr202530tyrmettyrtrpvalargglnalaproglyglnglyleuglutrpmet354045glyglyileasnproserasnglyglythrasnpheasnglulysphe505560lysasnargvalthrleuthrthraspserserthrthrthralatyr65707580metgluleulysserleuglnpheaspaspthralavaltyrtyrcys859095alaargargasptyrargpheaspmetglypheasptyrtrpglygln100105110glythrthrvalthrvalserseralaserthrlysglyproserval115120125pheproleualaprocysserargserthrsergluserthralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrlysthrtyrthrcysasnvalasphislys195200205proserasnthrlysvalasplysargvalgluserlystyrglypro210215220procysproprocysproalaproglupheleuglyglyproserval225230235240pheleupheproprolysprolysaspthrleumetileserargthr245250255progluvalthrcysvalvalvalaspvalserglngluaspproglu260265270valglnpheasntrptyrvalaspglyvalgluvalhisasnalalys275280285thrlysproargglugluglnpheasnserthrtyrargvalvalser290295300valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys305310315320cyslysvalserasnlysglyleuproserserileglulysthrile325330335serlysalalysglyglnproarggluproglnvaltyrthrleupro340345350proserglngluglumetthrlysasnglnvalserleuthrcysleu355360365vallysglyphetyrproseraspilealavalglutrpgluserasn370375380glyglnprogluasnasntyrlysthrthrproprovalleuaspser385390395400aspglyserphepheleutyrserargleuthrvalasplysserarg405410415trpglngluglyasnvalphesercysservalmethisglualaleu420425430hisasnhistyrthrglnlysserleuserleuserleuglylys435440445277218prt人工序列來源/註解="人工序列的描述:合成的多肽"277gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalaserlysglyvalserthrser202530glytyrsertyrleuhistrptyrglnglnlysproglyglnalapro354045argleuleuiletyrleualasertyrleugluserglyvalproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnhisserarg859095aspleuproleuthrpheglyglyglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215278447prt人工序列來源/註解="人工序列的描述:合成的多肽"278gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheseraspser202530trpilehistrpvalargglnalaproglylysglyleuglutrpval354045alatrpileserprotyrglyglyserthrtyrtyralaaspserval505560lysglyargphethrileseralaaspthrserlysasnthralatyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargarghistrpproglyglypheasptyrtrpglyglnglythr100105110leuvalthrvalserseralaserthrlysglyproservalphepro115120125leualaproserserlysserthrserglyglythralaalaleugly130135140cysleuvallysasptyrpheprogluprovalthrvalsertrpasn145150155160serglyalaleuthrserglyvalhisthrpheproalavalleugln165170175serserglyleutyrserleuserservalvalthrvalproserser180185190serleuglythrglnthrtyrilecysasnvalasnhislysproser195200205asnthrlysvalasplyslysvalgluprolyssercysasplysthr210215220histhrcysproprocysproalaprogluleuleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserhisgluasppro260265270gluvallyspheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglntyralaserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysalaleuproalaproileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserarggluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserlysleuthrvalasplysser405410415argtrpglnglnglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserprogly435440445279214prt人工序列來源/註解="人工序列的描述:合成的多肽"279aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnaspvalserthrala202530valalatrptyrglnglnlysproglylysalaprolysleuleuile354045tyrseralaserpheleutyrserglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglntyrleutyrhisproala859095thrpheglyglnglythrlysvalgluilelysargthrvalalaala100105110proservalpheilepheproproseraspgluglnleulyssergly115120125thralaservalvalcysleuleuasnasnphetyrproarggluala130135140lysvalglntrplysvalaspasnalaleuglnserglyasnsergln145150155160gluservalthrgluglnaspserlysaspserthrtyrserleuser165170175serthrleuthrleuserlysalaasptyrglulyshislysvaltyr180185190alacysgluvalthrhisglnglyleuserserprovalthrlysser195200205pheasnargglyglucys210280118prt人工序列來源/註解="人工序列的描述:合成的多肽"280gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheseraspser202530trpilehistrpvalargglnalaproglylysglyleuglutrpval354045alatrpileserprotyrglyglyserthrtyrtyralaaspserval505560lysglyargphethrileseralaaspthrserlysasnthralatyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargarghistrpproglyglypheasptyrtrpglyglnglythr100105110leuvalthrvalserser115281122prt人工序列來源/註解="人工序列的描述:合成的多肽"281gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheseraspser202530trpilehistrpvalargglnalaproglylysglyleuglutrpval354045alatrpileserprotyrglyglyserthrtyrtyralaaspserval505560lysglyargphethrileseralaaspthrserlysasnthralatyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargarghistrpproglyglypheasptyrtrpglyglnglythr100105110leuvalthrvalserseralaserthrlys115120282108prt人工序列來源/註解="人工序列的描述:合成的多肽"282aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnaspvalserthrala202530valalatrptyrglnglnlysproglylysalaprolysleuleuile354045tyrseralaserpheleutyrserglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglntyrleutyrhisproala859095thrpheglyglnglythrlysvalgluilelysarg10010528310prt人工序列來源/註解="人工序列的描述:合成的肽"變異(6)..(6)/替換="gly"混雜特徵(1)..(10)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"283glyphethrpheseraspsertrpilehis151028418prt人工序列來源/註解="人工序列的描述:合成的肽"變異(4)..(4)/替換="leu"變異(10)..(10)/替換="ser"混雜特徵(1)..(18)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"284alatrpileserprotyrglyglyserthrtyrtyralaaspserval151015lysgly2859prt人工序列來源/註解="人工序列的描述:合成的肽"285arghistrpproglyglypheasptyr1528611prt人工序列來源/註解="人工序列的描述:合成的肽"修飾的殘基(5)..(5)/替換="val"修飾的殘基(6)..(6)/替換="ile"修飾的殘基(7)..(7)/替換="asn"修飾的殘基(9)..(9)/替換="phe"修飾的殘基(10)..(10)/替換="leu"混雜特徵(1)..(11)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"286argalaserglnaspvalserthralavalala15102877prt人工序列來源/註解="人工序列的描述:合成的肽"修飾的殘基(4)..(4)/替換="thr"修飾的殘基(6)..(6)/替換="ala"混雜特徵(1)..(7)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"287seralaserpheleutyrser152889prt人工序列來源/註解="人工序列的描述:合成的肽"修飾的殘基(3)..(3)/替換="gly"或"phe"或"ser"修飾的殘基(4)..(4)/替換="tyr"或"phe"或"trp"修飾的殘基(5)..(5)/替換="asn"或"ala"或"thr"或"gly"或"phe"或"ile"修飾的殘基(6)..(6)/替換="val"或"pro"或"thr"或"ile"修飾的殘基(8)..(8)/替換="trp"或"arg"或"pro"或"thr"混雜特徵(1)..(9)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"288glnglntyrleutyrhisproalathr1528910prt人工序列來源/註解="人工序列的描述:合成的肽"289glyphethrpheseraspsertrpilehis151029018prt人工序列來源/註解="人工序列的描述:合成的肽"290alatrpileserprotyrglyglyserthrtyrtyralaaspserval151015lysgly2919prt人工序列來源/註解="人工序列的描述:合成的肽"291arghistrpproglyglypheasptyr1529211prt人工序列來源/註解="人工序列的描述:合成的肽"292argalaserglnaspvalserthralavalala15102937prt人工序列來源/註解="人工序列的描述:合成的肽"293seralaserpheleutyrser152949prt人工序列來源/註解="人工序列的描述:合成的肽"294glnglntyrleutyrhisproalathr1529525prt人工序列來源/註解="人工序列的描述:合成的肽"295gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaser202529613prt人工序列來源/註解="人工序列的描述:合成的肽"296trpvalargglnalaproglylysglyleuglutrpval151029732prt人工序列來源/註解="人工序列的描述:合成的多肽"297argphethrileseralaaspthrserlysasnthralatyrleugln151015metasnserleuargalagluaspthralavaltyrtyrcysalaarg20253029811prt人工序列來源/註解="人工序列的描述:合成的肽"298trpglyglnglythrleuvalthrvalserala151029911prt人工序列來源/註解="人工序列的描述:合成的肽"299trpglyglnglythrleuvalthrvalserser151030023prt人工序列來源/註解="人工序列的描述:合成的肽"300aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcys2030115prt人工序列來源/註解="人工序列的描述:合成的肽"301trptyrglnglnlysproglylysalaprolysleuleuiletyr15101530232prt人工序列來源/註解="人工序列的描述:合成的多肽"302glyvalproserargpheserglyserglyserglythraspphethr151015leuthrileserserleuglnprogluaspphealathrtyrtyrcys20253030311prt人工序列來源/註解="人工序列的描述:合成的肽"303pheglyglnglythrlysvalgluilelysarg15103049prt小鼠(musmusculus)304glypheserleuserthrserglymet153053prt小鼠(musmusculus)305leuasnasp13068prt小鼠(musmusculus)306asnglytyrleutyralaleuasp153076prt小鼠(musmusculus)307serserservalasntyr153083prt小鼠(musmusculus)308aspalaphe13097prt小鼠(musmusculus)309trpsersertyrprotrpthr15310120prt小鼠(musmusculus)310glnvalthrleulysgluserglyproglyileleuglnprosergln151015thrleuargleuthrcysserpheserglypheserleuserthrser202530glymetservalglytrpileargglnproserglylysglyleuglu354045trpleualahisiletrpleuasnaspaspvalphepheasnproala505560leulysserargleuthrileserlysaspthrserasnasnglnval65707580pheleuglnilealaservalvalthralaaspthralathrtyrtyr859095cysvalargalaasnglytyrleutyralaleuasptyrtrpglygln100105110glythrservalthrvalserser115120311106prt小鼠(musmusculus)311glnilevalleuthrglnserproalailemetseralaserprogly151015glnlysvalthrilethrcysseralaserserservalasntyrthr202530glntrptyrglnglnlysleuglyserserprolysleutrpiletyr354045aspalaphelysleualaproglyvalproalaargpheserglyser505560glythrglythrsertyrserleuthrilesersermetglualaglu65707580aspalaalasertyrphecyshisglntrpsersertyrprotrpthr859095pheglyglyglythrlysleugluilelys100105312120prt小鼠(musmusculus)312glnvalthrleulysgluserglyproglyileleuglnprosergln151015thrleuserleuthrcysserpheserglypheserleuserthrser202530glymetservalglytrpileargglnproserglylysglyleuglu354045trpleualahisiletrpleuasnaspaspvalphepheasnproala505560leulysargargleuthrileserlysaspthrserasnasnglnval65707580pheleuglnilealaservalvalthralaaspthralathrtyrtyr859095cysvalargalaasnglytyrleutyralaleuasptyrtrpglygln100105110glyileservalthrvalserser115120313106prt小鼠(musmusculus)313glnilevalleuthrglnserproalailemetseralaserprogly151015glnlysvalthrilethrcysseralaserserservalasntyrthr202530glntrptyrglnglnlysleuglyserserprolysleutrpiletyr354045aspalaphelysleualaproglyvalproalaargpheserglyser505560glythrglythrsertyrserleuthrilesersermetglualaglu65707580aspalaalasertyrphecyshisglntrpsersertyrprotrpthr859095pheglyglyglythrlysleugluilelys1001053146prt小鼠(musmusculus)314serserservalglntyr153156prt小鼠(musmusculus)315serserservalsertyr153167prt小鼠(musmusculus)316glytyrserphethrsertyr153173prt小鼠(musmusculus)317seraspser13189prt小鼠(musmusculus)318glytyrtyralatrptyrtyrpheasp153197prt小鼠(musmusculus)319serglnserileglyasnasn153203prt小鼠(musmusculus)320tyralaser13216prt小鼠(musmusculus)321serasnsertrpproleu15322120prt小鼠(musmusculus)322glnvalglnleuglnglnserglyproglnleuvalargproglyala151015servalglnilesercyslysalaserglytyrserphethrsertyr202530leuleuhistrpleulysglnargproglyglnglyleuglutrpile354045glymetileaspproseraspsergluthrargleuasnglnlysphe505560lysasplysalathrleuthrvalasplysserserserthralatyr65707580metglnleuserserprothrsergluaspseralavaltyrtyrcys859095alaargaspglytyrtyralatrptyrtyrpheaspcystrpglygln100105110glythrthrleuthrvalserser115120323107prt小鼠(musmusculus)323aspilevalleuthrglnserproalathrleuservalthrprogly151015aspargvalserleusercysargalaserglnserileglyasnasn202530leuhistrptyrglnglnlysserhisgluserproargleuleuile354045lystyralaserhisserileserglyileproserlysphesergly505560thrglyserglythraspphethrleuserpheasnservalgluthr65707580gluasppheglymettyrphecysglnglnserasnsertrpproleu859095thrpheglyalaglythrlysleugluleulys1001053245prt小鼠(musmusculus)324glyaspserileala153253prt小鼠(musmusculus)325tyrsergly13264prt小鼠(musmusculus)326asptyrpheasp13277prt小鼠(musmusculus)327argglnaspvalarglysasn153283prt小鼠(musmusculus)328tyrthrser13296prt小鼠(musmusculus)329tyraspasnleuprophe15330114prt小鼠(musmusculus)330gluvalglnleuglngluserglyproserleuvallysprosergln151015thrleuserleuthrcysservalthrglyaspserilealaserala202530tyrtrpasntrpilearglyspheproglyasnlysleuglutyrmet354045glytyrileasntyrserglyserthrtyrtyrasnproserleulys505560serargileserilethrargaspthrserglnasnglntyrtyrleu65707580glnleuasnservalthrthrgluaspthralathrtyrtyrcysval859095thrglyasptyrpheasptyrtrpglyargglythrthrleuthrval100105110serser331107prt小鼠(musmusculus)331aspileglnmetthrglnserproserserleuseralatyrleugly151015glylysvalthrilethrcyslysalaargglnaspvalarglysasn202530ileglytrptyrglnhislysproglylysglyproargleuleuile354045trptyrthrserthrleuglnserglyileproserargphesergly505560serglyserglyargasptyrserpheasnileasnasnleuglupro65707580gluaspilealathrtyrtyrcysleuglntyraspasnleuprophe859095thrpheglythrglythrlysleugluilearg1001053325prt小鼠(musmusculus)332glytyrthrphethr153333prt小鼠(musmusculus)333gluthrtyr13344prt小鼠(musmusculus)334glytyrproala133512prt小鼠(musmusculus)335serargthrileleuhisserserglyasnthrtyr15103363prt小鼠(musmusculus)336lysvalser13376prt小鼠(musmusculus)337aspserhisvalprophe15338115prt小鼠(musmusculus)338glnileglnleuvalglnserglyprogluleulyslysproglyglu151015thrvallysilesercyslysalaserglytyrthrphethrasptyr202530sermethistrpvallysglnalaproglyargglyleulystrpmet354045glytyrileasnthrgluthrtyrgluprothrpheglyalaaspphe505560lysglyargphealapheserleuaspthrseralathrthralatyr65707580leuglnileasnserleulysthrgluaspthralathrphephecys859095glyglyglyglytyrproalatyrtrpglyglnglythrvalvalile100105110valserala115339112prt小鼠(musmusculus)339aspvalleumetthrglnthrproleuserleuprovalserleugly151015aspglnalaserilesercysargserserargthrileleuhisser202530serglyasnthrtyrleuglutrptyrleuglnlysproglyglnser354045prolysleuleuiletyrlysvalserasnargpheserglyvalpro505560aspargpheserglyserglyserglythraspphethrleuasnile65707580serargvalglualagluaspleuglyvaltyrtyrcyspheglnasp859095serhisvalprophethrpheglythrglythrlysleugluilelys1001051103407prt小鼠(musmusculus)340glypheasnilelysthrthr153413prt小鼠(musmusculus)341alaaspasp13428prt小鼠(musmusculus)342pheglytyrvalalatrppheala153437prt小鼠(musmusculus)343serglnservalaspasntyr153443prt小鼠(musmusculus)344tyralaser13456prt小鼠(musmusculus)345histyrserserprotyr15346119prt小鼠(musmusculus)346gluvalglnleuglnglnservalalagluleuvalargproglyala151015servallysleusercysthralaserglypheasnilelysthrthr202530tyrmethistrpvallysglnargprogluglnglyleuglutrpile354045glyargileaspproalaaspaspasnthrlystyralaprolysphe505560glnglylysalathrilethralaaspthrserserasnthralatyr65707580leuglnleuserserleuthrsergluaspalaalailetyrtyrcys859095valargasppheglytyrvalalatrpphealatyrtrpglyglngly100105110thrleuvalthrpheserala115347107prt小鼠(musmusculus)347asnilevalmetthrprothrprolyspheleuprovalsersergly151015aspargvalthrmetthrcysargalaserglnservalaspasntyr202530valalatrptyrglnglnlysproglyglnserprolysleuleuile354045tyrtyralaserasnargtyrileglyvalproaspargphethrgly505560serglyserglythraspphethrphethrileserservalglnval65707580gluaspleualavaltyrphecysglnglnhistyrserserprotyr859095thrpheglyserglythrlysleugluilelys1001053487prt小鼠(musmusculus)348glytyrpropheserglutyr153493prt小鼠(musmusculus)349gluthrgly13504prt小鼠(musmusculus)350glytyrproala135112prt小鼠(musmusculus)351serargserilevalhisserserglyasnthrtyr15103523prt小鼠(musmusculus)352lysvalser13535prt小鼠(musmusculus)353aspserhisvalpro15354115prt小鼠(musmusculus)354glnileglnleuvalglnserglyprogluleulyslysproglyglu151015thrvallysilesercyslysalaserglytyrpropheserglutyr202530serilehistrpvallysglnalaproglylysglyleulystrpmet354045valtyrvalasnthrgluthrglyglnproilevalglyaspaspphe505560argglyargphevalleuserleugluthrseralaserthralatyr65707580leuglnileasnasnleulysasngluaspthralathrtyrphecys859095glyglyglyglytyrproalatyrtrpglyglnglythrleuvalthr100105110valserala115355112prt小鼠(musmusculus)355aspvalleumetthrglnthrproleuserleuprovalserleugly151015aspglnalaserilesercysargserserargserilevalhisser202530serglyasnthrtyrleuglutrptyrleuglnlysproglyglnser354045prolysleuleuiletyrlysvalserasnargpheserglyvalpro505560aspargpheserglyserglyserglythraspphethrleuasnile65707580serargvalglualagluaspleuglyvaltyrtyrcyspheglnasp859095serhisvalprophethrpheglythrglythrlysleugluilelys1001051103567prt小鼠(musmusculus)356glyphethrpheserserser153573prt小鼠(musmusculus)357alathrgly13588prt小鼠(musmusculus)358tyrprohistyrtyralametasp153597prt小鼠(musmusculus)359sergluasnilepheserasn153603prt小鼠(musmusculus)360seralathr13616prt小鼠(musmusculus)361phetyrlysileprophe15362121prt小鼠(musmusculus)362glnglyglnmethisglnserglyalagluleuvallysproglyser151015servallysleusercyslysthrserglyphethrpheserserser202530pheilesertrpleulysglnlysproglyglnserleuglutrpile354045alatrpiletyralaalathrglyserthrsertyrasnglnlysphe505560thrasnlysalaglnleuthrvalaspthrserserseralaalatyr65707580metglnpheserserleuthrthrgluaspseralailetyrtyrcys859095alaarghisalaglytyrprohistyrtyralametasptyrtrpgly100105110glnglythrservalthrvalserser115120363107prt小鼠(musmusculus)363aspileglnmetthrglnserproalaserleuseralaservalgly151015gluthrvalthrilethrcysargalasergluasnilepheserasn202530leualatrptyrglnglnlysglnglylysserproglnleuleuval354045tyrseralathrasnleuglyaspglyvalproserargphesergly505560serglyserglythrglnpheserleulysileasnserleuglnpro65707580gluasppheglyasntyrtyrcysglnhisphetyrlysileprophe859095thrpheglythrglythrlysleugluilelys1001053647prt小鼠(musmusculus)364glypheasnilelysasptyr153653prt小鼠(musmusculus)365gluaspgly13668prt小鼠(musmusculus)366hisglytyrvalglytrppheala153678prt小鼠(musmusculus)367alasergluasnvalaspthrtyr153683prt小鼠(musmusculus)368glyalaser13696prt小鼠(musmusculus)369sertyrsertyrprotrp15370119prt小鼠(musmusculus)370gluvalglnleuglnglnserglyalagluproleulysproglyala151015servallysleuthrcysthrthrserglypheasnilelysasptyr202530tyrilehistrpvallysglnargseraspglnglyleuglutrpile354045glyargileaspprogluaspglygluleuiletyralaprolysphe505560glnasplysalathrilethrvalaspthrserserasnilealatyr65707580leuglnleuasnserleuthrsergluaspthralavaltyrtyrcys859095serargasphisglytyrvalglytrpphealatyrtrpglyglngly100105110thrleuvalthrvalserala115371107prt小鼠(musmusculus)371asnvalvalmetthrglnserprolyssermetilemetservalgly151015glnargvalthrleuasncyslysalasergluasnvalaspthrtyr202530valsertrptyrglnglnlysprogluglnserprolysleuleuile354045tyrglyalaserasnargtyrthrglyvalproaspargphethrgly505560serargseralathraspphethrleuthrileserservalglnala65707580gluaspleualavaltyrtyrcysglyglnsertyrsertyrprotrp859095thrpheglyglyglythrlysleugluphearg100105372219prt人工序列來源/註解="人工序列的描述:合成的多肽"372prothrglyalaglupheleuglyaspglyglyaspvalserpheser151015thrargglythrglnasntrpthrvalgluargleuleuglnalahis202530alaglnleuglugluargglytyrvalphevalglytyrhisglythr354045pheleuglualaalaglnserilevalpheglyglyvalalaalaarg505560serglnaspleualaalailetrpalaglyphetyrilealaglyasp65707580proalaleualatyrglytyralaglnaspglngluproaspalaala859095glyargileargasnglyalaleuleuargvaltyrvalproalaser100105110serleuproglyphetyrargthrserleuthrleualaalaproglu115120125alaalaglygluvalgluargleuileglyhisproleuproleuala130135140leuaspalailethrglyprogluglugluglyglyargleugluthr145150155160ileleuglytrpproleualagluargthrvalvalileproserala165170175ileprothraspproargasnvalglyglyaspleuaspproserser180185190ileproasplysgluglnalaileseralaleuproasptyralaser195200205glnproglylysproproarggluaspleulys210215373219prt人工序列來源/註解="人工序列的描述:合成的多肽"373prothrglyalaglupheleuglyaspglyglyaspvalserpheser151015thrargglythrglnasntrpthrvalgluargleuleuglnalahis202530alaglnleuglugluargglytyrvalphevalglytyrhisglythr354045alaleuglualaalaglnserilevalpheglyglyvalargalaarg505560serglnaspleuargalailetrpargglyphetyrilealaglyasp65707580proalahisalatyrglytyralaglnaspglngluproaspalaarg859095glyargilealaasnglyalaleuleuargvaltyrvalproalaser100105110serleuproglyphetyrargthrserleuthrleualaalaproglu115120125alaalaglygluvalgluargleuileglyhisproleuproleuarg130135140leuaspalailethrglyprogluglugluglyglyargglugluthr145150155160ileleuglytrpproleualagluargthrvalvalileproserala165170175ileprothraspproargasnvalglyglyaspleuaspproserser180185190ileproasplysgluglnalaileseralaleuproasptyralaser195200205glnproglylysproproarggluaspleulys210215374107prt人(homosapiens)374argthrvalalaalaproservalpheilepheproproseraspglu151015glnleulysserglythralaservalvalcysleuleuasnasnphe202530tyrproargglualalysvalglntrplysvalaspasnalaleugln354045serglyasnserglngluservalthrgluglnaspserlysaspser505560thrtyrserleuserserthrleuthrleuserlysalaasptyrglu65707580lyshislysvaltyralacysgluvalthrhisglnglyleuserser859095provalthrlysserpheasnargglyglucys100105375105prt人(homosapiens)375glnprolysalaalaproservalthrleupheproproserserglu151015gluleuglnalaasnlysalathrleuvalcysleuileseraspphe202530tyrproglyalavalthrvalalatrplysalaaspserserproval354045lysalaglyvalgluthrthrthrproserlysglnserasnasnlys505560tyralaalasersertyrleuserleuthrprogluglntrplysser65707580hisargsertyrsercysglnvalthrhisgluglyserthrvalglu859095lysthrvalalaprothrglucysser100105376330prt人(homosapiens)376alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercysasplysthrhisthrcysproprocys100105110proalaprogluleuleuglyglyproservalpheleuphepropro115120125lysprolysaspthrleumetileserargthrprogluvalthrcys130135140valvalvalaspvalserhisgluaspprogluvallyspheasntrp145150155160tyrvalaspglyvalgluvalhisasnalalysthrlysproargglu165170175gluglntyrasnserthrtyrargvalvalservalleuthrvalleu180185190hisglnasptrpleuasnglylysglutyrlyscyslysvalserasn195200205lysalaleuproalaproileglulysthrileserlysalalysgly210215220glnproarggluproglnvaltyrthrleuproproserargaspglu225230235240leuthrlysasnglnvalserleuthrcysleuvallysglyphetyr245250255proseraspilealavalglutrpgluserasnglyglnprogluasn260265270asntyrlysthrthrproprovalleuaspseraspglyserphephe275280285leutyrserlysleuthrvalasplysserargtrpglnglnglyasn290295300valphesercysservalmethisglualaleuhisasnhistyrthr305310315320glnlysserleuserleuserproglylys325330377330prt人(homosapiens)377alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercysasplysthrhisthrcysproprocys100105110proalaproglualaalaglyglyproservalpheleuphepropro115120125lysprolysaspthrleumetileserargthrprogluvalthrcys130135140valvalvalaspvalserhisgluaspprogluvallyspheasntrp145150155160tyrvalaspglyvalgluvalhisasnalalysthrlysproargglu165170175gluglntyrasnserthrtyrargvalvalservalleuthrvalleu180185190hisglnasptrpleuasnglylysglutyrlyscyslysvalserasn195200205lysalaleuproalaproileglulysthrileserlysalalysgly210215220glnproarggluproglnvaltyrthrleuproproserargaspglu225230235240leuthrlysasnglnvalserleuthrcysleuvallysglyphetyr245250255proseraspilealavalglutrpgluserasnglyglnprogluasn260265270asntyrlysthrthrproprovalleuaspseraspglyserphephe275280285leutyrserlysleuthrvalasplysserargtrpglnglnglyasn290295300valphesercysservalmethisglualaleuhisasnhistyrthr305310315320glnlysserleuserleuserproglylys325330378330prt人(homosapiens)378alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercysasplysthrhisthrcysproprocys100105110proalaproglualaalaglyglyproservalpheleuphepropro115120125lysprolysaspthrleumetileserargthrprogluvalthrcys130135140valvalvalaspvalserhisgluaspprogluvallyspheasntrp145150155160tyrvalaspglyvalgluvalhisasnalalysthrlysproargglu165170175gluglntyrasnserthrtyrargvalvalservalleuthrvalleu180185190hisglnasptrpleuasnglylysglutyrlyscyslysvalserasn195200205lysalaleuglyalaproileglulysthrileserlysalalysgly210215220glnproarggluproglnvaltyrthrleuproproserargaspglu225230235240leuthrlysasnglnvalserleuthrcysleuvallysglyphetyr245250255proseraspilealavalglutrpgluserasnglyglnprogluasn260265270asntyrlysthrthrproprovalleuaspseraspglyserphephe275280285leutyrserlysleuthrvalasplysserargtrpglnglnglyasn290295300valphesercysservalmethisglualaleuhisasnhistyrthr305310315320glnlysserleuserleuserproglylys325330379327prt人(homosapiens)379alaserthrlysglyproservalpheproleualaprocysserarg151015serthrsergluserthralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrlysthr65707580tyrthrcysasnvalasphislysproserasnthrlysvalasplys859095argvalgluserlystyrglyproprocysprosercysproalapro100105110glupheleuglyglyproservalpheleupheproprolysprolys115120125aspthrleumetileserargthrprogluvalthrcysvalvalval130135140aspvalserglngluaspprogluvalglnpheasntrptyrvalasp145150155160glyvalgluvalhisasnalalysthrlysproargglugluglnphe165170175asnserthrtyrargvalvalservalleuthrvalleuhisglnasp180185190trpleuasnglylysglutyrlyscyslysvalserasnlysglyleu195200205proserserileglulysthrileserlysalalysglyglnproarg210215220gluproglnvaltyrthrleuproproserglngluglumetthrlys225230235240asnglnvalserleuthrcysleuvallysglyphetyrproserasp245250255ilealavalglutrpgluserasnglyglnprogluasnasntyrlys260265270thrthrproprovalleuaspseraspglyserphepheleutyrser275280285argleuthrvalasplysserargtrpglngluglyasnvalpheser290295300cysservalmethisglualaleuhisasnhistyrthrglnlysser305310315320leuserleuserleuglylys325380280prt人(homosapiens)380sergluvalglutyrargalagluvalglyglnasnalatyrleupro151015cysphetyrthrproalaalaproglyasnleuvalprovalcystrp202530glylysglyalacysprovalpheglucysglyasnvalvalleuarg354045thraspgluargaspvalasntyrtrpthrserargtyrtrpleuasn505560glyaspphearglysglyaspvalserleuthrilegluasnvalthr65707580leualaaspserglyiletyrcyscysargileglnileproglyile859095metasnaspglulyspheasnleulysleuvalilelysproalalys100105110valthrproalaprothrargglnargaspphethralaalaphepro115120125argmetleuthrthrargglyhisglyproalagluthrglnthrleu130135140glyserleuproaspileasnleuthrglnileserthrleualaasn145150155160gluleuargaspserargleualaasnaspleuargaspserglyala165170175thrileargileglyiletyrileglyalaglyilecysalaglyleu180185190alaleualaleuilepheglyalaleuilephelystrptyrserhis195200205serlysglulysileglnasnleuserleuileserleualaasnleu210215220proproserglyleualaasnalavalalagluglyileargserglu225230235240gluasniletyrthrileglugluasnvaltyrgluvalgluglupro245250255asnglutyrtyrcystyrvalserserargglnglnproserglnpro260265270leuglycysargphealametpro275280381181prt人(homosapiens)381sergluvalglutyrargalagluvalglyglnasnalatyrleupro151015cysphetyrthrproalaalaproglyasnleuvalprovalcystrp202530glylysglyalacysprovalpheglucysglyasnvalvalleuarg354045thraspgluargaspvalasntyrtrpthrserargtyrtrpleuasn505560glyaspphearglysglyaspvalserleuthrilegluasnvalthr65707580leualaaspserglyiletyrcyscysargileglnileproglyile859095metasnaspglulyspheasnleulysleuvalilelysproalalys100105110valthrproalaprothrargglnargaspphethralaalaphepro115120125argmetleuthrthrargglyhisglyproalagluthrglnthrleu130135140glyserleuproaspileasnleuthrglnileserthrleualaasn145150155160gluleuargaspserargleualaasnaspleuargaspserglyala165170175thrileargilegly180382118prt人工序列來源/註解="人工序列的描述:合成的多肽"382gluvalglnleuvalgluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrpheseraspser202530trpilehistrpvalargglnalaproglylysglyleuglutrpval354045alatrpileserprotyrglyglyserthrtyrtyralaaspserval505560lysglyargphethrileseralaaspthrserlysasnthralatyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargarghistrpproglyglypheasptyrtrpglyglnglythr100105110leuvalthrvalserala115383108prt人工序列來源/註解="人工序列的描述:合成的多肽"383aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnaspvalserthrala202530valalatrptyrglnglnlysproglylysalaprolysleuleuile354045tyrseralaserpheleutyrserglyvalproserargphesergly505560serglyserglythraspphethrleuthrileserserleuglnpro65707580gluaspphealathrtyrtyrcysglnglntyrleutyrhisproala859095thrpheglyglnglythrlysvalgluilelysarg10010538424prt人工序列來源/註解="人工序列的描述:合成的肽"變異(13)..(24)/替換=""混雜特徵(1)..(24)/註解="此序列可包含3-6個"glyglyglyser"重複單元"混雜特徵(1)..(24)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"384glyglyglyserglyglyglyserglyglyglyserglyglyglyser151015glyglyglyserglyglyglyser2038525prt人工序列來源/註解="人工序列的描述:合成的肽"變異(11)..(25)/替換=""混雜特徵(1)..(25)/註解="此序列可包含2-5個"glyglyglyglyser"重複單元"混雜特徵(1)..(25)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"385glyglyglyglyserglyglyglyglyserglyglyglyglysergly151015glyglyglyserglyglyglyglyser202538610prt人工序列來源/註解="人工序列的描述:合成的肽"386glyglyglyglyserglyglyglyglyser151038750prt人工序列來源/註解="人工序列的描述:合成的多肽"變異(6)..(50)/替換=""混雜特徵(1)..(50)/註解="此序列可包含1-10個"glyglyglyglyser"重複單元"混雜特徵(1)..(50)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"387glyglyglyglyserglyglyglyglyserglyglyglyglysergly151015glyglyglyserglyglyglyglyserglyglyglyglyserglygly202530glyglyserglyglyglyglyserglyglyglyglyserglyglygly354045glyser5038850prt人工序列來源/註解="人工序列的描述:合成的多肽"變異(6)..(50)/替換=""混雜特徵(1)..(50)/註解="此序列可包含1-10個"serglyglyglygly"重複單元"混雜特徵(1)..(50)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"388serglyglyglyglyserglyglyglyglyserglyglyglyglyser151015glyglyglyglyserglyglyglyglyserglyglyglyglysergly202530glyglyglyserglyglyglyglyserglyglyglyglyserglygly354045glygly5038954prt人工序列來源/註解="人工序列的描述:合成的多肽"變異(10)..(54)/替換=""混雜特徵(5)..(54)/註解="此區域可包含1-10個"serglyglyglygly"重複單元"混雜特徵(1)..(54)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"389glyglyglyglyserglyglyglyglyserglyglyglyglysergly151015glyglyglyserglyglyglyglyserglyglyglyglyserglygly202530glyglyserglyglyglyglyserglyglyglyglyserglyglygly354045glyserglyglyglygly5039015prt人工序列來源/註解="人工序列的描述:合成的肽"390gluprolyssercysglyglyglyglyserglyglyglyglyser15101539116prt人工序列來源/註解="人工序列的描述:合成的肽"391gluprolyssercysaspglyglyglyglyserglyglyglyglyser1510153925prt人工序列來源/註解="人工序列的描述:合成的5xhis標籤"392hishishishishis15393692prt人工序列來源/註解="人工序列的描述:合成的多肽"393glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrhisaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargserphephethrglyphehisleuasptyrtrpglyglngly100105110thrleuvalthrvalserseralaserthrlysglyproservalphe115120125proleualaproserserlysserthrserglyglythralaalaleu130135140glycysleuvallysasptyrpheprogluprovalthrvalsertrp145150155160asnserglyalaleuthrserglyvalhisthrpheproalavalleu165170175glnserserglyleutyrserleuserservalvalthrvalproser180185190serserleuglythrglnthrtyrilecysasnvalasnhislyspro195200205serasnthrlysvalasplyslysvalgluprolyssercysaspgly210215220glyglyglyserglyglyglyglysergluvalglnleuleugluser225230235240glyglyglyleuvalglnproglyglyserleuargleusercysala245250255alaserglyphethrpheserthrtyralametasntrpvalarggln260265270alaproglylysglyleuglutrpvalserargileargserlystyr275280285asnasntyralathrtyrtyralaaspservallysglyargphethr290295300ileserargaspaspserlysasnthrleutyrleuglnmetasnser305310315320leuargalagluaspthralavaltyrtyrcysvalarghisglyasn325330335pheglyasnsertyrvalsertrpphealatyrtrpglyglnglythr340345350leuvalthrvalserseralaservalalaalaproservalpheile355360365pheproproseraspgluglnleulysserglythralaservalval370375380cysleuleuasnasnphetyrproargglualalysvalglntrplys385390395400valaspasnalaleuglnserglyasnserglngluservalthrglu405410415glnaspserlysaspserthrtyrserleuserserthrleuthrleu420425430serlysalaasptyrglulyshislysvaltyralacysgluvalthr435440445hisglnglyleuserserprovalthrlysserpheasnargglyglu450455460cysasplysthrhisthrcysproprocysproalaproglualaala465470475480glyglyproservalpheleupheproprolysprolysaspthrleu485490495metileserargthrprogluvalthrcysvalvalvalaspvalser500505510hisgluaspprogluvallyspheasntrptyrvalaspglyvalglu515520525valhisasnalalysthrlysproargglugluglntyrasnserthr530535540tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn545550555560glylysglutyrlyscyslysvalserasnlysalaleuglyalapro565570575ileglulysthrileserlysalalysglyglnproarggluprogln580585590valtyrthrleuproprocysargaspgluleuthrlysasnglnval595600605serleutrpcysleuvallysglyphetyrproseraspilealaval610615620glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro625630635640provalleuaspseraspglyserphepheleutyrserlysleuthr645650655valasplysserargtrpglnglnglyasnvalphesercysserval660665670methisglualaleuhisasnhistyrthrglnlysserleuserleu675680685serproglylys690394449prt人工序列來源/註解="人工序列的描述:合成的多肽"394glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrhisaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargserphephethrglyphehisleuasptyrtrpglyglngly100105110thrleuvalthrvalserseralaserthrlysglyproservalphe115120125proleualaproserserlysserthrserglyglythralaalaleu130135140glycysleuvallysasptyrpheprogluprovalthrvalsertrp145150155160asnserglyalaleuthrserglyvalhisthrpheproalavalleu165170175glnserserglyleutyrserleuserservalvalthrvalproser180185190serserleuglythrglnthrtyrilecysasnvalasnhislyspro195200205serasnthrlysvalasplyslysvalgluprolyssercysasplys210215220thrhisthrcysproprocysproalaproglualaalaglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserhisgluasp260265270progluvallyspheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglntyrasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysalaleuglyalaproileglulys325330335thrileserlysalalysglyglnproarggluproglnvalcysthr340345350leuproproserargaspgluleuthrlysasnglnvalserleuser355360365cysalavallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleuvalserlysleuthrvalasplys405410415serargtrpglnglnglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserprogly435440445lys395216prt人工序列來源/註解="人工序列的描述:合成的多肽"修飾的殘基(201)..(201)任何胺基酸395gluilevalleuthrglnserproglythrleuserleuserprogly151015gluargalathrleusercysargalaserglnservalserserser202530tyrleualatrptyrglnglnlysproglyglnalaproargleuleu354045iletyrglyalaserserargalathrglyileproaspargpheser505560glyserglyserglythraspphethrleuthrileserargleuglu65707580progluaspphealavaltyrtyrcysglnglntyrthrasngluhis859095tyrtyrthrpheglyglnglythrlysvalgluilelysargthrval100105110alaalaproservalpheilepheproproseraspgluglnleulys115120125serglythralaservalvalcysleuleuasnasnphetyrproarg130135140glualalysvalglntrplysvalaspasnalaleuglnserglyasn145150155160serglngluservalthrgluglnaspserlysaspserthrtyrser165170175leuserserthrleuthrleuserlysalaasptyrglulyshislys180185190valtyralacysgluvalthrhisxaaglyleuserserprovalthr195200205lysserpheasnargglyglucys2102153967prt人工序列來源/註解="人工序列的描述:合成的肽"396glythrasnalaargalapro153979prt人工序列來源/註解="人工序列的描述:合成的肽"397alaleutrptyralaasnleutrpval153985prt人工序列來源/註解="人工序列的描述:合成的肽"398asnalatrpmethis1539919prt人工序列來源/註解="人工序列的描述:合成的肽"399serilelysserlysthraspglyglythrthrasptyralaalapro151015vallysgly4009prt人工序列來源/註解="人工序列的描述:合成的肽"400protyrglutrpsertrptyrasptyr15401120prt人工序列來源/註解="人工序列的描述:合成的多肽"401gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthrgluglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotyrglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserser11512040219prt人工序列來源/註解="人工序列的描述:合成的肽"402argilelysserlysthrgluglyglythrthrasptyralaalapro151015vallysgly403689prt人工序列來源/註解="人工序列的描述:合成的多肽"403gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthrgluglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotyrglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220glyglyglyglyserglyglyglyglysergluvalglnleuleuglu225230235240serglyglyglyleuvalglnproglyglyserleuargleusercys245250255alaalaserglyphethrpheserthrtyralametasntrpvalarg260265270glnalaproglylysglyleuglutrpvalserargileargserlys275280285tyrasnasntyralathrtyrtyralaaspservallysglyargphe290295300thrileserargaspaspserlysasnthrleutyrleuglnmetasn305310315320serleuargalagluaspthralavaltyrtyrcysvalarghisgly325330335asnpheglyasnsertyrvalsertrpphealatyrtrpglyglngly340345350thrleuvalthrvalserseralaserthrlysglyproservalphe355360365proleualaproserserlysserthrserglyglythralaalaleu370375380glycysleuvallysasptyrpheprogluprovalthrvalsertrp385390395400asnserglyalaleuthrserglyvalhisthrpheproalavalleu405410415glnserserglyleutyrserleuserservalvalthrvalproser420425430serserleuglythrglnthrtyrilecysasnvalasnhislyspro435440445serasnthrlysvalasplyslysvalgluprolyssercysasplys450455460thrhisthrcysproprocysproalaproglualaalaglyglypro465470475480servalpheleupheproprolysprolysaspthrleumetileser485490495argthrprogluvalthrcysvalvalvalaspvalserhisgluasp500505510progluvallyspheasntrptyrvalaspglyvalgluvalhisasn515520525alalysthrlysproargglugluglntyrasnserthrtyrargval530535540valservalleuthrvalleuhisglnasptrpleuasnglylysglu545550555560tyrlyscyslysvalserasnlysalaleuglyalaproileglulys565570575thrileserlysalalysglyglnproarggluproglnvaltyrthr580585590leuproprocysargaspgluleuthrlysasnglnvalserleutrp595600605cysleuvallysglyphetyrproseraspilealavalglutrpglu610615620serasnglyglnprogluasnasntyrlysthrthrproprovalleu625630635640aspseraspglyserphepheleutyrserlysleuthrvalasplys645650655serargtrpglnglnglyasnvalphesercysservalmethisglu660665670alaleuhisasnhistyrthrglnlysserleuserleuserprogly675680685lys404450prt人工序列來源/註解="人工序列的描述:合成的多肽"404gluvalglnleuvalgluserglyglyglyleuvallysproglygly151015serleuargleusercysalaalaserglyphethrpheserasnala202530trpmetsertrpvalargglnalaproglylysglyleuglutrpval354045glyargilelysserlysthrgluglyglythrthrasptyralaala505560provallysglyargphethrileserargaspaspserlysasnthr65707580leutyrleuglnmetasnserleulysthrgluaspthralavaltyr859095tyrcysthrthrprotyrglutrpsertrptyrasptyrtrpglygln100105110glythrleuvalthrvalserseralaserthrlysglyproserval115120125pheproleualaproserserlysserthrserglyglythralaala130135140leuglycysleuvallysasptyrpheprogluprovalthrvalser145150155160trpasnserglyalaleuthrserglyvalhisthrpheproalaval165170175leuglnserserglyleutyrserleuserservalvalthrvalpro180185190serserserleuglythrglnthrtyrilecysasnvalasnhislys195200205proserasnthrlysvalasplyslysvalgluprolyssercysasp210215220lysthrhisthrcysproprocysproalaproglualaalaglygly225230235240proservalpheleupheproprolysprolysaspthrleumetile245250255serargthrprogluvalthrcysvalvalvalaspvalserhisglu260265270aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis275280285asnalalysthrlysproargglugluglntyrasnserthrtyrarg290295300valvalservalleuthrvalleuhisglnasptrpleuasnglylys305310315320glutyrlyscyslysvalserasnlysalaleuglyalaproileglu325330335lysthrileserlysalalysglyglnproarggluproglnvalcys340345350thrleuproproserargaspgluleuthrlysasnglnvalserleu355360365sercysalavallysglyphetyrproseraspilealavalglutrp370375380gluserasnglyglnprogluasnasntyrlysthrthrproproval385390395400leuaspseraspglyserphepheleuvalserlysleuthrvalasp405410415lysserargtrpglnglnglyasnvalphesercysservalmethis420425430glualaleuhisasnargphethrglnlysserleuserleuserpro435440445glylys450405119prt人工序列來源/註解="人工序列的描述:合成的多肽"405gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglyasptyrargtyrargtyrpheasptyrtrpglyglngly100105110thrleuvalthrvalserser115406109prt人工序列來源/註解="人工序列的描述:合成的多肽"406sersergluleuthrglnaspproalavalservalalaleuglygln151015thrvalargilethrcysglnglyaspserleuargsertyrtyrala202530sertrptyrglnglnlysproglyglnalaprovalleuvaliletyr354045glylysasnasnargproserglyileproaspargpheserglyser505560serserglyasnthralaserleuthrilethrglyalaglnalaglu65707580aspglualaasptyrtyrcysasnserarggluserproprothrgly859095leuvalvalpheglyglyglythrlysleuthrvalleu100105407674prt人工序列來源/註解="人工序列的描述:合成的多肽"407gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglyasptyrargtyrargtyrpheasptyrtrpglyglngly100105110thrleuvalthrvalserseralaserthrlysglyproservalphe115120125proleualaproserserlysserthrserglyglythralaalaleu130135140glycysleuvalgluasptyrpheprogluprovalthrvalsertrp145150155160asnserglyalaleuthrserglyvalhisthrpheproalavalleu165170175glnserserglyleutyrserleuserservalvalthrvalproser180185190serserleuglythrglnthrtyrilecysasnvalasnhislyspro195200205serasnthrlysvalaspglulysvalgluprolyssercysaspgly210215220glyglyglyserglyglyglyglyserglnalavalvalthrglnglu225230235240proserleuthrvalserproglyglythrvalthrleuthrcysgly245250255serserthrglyalavalthrthrserasntyralaasntrpvalgln260265270glulysproglyglnalapheargglyleuileglyglythrasnlys275280285argalaproglythrproalaargpheserglyserleuleuglygly290295300lysalaalaleuthrleuserglyalaglnprogluaspglualaglu305310315320tyrtyrcysalaleutrptyrserasnleutrpvalpheglyglygly325330335thrlysleuthrvalleuserseralaserthrlysglyproserval340345350pheproleualaproserserlysserthrserglyglythralaala355360365leuglycysleuvallysasptyrpheprogluprovalthrvalser370375380trpasnserglyalaleuthrserglyvalhisthrpheproalaval385390395400leuglnserserglyleutyrserleuserservalvalthrvalpro405410415serserserleuglythrglnthrtyrilecysasnvalasnhislys420425430proserasnthrlysvalasplyslysvalgluprolyssercysasp435440445lysthrhisthrcysproprocysproalaproglualaalaglygly450455460proservalpheleupheproprolysprolysaspthrleumetile465470475480serargthrprogluvalthrcysvalvalvalaspvalserhisglu485490495aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis500505510asnalalysthrlysproargglugluglntyrasnserthrtyrarg515520525valvalservalleuthrvalleuhisglnasptrpleuasnglylys530535540glutyrlyscyslysvalserasnlysalaleuglyalaproileglu545550555560lysthrileserlysalalysglyglnproarggluproglnvaltyr565570575thrleuproprocysargaspgluleuthrlysasnglnvalserleu580585590trpcysleuvallysglyphetyrproseraspilealavalglutrp595600605gluserasnglyglnprogluasnasntyrlysthrthrproproval610615620leuaspseraspglyserphepheleutyrserlysleuthrvalasp625630635640lysserargtrpglnglnglyasnvalphesercysservalmethis645650655glualaleuhisasnhistyrthrglnlysserleuserleuserpro660665670glylys408449prt人工序列來源/註解="人工序列的描述:合成的多肽"408gluvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530alametsertrpvalargglnalaproglylysglyleuglutrpval354045seralaileserglyserglyglyserthrtyrtyralaaspserval505560lysglyargphethrileserargaspasnserlysasnthrleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglyasptyrargtyrargtyrpheasptyrtrpglyglngly100105110thrleuvalthrvalserseralaserthrlysglyproservalphe115120125proleualaproserserlysserthrserglyglythralaalaleu130135140glycysleuvalgluasptyrpheprogluprovalthrvalsertrp145150155160asnserglyalaleuthrserglyvalhisthrpheproalavalleu165170175glnserserglyleutyrserleuserservalvalthrvalproser180185190serserleuglythrglnthrtyrilecysasnvalasnhislyspro195200205serasnthrlysvalaspglulysvalgluprolyssercysasplys210215220thrhisthrcysproprocysproalaproglualaalaglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserhisgluasp260265270progluvallyspheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglntyrasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysalaleuglyalaproileglulys325330335thrileserlysalalysglyglnproarggluproglnvalcysthr340345350leuproproserargaspgluleuthrlysasnglnvalserleuser355360365cysalavallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleuvalserlysleuthrvalasplys405410415serargtrpglnglnglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserprogly435440445lys409215prt人工序列來源/註解="人工序列的描述:合成的多肽"409sersergluleuthrglnaspproalavalservalalaleuglygln151015thrvalargilethrcysglnglyaspserleuargsertyrtyrala202530sertrptyrglnglnlysproglyglnalaprovalleuvaliletyr354045glylysasnasnargproserglyileproaspargpheserglyser505560serserglyasnthralaserleuthrilethrglyalaglnalaglu65707580aspglualaasptyrtyrcysasnserarggluserproprothrgly859095leuvalvalpheglyglyglythrlysleuthrvalleuglyglnpro100105110lysalaalaproservalthrleupheproproserserlyslysleu115120125glnalaasnlysalathrleuvalcysleuileseraspphetyrpro130135140glyalavalthrvalalatrplysalaaspserserprovallysala145150155160glyvalgluthrthrthrproserlysglnserasnasnlystyrala165170175alasersertyrleuserleuthrprogluglntrplysserhisarg180185190sertyrsercysglnvalthrhisgluglyserthrvalglulysthr195200205valalaprothrglucysser210215410118prt人工序列來源/註解="人工序列的描述:合成的多肽"410glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyasptrpsertyrtyrmetasptyrtrpglyglnglythr100105110leuvalthrvalserser115411111prt人工序列來源/註解="人工序列的描述:合成的多肽"411aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095argglnthrprothrpheglyglnglythrlysvalgluilelys100105110412673prt人工序列來源/註解="人工序列的描述:合成的多肽"412glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyasptrpsertyrtyrmetasptyrtrpglyglnglythr100105110leuvalthrvalserseralaserthrlysglyproservalphepro115120125leualaproserserlysserthrserglyglythralaalaleugly130135140cysleuvalgluasptyrpheprogluprovalthrvalsertrpasn145150155160serglyalaleuthrserglyvalhisthrpheproalavalleugln165170175serserglyleutyrserleuserservalvalthrvalproserser180185190serleuglythrglnthrtyrilecysasnvalasnhislysproser195200205asnthrlysvalaspglulysvalgluprolyssercysaspglygly210215220glyglyserglyglyglyglyserglnalavalvalthrglnglupro225230235240serleuthrvalserproglyglythrvalthrleuthrcysglyser245250255serthrglyalavalthrthrserasntyralaasntrpvalglnglu260265270lysproglyglnalapheargglyleuileglyglythrasnlysarg275280285alaproglythrproalaargpheserglyserleuleuglyglylys290295300alaalaleuthrleuserglyalaglnprogluaspglualaglutyr305310315320tyrcysalaleutrptyrserasnleutrpvalpheglyglyglythr325330335lysleuthrvalleuserseralaserthrlysglyproservalphe340345350proleualaproserserlysserthrserglyglythralaalaleu355360365glycysleuvallysasptyrpheprogluprovalthrvalsertrp370375380asnserglyalaleuthrserglyvalhisthrpheproalavalleu385390395400glnserserglyleutyrserleuserservalvalthrvalproser405410415serserleuglythrglnthrtyrilecysasnvalasnhislyspro420425430serasnthrlysvalasplyslysvalgluprolyssercysasplys435440445thrhisthrcysproprocysproalaproglualaalaglyglypro450455460servalpheleupheproprolysprolysaspthrleumetileser465470475480argthrprogluvalthrcysvalvalvalaspvalserhisgluasp485490495progluvallyspheasntrptyrvalaspglyvalgluvalhisasn500505510alalysthrlysproargglugluglntyrasnserthrtyrargval515520525valservalleuthrvalleuhisglnasptrpleuasnglylysglu530535540tyrlyscyslysvalserasnlysalaleuglyalaproileglulys545550555560thrileserlysalalysglyglnproarggluproglnvaltyrthr565570575leuproprocysargaspgluleuthrlysasnglnvalserleutrp580585590cysleuvallysglyphetyrproseraspilealavalglutrpglu595600605serasnglyglnprogluasnasntyrlysthrthrproprovalleu610615620aspseraspglyserphepheleutyrserlysleuthrvalasplys625630635640serargtrpglnglnglyasnvalphesercysservalmethisglu645650655alaleuhisasnhistyrthrglnlysserleuserleuserprogly660665670lys413448prt人工序列來源/註解="人工序列的描述:合成的多肽"413glnvalglnleuvalglnserglyalagluvallyslysproglyala151015servallysvalsercyslysalaserglytyrthrphethrsertyr202530tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glyileileasnproserglyglyserthrsertyralaglnlysphe505560glnglyargvalthrmetthrargaspthrserthrserthrvaltyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaargglyasptrpsertyrtyrmetasptyrtrpglyglnglythr100105110leuvalthrvalserseralaserthrlysglyproservalphepro115120125leualaproserserlysserthrserglyglythralaalaleugly130135140cysleuvalgluasptyrpheprogluprovalthrvalsertrpasn145150155160serglyalaleuthrserglyvalhisthrpheproalavalleugln165170175serserglyleutyrserleuserservalvalthrvalproserser180185190serleuglythrglnthrtyrilecysasnvalasnhislysproser195200205asnthrlysvalaspglulysvalgluprolyssercysasplysthr210215220histhrcysproprocysproalaproglualaalaglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserhisgluasppro260265270gluvallyspheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglntyrasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysalaleuglyalaproileglulysthr325330335ileserlysalalysglyglnproarggluproglnvalcysthrleu340345350proproserargaspgluleuthrlysasnglnvalserleusercys355360365alavallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleuvalserlysleuthrvalasplysser405410415argtrpglnglnglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserproglylys435440445414218prt人工序列來源/註解="人工序列的描述:合成的多肽"414aspilevalmetthrglnserproleuserleuprovalthrprogly151015gluproalaserilesercysargserserglnserleuleuhisser202530asnglytyrasntyrleuasptrptyrleuglnlysproglyglnser354045proglnleuleuiletyrleuglyserasnargalaserglyvalpro505560aspargpheserglyserglyserglythraspphethrleulysile65707580serargvalglualagluaspvalglyvaltyrtyrcysmetglnala859095argglnthrprothrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproserasparglys115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215415360dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"415gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggacggatcaagagcaagaccgagggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctacgagtggtcttggtacgactactggggccagggcaccctcgtgaccgtgtcatct3604162067dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"416gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggacggatcaagagcaagaccgagggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctacgagtggtcttggtacgactactggggccagggcaccctcgtgaccgtgtcatct360gctagcacaaagggccctagcgtgttccctctggcccccagcagcaagagcacaagcggc420ggaacagccgccctgggctgcctcgtgaaggactacttccccgagcccgtgacagtgtct480tggaacagcggagccctgacaagcggcgtgcacaccttccctgccgtgctgcagagcagc540ggcctgtactccctgagcagcgtggtcaccgtgcctagcagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaagtggacaagaaggtggagccc660aagagctgtgatggcggaggagggtccggaggcggaggatccgaggtgcagctgctggaa720tctggcggcggactggtgcagcctggcggatctctgagactgagctgtgccgccagcggc780ttcaccttcagcacctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaa840tgggtgtcccggatcagaagcaagtacaacaactacgccacctactacgccgacagcgtg900aagggccggttcaccatcagccgggacgacagcaagaacaccctgtacctgcagatgaac960agcctgcgggccgaggacaccgccgtgtactattgtgtgcggcacggcaacttcggcaac1020agctatgtgtcttggtttgcctactggggccagggcaccctcgtgaccgtgtcaagcgct1080agtaccaagggccccagcgtgttccccctggcacccagcagcaagagcacatctggcgga1140acagccgctctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcttgg1200aactctggcgccctgaccagcggcgtgcacacctttccagccgtgctgcagagcagcggc1260ctgtactccctgtcctccgtggtcaccgtgccctctagctccctgggaacacagacatat1320atctgtaatgtcaatcacaagccttccaacaccaaagtcgataagaaagtcgagcccaag1380agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg1440tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag1500gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac1560gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc1620acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag1680tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1740gccaaagggcagccccgagaaccacaggtgtacaccctgcccccatgccgggatgagctg1800accaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgcc1860gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1920gactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcag1980caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag2040aagagcctctccctgtctccgggtaaa20674171350dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"417gaggtgcaattggtggaaagcggaggcggcctcgtgaagcctggcggatctctgagactg60agctgtgccgccagcggcttcaccttcagcaacgcctggatgagctgggtgcgccaggcc120cctggaaaaggactcgagtgggtgggacggatcaagagcaagaccgagggcggcaccacc180gactatgccgcccctgtgaagggccggttcaccatcagcagggacgacagcaagaacacc240ctgtacctgcagatgaacagcctgaaaaccgaggacaccgccgtgtactactgcaccacc300ccctacgagtggtcttggtacgactactggggccagggcaccctcgtgaccgtgtcatct360gctagcaccaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggc420ggcacagccgctctgggctgcctggtcaaggactacttccccgagcccgtgaccgtgtcc480tggaacagcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttct540ggcctgtatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacc600tacatctgcaacgtgaaccacaagcccagcaacaccaaggtggacaagaaggtggagccc660aagagctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcaggggga720ccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccct780gaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactgg840tacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaac900agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaag960gagtacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctcc1020aaagccaaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgag1080ctgaccaagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatc1140gccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg1200ctggactccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtgg1260cagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccgcttcacg1320cagaagagcctctccctgtctccgggtaaa1350418357dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"418gaggtgcaattgttggagtctgggggaggcttggtacagcctggggggtccctgagactc60tcctgtgcagcctccggattcacctttagcagttatgccatgagctgggtccgccaggct120ccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactac180gcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtat240ctgcagatgaacagcctgagagccgaggacacggccgtatattactgtgcgcgtggtgac300taccgttaccgttacttcgactactggggccaaggaaccctggtcaccgtctcgagt357419327dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"419tcttctgaactgactcaagatccagctgttagcgtggctctgggtcagactgtacgtatc60acctgccaaggcgattctctgcgctcctactacgcaagctggtaccagcagaaaccgggt120caggccccagttctggtgatttacggcaaaaacaaccgtccgtctgggatcccggaccgt180ttctccggcagctcttccggtaacacggcgagcctcaccatcactggcgctcaagcagaa240gacgaggccgactattactgtaactctcgggaaagcccaccaaccggcctggttgtcttc300ggtggcggtaccaagctgaccgtccta3274202022dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"420gaggtgcaattgttggagtctgggggaggcttggtacagcctggggggtccctgagactc60tcctgtgcagcctccggattcacctttagcagttatgccatgagctgggtccgccaggct120ccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactac180gcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtat240ctgcagatgaacagcctgagagccgaggacacggccgtatattactgtgcgcgtggtgac300taccgttaccgttacttcgactactggggccaaggaaccctggtcaccgtctcgagtgct360agcaccaagggcccctccgtgtttcctctggccccttccagcaagtccacctctggcgga420actgccgctctgggctgcctggtggaagattacttccccgagcccgtgaccgtgtcctgg480aattctggcgctctgacctccggcgtgcacacctttccagctgtgctgcagtcctccggc540ctgtactccctgtcctccgtcgtgacagtgccctccagctctctgggcacccagacctac600atctgcaacgtgaaccacaagccctccaacaccaaggtggacgagaaggtggaacccaag660tcctgcgacggtggcggaggttccggaggcggaggatcccaggctgtcgtgacccaggaa720ccctccctgacagtgtctcctggcggcaccgtgaccctgacctgtggatcttctaccggc780gctgtgaccacctccaactacgccaattgggtgcaggaaaagcccggccaggccttcaga840ggactgatcggcggcaccaacaagagagcccctggcacccctgccagattctccggttct900ctgctgggcggcaaggctgccctgactctgtctggtgctcagcctgaggacgaggccgag960tactactgcgccctgtggtactccaacctgtgggtgttcggcggaggcaccaagctgacc1020gtgctgtccagcgcttccaccaagggacccagtgtgttccccctggcccccagctccaag1080tctacatccggtggcacagctgccctgggatgtctcgtgaaggactactttcctgagcct1140gtgacagtgtcttggaacagcggagccctgaccagcggagtgcacacattccctgcagtg1200ctgcagagcagcggcctgta標籤cctgagcagcgtcgtgaccgtgccttcctctagcctg1260ggaacacagacatatatctgtaatgtgaatcataagcccagtaataccaaagtggataag1320aaagtggaacctaagagctgcgataagacccacacctgtcccccctgccctgctcctgaa1380gctgctggtggccctagcgtgttcctgttccccccaaagcccaaggacaccctgatgatc1440tcccggacccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtg1500aagttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcctagagag1560gaacagtacaactccacctaccgggtggtgtccgtgctgacagtgctgcaccaggactgg1620ctgaacggcaaagagtacaagtgcaaggtgtccaacaaggccctgggcgctcccatcgaa1680aagaccatctccaaggccaagggccagccccgggaaccccaggtgtacaccctgccccca1740tgccgggatgagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctat1800cccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagacc1860acgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggac1920aagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcac1980aaccactacacgcagaagagcctctccctgtctccgggtaaa20224211347dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"421gaggtgcaattgttggagtctgggggaggcttggtacagcctggggggtccctgagactc60tcctgtgcagcctccggattcacctttagcagttatgccatgagctgggtccgccaggct120ccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactac180gcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtat240ctgcagatgaacagcctgagagccgaggacacggccgtatattactgtgcgcgtggtgac300taccgttaccgttacttcgactactggggccaaggaaccctggtcaccgtctcgagtgct360agcaccaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggcggc420acagccgctctgggctgcctggtcgaggactacttccccgagcccgtgaccgtgtcctgg480aacagcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttctggc540ctgtatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacctac600atctgcaacgtgaaccacaagcccagcaacaccaaggtggacgagaaggtggagcccaag660agctgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccg720tcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgag780gtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtac840gtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagc900acgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggag960tacaagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaa1020gccaaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctg1080accaagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgcc1140gtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctg1200gactccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcag1260caggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcag1320aagagcctctccctgtctccgggtaaa1347422645dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"422tcttctgaactgactcaagatccagctgttagcgtggctctgggtcagactgtacgtatc60acctgccaaggcgattctctgcgctcctactacgcaagctggtaccagcagaaaccgggt120caggccccagttctggtgatttacggcaaaaacaaccgtccgtctgggatcccggaccgt180ttctccggcagctcttccggtaacacggcgagcctcaccatcactggcgctcaagcagaa240gacgaggccgactattactgtaactctcgggaaagcccaccaaccggcctggttgtcttc300ggtggcggtaccaagctgaccgtcctaggtcaacccaaggctgcccccagcgtgaccctg360ttcccccccagcagcaagaaactgcaggccaacaaggccaccctggtctgcctgatcagc420gacttctacccaggcgccgtgaccgtggcctggaaggccgacagcagccccgtgaaggcc480ggcgtggagaccaccacccccagcaagcagagcaacaacaagtacgccgccagcagctac540ctgagcctgacccccgagcagtggaagagccacaggtcctacagctgccaggtgacccac600gagggcagcaccgtggagaaaaccgtggcccccaccgagtgcagc645423354dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"423caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300tggtcttactacatggactattggggtcaaggcaccctcgtaacggtttcttct354424333dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"424gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcacggcagacccca300acttttggtcaaggcaccaaggtcgaaattaaa3334252019dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"425caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300tggtcttactacatggactattggggtcaaggcaccctcgtaacggtttcttctgctagc360accaagggcccctccgtgtttcctctggccccttccagcaagtccacctctggcggaact420gccgctctgggctgcctggtggaagattacttccccgagcccgtgaccgtgtcctggaat480tctggcgctctgacctccggcgtgcacacctttccagctgtgctgcagtcctccggcctg540tactccctgtcctccgtcgtgacagtgccctccagctctctgggcacccagacctacatc600tgcaacgtgaaccacaagccctccaacaccaaggtggacgagaaggtggaacccaagtcc660tgcgacggtggcggaggttccggaggcggaggatcccaggctgtcgtgacccaggaaccc720tccctgacagtgtctcctggcggcaccgtgaccctgacctgtggatcttctaccggcgct780gtgaccacctccaactacgccaattgggtgcaggaaaagcccggccaggccttcagagga840ctgatcggcggcaccaacaagagagcccctggcacccctgccagattctccggttctctg900ctgggcggcaaggctgccctgactctgtctggtgctcagcctgaggacgaggccgagtac960tactgcgccctgtggtactccaacctgtgggtgttcggcggaggcaccaagctgaccgtg1020ctgtccagcgcttccaccaagggacccagtgtgttccccctggcccccagctccaagtct1080acatccggtggcacagctgccctgggatgtctcgtgaaggactactttcctgagcctgtg1140acagtgtcttggaacagcggagccctgaccagcggagtgcacacattccctgcagtgctg1200cagagcagcggcctgtatagcctgagcagcgtcgtgaccgtgccttcctc標籤cctggga1260acacagacatatatctgtaatgtgaatcataagcccagtaataccaaagtggataagaaa1320gtggaacctaagagctgcgataagacccacacctgtcccccctgccctgctcctgaagct1380gctggtggccctagcgtgttcctgttccccccaaagcccaaggacaccctgatgatctcc1440cggacccccgaagtgacctgcgtggtggtggatgtgtcccacgaggaccctgaagtgaag1500ttcaattggtacgtggacggcgtggaagtgcacaacgccaagaccaagcc標籤agaggaa1560cagtacaactccacctaccgggtggtgtccgtgctgacagtgctgcaccaggactggctg1620aacggcaaagagtacaagtgcaaggtgtccaacaaggccctgggcgctcccatcgaaaag1680accatctccaaggccaagggccagccccgggaaccccaggtgtacaccctgcccccatgc1740cgggatgagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatccc1800agcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacg1860cctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaag1920agcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaac1980cactacacgcagaagagcctctccctgtctccgggtaaa20194261344dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"426caggtgcaattggttcaatctggtgctgaagtaaaaaaaccgggcgcttccgttaaagtg60agctgcaaagcatccggatacaccttcacttcctattacatgcactgggttcgtcaagcc120ccgggccagggtctggaatggatgggcatcattaacccaagcggtggctctacctcctac180gcgcagaaattccagggtcgcgtcacgatgacccgtgacactagcacctctaccgtttat240atggagctgtccagcctgcgttctgaagatactgcagtgtactactgtgcacgcggtgac300tggtcttactacatggactattggggtcaaggcaccctcgtaacggtttcttctgctagc360accaagggcccctccgtgttccccctggcccccagcagcaagagcaccagcggcggcaca420gccgctctgggctgcctggtcgaggactacttccccgagcccgtgaccgtgtcctggaac480agcggagccctgacctccggcgtgcacaccttccccgccgtgctgcagagttctggcctg540tatagcctgagcagcgtggtcaccgtgccttctagcagcctgggcacccagacctacatc600tgcaacgtgaaccacaagcccagcaacaccaaggtggacgagaaggtggagcccaagagc660tgcgacaaaactcacacatgcccaccgtgcccagcacctgaagctgcagggggaccgtca720gtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtc780acatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtg840gacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacg900taccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtac960aagtgcaaggtctccaacaaagccctcggcgcccccatcgagaaaaccatctccaaagcc1020aaagggcagccccgagaaccacaggtgtgcaccctgcccccatcccgggatgagctgacc1080aagaaccaggtcagcctctcgtgcgcagtcaaaggcttctatcccagcgacatcgccgtg1140gagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggac1200tccgacggctccttcttcctcgtgagcaagctcaccgtggacaagagcaggtggcagcag1260gggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaag1320agcctctccctgtctccgggtaaa1344427654dna人工序列來源/註解="人工序列的描述:合成的多核苷酸"427gatattgttatgactcaatctccactgtctctgccggtgactccaggcgaaccggcgagc60atttcttgccgttccagccagtctctgctgcactccaacggctacaactatctcgattgg120tacctgcaaaaaccgggtcagagccctcagctgctgatctacctgggctctaaccgcgct180tccggtgtaccggaccgtttcagcggctctggatccggcaccgatttcacgttgaaaatc240agccgtgttgaagcagaagacgtgggcgtttattactgtatgcaggcacggcagacccca300acttttggtcaaggcaccaaggtcgaaattaaacgtacggtggctgcaccatctgtcttc360atcttcccgccatctgatcggaagttgaaatctggaactgcctctgttgtgtgcctgctg420aataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcg480ggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagc540agcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtc600acccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt654428104prt人工序列來源/註解="人工序列的描述:合成的多肽"428alaserthrlysglyproservalpheproleualaproserserlys151015serthrserglyglythralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrglnthr65707580tyrilecysasnvalasnhislysproserasnthrlysvalasplys859095lysvalgluprolyssercysasp10042927prt人工序列來源/註解="人工序列的描述:合成的肽"變異(13)..(24)/替換=""混雜特徵(1)..(24)/註解="此區域可包含3-6個"glyglyglyser"重複單元"變異(25)..(27)/替換=""混雜特徵(1)..(27)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"429glyglyglyserglyglyglyserglyglyglyserglyglyglyser151015glyglyglyserglyglyglyserglyglygly202543028prt人工序列來源/註解="人工序列的描述:合成的肽"變異(11)..(25)/替換=""混雜特徵(1)..(25)/註解="此區域可包含2-5個"glyglyglyglyser"重複單元"變異(26)..(28)/替換=""混雜特徵(1)..(28)/註解="序列中給出的變異殘基就注釋中關於變異位置的那些而言沒有偏愛"430glyglyglyglyserglyglyglyglyserglyglyglyglysergly151015glyglyglyserglyglyglyglyserglyglygly2025當前第1頁12
