製備植物來源的VLP的方法與流程
2023-10-26 17:22:47 5
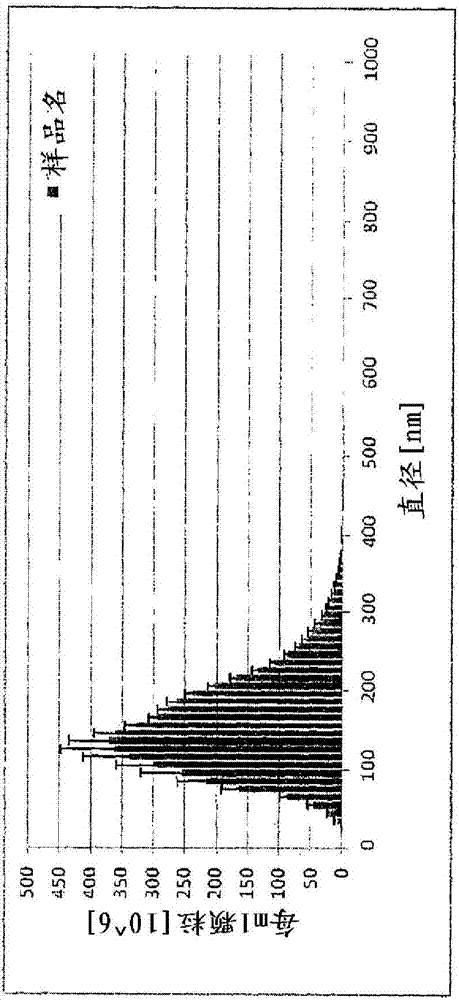
本申請是中國專利申請cn201080042333.0的分案申請,原申請是國際申請號pct/ca2010/001488於2012年3月22日進入中國國家階段的申請。本發明涉及製備植物來源的病毒樣顆粒(viruslikeparticle,vlp)的方法。
背景技術:
:目前宿主細胞(如大腸桿菌、昆蟲細胞培養物和哺乳動物細胞培養物)中的重組表達策略在培養基中以非常高的水平表達和分泌蛋白質。使用這些系統獲得了高水平表達、正確蛋白質摺疊和蛋白質翻譯後修飾。此外,由於可以容易地將細胞內蛋白質與其他組分(dna、囊泡、膜、色素等)分離,所表達蛋白質的純化得以簡化。對於植物或酵母表達系統,細胞壁阻止表達的蛋白質分泌到培養基中。對抗病毒感染的一種主要方法是通過免疫接種。應對流行爆發或滿足季節性需求(例如,每年秋季發生的「流感季」或最近全球爆發的「豬流感」)的疫苗生產需要在獲知後短時間內生產足量的疫苗。在面對全球流感大流行時,目前全球的流感疫苗產量可能不足。此外,主導(dominant)流感毒株每年變化,因此在一年中的低需求時間中儲備是不實際的。經濟、大規模地生產有效的流感疫苗有顯著價值。病毒樣顆粒(vlp)可用於製備流感疫苗。超結構(suprastructure)(如vlp)模擬病毒衣殼結構,但缺少基因組,從而不能複製或提供再次感染。vlp刺激強免疫應答,為分離(可溶)的重組抗原提供了替代方法。vlp在特定病毒蛋白表達後進行組裝並具有類似於其同類病毒的外表面,但不同於真的病毒顆粒,遺傳物質不會整合到其中。與天然病毒類似的顆粒狀多價結構抗原的呈遞引發具有均衡的體液和細胞成分的增強的免疫應答刺激。認為優於分離抗原產生之刺激的這種改進對於包膜病毒尤其適用,因為包膜vlp以其天然膜結合狀態呈遞表面抗原(grgacic和anderson,2006年,methods40,60-65)。此外,已證明與重組血凝素(ha)(即單體ha,或組成花環的ha;3-8個三聚體的ha組裝物)相比,擁有納米顆粒組織結構的流感vlp是更佳的候選疫苗,並且他們能激活體液和細胞免疫應答。(bright,r.a.,等,2007,vaccine25,3871-3878)。目前市場上的絕大部分流感疫苗由從蛋中培養之病毒粒獲得的病毒顆粒或病毒抗原構成。來源於蛋的疫苗的生產依賴於在具有胚胎的雞蛋中培養活病毒。在用去汙劑化學滅活和破壞純化的病毒粒後獲得裂解流感疫苗。作為大流行性疫苗產品,重組流感抗原是病毒來源抗原的有效替代品。一旦可獲得新毒株的遺傳構成信息,可以使用該信息生產重組抗原,並且其允許快速啟動生產過程。但是,與滅活的裂解流感疫苗相比,純化的重組ha亞基表現出更低的效力,並且需要更高的抗原含量來產生強免疫應答(treanor等,2007,j.am.med.assoc.297,1577-1582)。已通過在培養的哺乳動物細胞中共表達全部10種流感病毒蛋白獲得流感vlp(mena等,1996年,j.virol.70,5016-5024)。幾種病毒蛋白對於vlp的生產是可預設的,而且在疫苗發展中已通過共表達2種主要抗原性包膜蛋白(ha和na)以及m1或者僅共表達ha和m1生產流感vlp(kang等,2009年,virusres.143,140-146)。chen等(2007年,j.virol.81,7111-7123)證實單獨的ha可以驅動vlp形成和出芽,在他們的系統中可以省去m1共表達。但是,由於發現ha與產生vlp的哺乳動物細胞表面的唾液酸化糖蛋白結合,所以共表達了病毒唾液酸酶以使vlp在出芽後從生產細胞中釋放。期望有更簡單的vlp生產系統(例如依賴於表達僅一種或幾種病毒蛋白質而不需要表達非結構病毒蛋白的生產系統)以加快疫苗的開發。在植物系統中生產病毒抗原(包括vlp)提供了這樣的生產優勢,既它們可以在溫室或田間培養,不需要無菌組織培養法和處理。pct公開wo2006/119516(williamson和rybicki)公開了在植物中表達流感病毒a/越南/1194/2004的全長和截短的人密碼子優化h5ha。截短的構建體缺少膜錨定結構域。通過靶向er的構建體獲得最高的ha蛋白積累。缺少膜靶向結構域的構建體沒有產生可檢測的ha。沒有報導vlp的生產情況。之前wo2009/009876和wo2009/076778的發明人已描述了包含脂質包膜的流感havlp的生產(d'aoust等;兩者均通過引用併入本文)。對於包膜病毒,病毒保留脂質層或膜可以是有利的。不同系統的脂質構成可以有所不同(例如植物生成的包膜病毒會在包膜中包含植物脂質或植物甾醇),這可有助於增強免疫應答。mason等描述了表達hbv表面抗原(hbsag)的轉基因菸草中包膜vlp的組裝(1992年,proc.natl.acad.sci.usa89,11745-11749)。已證明植物生成的hbvvlp在腸胃外施用時在小鼠中顯示出誘導強b和t細胞免疫應答((huang等,2005年,vaccine23,1851-1858),但飼餵實驗的口服免疫僅誘導了中度的免疫應答(smith等,2003年,vaccine21,4011-4021)。greco(2007年,vaccine25,8228-8240)證明與hbsag融合的人免疫缺陷病毒(hiv)表位在轉基因菸草和擬南芥(arabidopsis)中表達時累積為vlp,產生了二價vlp疫苗。在轉基因菸草和馬鈴薯植株中表達病毒衣殼蛋白(nvcp)導致無包膜vlp的組裝(mason等,1996年,proc.natl.acad.sci.usa93,5335-5340)。已在農桿菌浸潤的本塞姆氏菸草(n.benthamiana)葉中產生了nvcpvlp(huang等2009年,biotechnol.bioeng.103,706-714),並且在小鼠中證實了其口服施用後的免疫原性(santi等,2008年,vaccine26,1846-1854)。給健康成人志願者施用含有215-751μgvlp形式的nvcp的2或3劑量生馬鈴薯在95%的免疫志願者中產生免疫應答(tacket等2000年,j.infect.dis.182,302-305)。還由hbv核心抗原(hbcag;huang等,2009年,biotechnol.bioeng.103,706-714)、人乳頭狀瘤病毒(hpv)主要衣殼蛋白l1(varsani等,2003年,arch.virol.148,1771-1786)的表達獲得了無包膜vlp。可期望在將vlp用於疫苗製備之前從植物或植物物質中存在的一些或全部蛋白質、碳水化合物等中分離vlp。pct公開wo00/09725(turpen等)描述了一種從植物的細胞間隙提取蛋白質的方法,包括真空和離心處理以提供包含目的蛋白質的間質液(interstitialfluid)提取物。該方法適於能在真空和離心條件下通過孔的小蛋白質(50kda或更小),但不適於較大超級結構蛋白(superstructureprotein)或蛋白複合物如vlp。1999年mccormick等(procnatlacadsciusa96:703-708)公開了使用與單鏈fv(scfv)表位融合的大米澱粉酶信號肽將表達的蛋白質靶向到細胞外部分(compartment),隨後通過對葉和莖組織進行真空過濾來回收scfv多肽。2008年moehnke等(biotechnollett30:1259-1264)描述了使用mccormick的真空過濾法通過質外體提取從菸草中獲得重組植物過敏原。pct公開wo2003/025124(zhang等)公開了在植物中表達scfv免疫球蛋白,其通過鼠信號序列靶向質外體空間。考慮到vlp和生產它們的植物組織的複雜性,期望有這樣的vlp製備方法,其中vlp基本上不含植物蛋白質或容易與其分離,但仍保留包膜病毒的結構和免疫原特性。技術實現要素:本發明涉及製備植物來源的病毒樣顆粒(vlp)的方法。更具體地,本發明涉及製備包含流感抗原的vlp的方法。本發明的一個目的是提供製備植物來源的病毒樣顆粒的改進方法。本發明提供了製備植物來源之vlp的方法(a),包括獲取定位於質外體(apoplast)中的包含植物來源之vlp的植物或植物物質;產生原生質體(protoplast)和質外體級分,質外體級分包含植物來源的vlp;回收質外體級分。該方法還可包括從質外體級分純化植物來源之vlp的步驟。植物來源之vlp可以是嵌合的植物來源vlp。植物來源的vlp可選自以下組:病毒包膜蛋白(viralenvelopeprotein)、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白(viralcoatprotein)。植物來源的vlp可以包含流感血凝素。質外體和原生質體級分可以通過用酶組合物處理植物或植物物質來產生。酶組合物可以包括一種或多於一種果膠酶、一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。此外,如期望,酶組合物不包括脂肪酶或蛋白酶,或該組合物不包括添加的脂肪酶或蛋白酶。植物或植物物質可以通過種植、收集或者種植並收集植物來獲得。植物物質可以包括一部分或整株植物、植物細胞、葉、莖、根或培養的植物細胞中的一種或多於一種。本發明提供了如上所述(方法a)製備植物來源之vlp的方法,其中編碼vlp的核酸以瞬時方式引入植物,所述vlp選自病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白的組。或者,核酸穩定地整合進植物基因組。本發明提供如上所述(方法a)製備植物來源的vlp的方法,其還包括從質外體級分純化植物來源的vlp的步驟。純化步驟可以包括通過深層過濾(depthfiltration)來過濾所述質外體級分以產生澄清的提取物,然後用陽離子交換樹脂來層析所述澄清的提取物。不希望被理論所約束,從質外體獲取的蛋白質較為均一,因為翻譯後修飾蛋白的中間形式或包含在多種細胞內部分進行之其他類型的加工的蛋白質沒有被共提取。重組蛋白均一性水平更高通常使得包含該蛋白質的製劑的質量更高,並可生成具有更高的效力、更長的半衰期或更好的免疫力的有益特性的產品。例如,與含有複合糖基化的蛋白質相比,含有高度甘露糖糖基化的血液蛋白在血液循環中被更快地被清除。產生於質外體級分的糖基化蛋白表現出更複合類型的糖基化。因此,使用本文所述方法(其涉及細胞壁消化)製備的質外體來源蛋白表現出,例如在循環中更長的半衰期。本發明還提供了製備包含植物來源之脂質包膜的植物來源vlp的方法(b),所述方法包括獲取包含位於質外體之vlp的植物或植物物質;用酶組合物處理植物或植物物質以產生原生質體級分和一種或多於一種質外體蛋白組合物;將所述一種或多於一種質外體蛋白複合物與所述原生質體級分分離,其中所述一種或多於一種質外體蛋白複合物包含vlp。所述酶組合物可以包含一種或多於一種果膠酶、一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。此外,如期望,酶組合物不包含脂肪酶或蛋白酶,或該組合物不包含添加的脂肪酶或蛋白酶。植物來源的vlp可以是嵌合的植物來源vlp。植物來源的vlp可以選自病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白的組。植物來源的vlp可以包含流感血凝素。本發明提供了如上所述(方法b)製備植物來源之vlp的方法,其中編碼vlp(選自病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白的組)的核酸以瞬時方式引入植物。或者,核酸穩定地整合進植物基因組。本發明提供如上所述(方法b)的製備植物來源的vlp的方法,其還包括從質外體級分中純化植物來源的vlp的步驟。所述純化步驟可以包括使用深層過濾來過濾質外體級分以產生澄清的提取物,然後用陽離子交換樹脂層析所述澄清的提取物。植物來源vlp可以包含一種或更多種流感ha多肽。流感ha多肽還可以是嵌合ha多肽。植物來源的vlp還可以包含凝血活性。植物或植物物質可以通過培養、收集或者培養並收集植物來獲得。所述植物物質可以包括部分或全部植物或者植物細胞、葉、莖、根或培養的細胞中的一種或多於一種。本發明還提供了製備植物來源的vlp的方法(c),包括獲取包含植物來源的vlp的植物或植物物質,用細胞壁降解酶組合物消化所述植物物質以產生消化級分,過濾所述消化級分以產生過濾級分,從所述過濾級分中回收植物來源的vlp。所述酶組合物可以包含一種或多於一種果膠酶,一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。此外,如期望,酶組合物不包含脂肪酶或蛋白酶,或該組合物不包含添加的脂肪酶或蛋白酶。植物來源的vlp可以是嵌合的植物來源vlp。植物來源的vlp可以選自病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白的組。植物來源的vlp可以包含流感血凝素。本發明提供了如上所述(方法c)製備植物來源之vlp的方法,其中編碼vlp(選自病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白的組)的核酸以瞬時方式引入植物。或者,核酸穩定地整合進植物基因組。本發明提供如上所述(方法c)的製備植物來源的vlp的方法,其還包括將過濾級分中的vlp與細胞碎片和不溶物質分離的步驟。分離步驟可以通過離心、深層過濾或者離心並深層過濾來進行以產生澄清的級分。植物來源的vlp可以通過層析來進一步純化,例如,澄清的提取物可以使用陽離子交換樹脂來純化。植物來源vlp可以包括包含一種或更多種流感ha多肽的vlp。流感ha多肽還可以是嵌合ha多肽。植物來源的vlp還可以包含凝血活性。植物或植物物質可以通過培養、收集或者培養並收集植物來獲得。所述植物物質可以包括部分或全部植物或者植物細胞、葉、莖、根或培養的細胞中的一種或多於一種。不希望被理論所約束,包含植物來源脂質的植物製得的vlp可以誘導比用其他生產系統製得的vlp更強的免疫反應,並且這些植物製得的vlp誘導的該免疫反應比活或減毒全病毒疫苗所誘導的免疫反應更強。從宿主細胞獲得的蛋白提取物成分是複雜的,並且往往包含與待分離的目的蛋白質或超結構一起的細胞外和細胞內成分。製備質外體級分隨後進行分離細胞內蛋白質和成分的步驟是有利的,因為目的蛋白質或超結構可以在製造過程中被富集和提高效力。包括更少有效步驟的更簡單過程可以顯著增加產量並且降低成本。還發現用細胞壁降解酶消化細胞壁的過程提高vlp蛋白的產量,即使在原生質體在提取過程中不保持完整的情況下也是如此。不希望被理論所約束,細胞壁消化步驟可鬆動細胞壁的多聚成分,並有助於使vlp釋放而非結合在細胞壁中。該方案還可以將細胞內成分對vlp的汙染降到最低。消化植物細胞壁的方法是已知的,並且消化細胞壁的酶混合物(enzymecocktailmixture)可以有所不同。本發明並不受所用的細胞壁消化方法限制。與使用勻漿、攪拌(blending)或研磨來製備植物來源之vlp的方法相比,本文所述方法使植物來源的vlp提取物受到更少的破壞和汙染。本文所述方法提供植物組織的質外體級分並且可以保持原生質體及其成分的完整性。本文所述方法即使在原生質體或原生質體的一部分失去其完整性而不再完整的情況下也能有效純化vlp。與涉及標準組織破碎技術(例如,勻漿、攪拌或研磨)的vlp提取方法相比,這些方法提供更高的vlp產量。更高的產量可以部分歸因於破壞vlp和/或脂質包膜之結構完整性的剪切力的減少。從質外體級分製備vlp可以是有利的,因為質外體級分具有顯著降低的細胞質蛋白或不含細胞質蛋白。因此,在質外體級分中將其他蛋白質和物質(包括ha單體、三聚體或ha片段)與vlp分離可以被容易地實施。但是,即使原生質體製備物或部分原生質體製備物是不完整的,vlp的產量增加也可以通過本文所述方法來實現。與通過標準組織破碎技術獲得的vlp相比,本發明的vlp的特徵還在於顯示出更高的凝血活性。這種改進的凝血活性可歸因於完整vlp產量更高(溶液中游離的ha單體或三聚體更少)、具有完整脂質包膜的完整vlp產量更高,或其組合。與用全病毒製成的疫苗相比,用vlp製成的疫苗的優勢在於它們是無感染性的。因此,不用考慮生物防護並且這在生產中也是不需要的。植物製備的vlp提供的另外一個優勢是允許在溫室或田間培養表達系統,從而顯著地更加經濟並適於擴大規模。此外,植物不包含參與向蛋白質合成或添加唾液酸殘基的酶。vlp可以在沒有神經氨酸酶(na)的情況下產生,並且不需要共表達na或用唾液酸酶(神經氨酸酶)處理生產細胞或提取以確保植物中的vlp生產。本發明的該概述並不必然描述本發明的所有特徵。附圖說明本發明的這些和其他特徵將從以下描述中顯而易見,其中參照了以下附圖:圖1顯示了表達h5a/印度尼西亞/5/05血凝素的基於cpmvht的表達盒(構建體685)。圖2顯示了a)表達h5/indo(構建體編號685)的構建體的部分(從paci(35s啟動子上遊)到asci(緊鄰nos終止子的下遊))核酸序列(seqidno.1)。來自a/印度尼西亞/5/2005的h5的編碼序列以下劃線表示。圖2b顯示了構建體編號685編碼的h5a/印度尼西亞/5/05的胺基酸序列(seqidno.2)。圖3顯示了用體積排阻層析(sec)表徵的包含血凝素(ha)的結構。離心經消化的植物提取物之後,重懸沉澱並通過sec分離。圖3a顯示了每個級分的總可溶性蛋白質含量(實心三角形;左側y-軸,最大值%;用bradford法測定)。還顯示了所收集級分(實心柱;右側y-軸)的凝血活性。圖3b顯示了sec洗脫級分的sds-page分析結果。通過丙酮沉澱級分並在分析前用1/40體積的還原性樣品上樣緩衝液重懸。用0.1%的考馬斯r-250溶液對凝膠染色。純化的vlp用作跑膠對照。對應於ha0單體的帶用箭頭表示。mw一分子量標準(kda);c一純化的vlp(對照);泳道7至10和14至16對應於圖3a所示的sec分析洗脫的級分編號。圖4顯示了酶消化和通過comitroltm勻漿器機械勻漿所獲得的蛋白譜對比。用變性樣品上樣緩衝液處理樣品,通過洗脫級分的sds-page分析分離蛋白質。用0.1%的考馬斯r-250溶液對凝膠染色。mw--分子量標準(kda);泳道1-25μl酶混合物;泳道2-25μl植物組織酶消化物,泳道3一通過comitrol勻漿器獲得的5μl提取物。圖5顯示了ha表達盒的核酸序列(seqidno:9),其包括苜蓿質體藍素啟動子和5』utr、a/印度尼西亞/5/2005(構建體號660)的h5的血凝素編碼序列、苜蓿質體藍素3』utr和終止子序列。圖6顯示了陽離子交換樹脂捕獲的直接來自質外體級分的ha-vlp分離物的ha-vlp。樣品用非還原變性樣品上樣緩衝液處理,通過sds-page分離蛋白質。用0.1%考馬斯r-250溶液對凝膠染色。泳道1:離心後的質外體級分;泳道2-3:連續微過濾後的質外體級分;泳道4:陽離子交換的上樣物;泳道5:陽離子交換的流出級分。泳道6;陽離子交換的洗脫物,濃縮10倍;泳道7:分子量標準(kda)。圖7顯示了h5/indovlp(a)、澄清之後沒有向消化緩衝液中添加nacl的h1/calvlp(b)和進行了該添加的h1/calvlp(c)的納米顆粒跟蹤分析(nanoparticletrackinganalysis,nta)譜。nta實驗是用nanosightlm20(nanosight,amesbury,uk)進行的。該裝置配備了藍雷射(405nm)、樣品室和viton氟橡膠o型圈。室溫下記錄視頻並用nta2.0軟體分析。樣品記錄60秒。手動選擇快門和增益(gain)以獲得最優粒子解析度。圖8顯示了用不同緩衝液酶消化產生的h3/布裡斯班vlp提取物的western印跡結果。泳道1)純重組ha標準(5μg,immunetechnologycorp.it-003-0042p),泳道2-5包含7μl如下緩衝液中進行的離心酶提取物:泳道2)600mm甘露糖醇+125m檸檬酸鹽+75mmnapo4+25mmedta+0.04%亞硫酸氫鹽(ph6.2),泳道3)600mm甘露糖醇+125mm檸檬酸鹽+75mmnapo4+50mmedta+0.04%亞硫酸氫鹽(ph6.2),泳道4)200mm甘露糖醇+125mm檸檬酸鹽+75mmnapo4+25mmedta+0.03%亞硫酸氫鹽(ph6.2),泳道5)200mm甘露糖醇+125mm檸檬酸鹽+75mmnapo4+50mmedta+0.03%亞硫酸氫鹽(ph6.2)。箭頭代表ha0的免疫檢測信號。具體實施方式本發明涉及製備植物來源的病毒樣顆粒(vlp)的方法。更具體地,本發明涉及製備包含流感血凝素(ha)的vlp的方法。以下描述是一個優選的實施方案。本發明提供了獲取目的蛋白質或蛋白超結構的方法。目的蛋白質可以存在於質外體或細胞外部分(compartment)中(對應於除原生質體/原生質球(spheroplast)部分之外的植物細胞部分)。該方法包括去除、消化或者消化並去除包圍植物細胞的纖維素植物細胞壁。通過消化細胞壁,細胞壁的聚合成分鬆動,目的蛋白質或蛋白超結構可以更容易地釋放。通過使用該方法,目的蛋白質或蛋白質超結構被富集,這是由於包含的主要宿主細胞蛋白和成分的原生質體/原生質球部分與質外體分離。如下所述,如果在過程中原生質體/原生質球部分失去完整性,如果原生質體/原生質球部分是不完整的,如果來自原生質體/原生質球部分的部分宿主細胞蛋白和成分存在於質外體級分中,本文提供的方法在獲得目的蛋白質或蛋白超結構方面仍然有效。蛋白超結構的實例是由2個或更多個多肽構成的結構;所述多肽可以是相同或不同的;如果是不同的,它們的存在比例可以為約1∶1至約10∶1或更高。蛋白超結構還可以包含一種或更多種脂質、磷脂、核酸、膜等。2個或更多個多肽可以通過共價鍵、二硫鍵、電荷相互作用、疏水吸引力、範德華力、氫鍵等連接。蛋白超結構的例子是病毒樣顆粒(vlp),其可以是包膜或非包膜的,例如病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白或病毒外殼蛋白。本發明還提供了製備植物來源的病毒樣顆粒(vlp)的方法。該方法包括獲取包含定位於質外體中的植物來源vlp的植物或植物物質;由植物物質產生原生質體/原生質球級分和質外體級分,質外體級分包含植物來源的vlp,以及回收質外體級分。如期望的話,可從質外體級分中純化植物來源的vlp。本發明還提供了製備包含植物來源的脂質包膜的vlp的方法。該方法包括獲取包含vlp的植物或植物物質,用酶組合物處理植物或植物物質以產生一種或多於一種質外體蛋白複合物和原生質體/原生質球級分,將一種或多於一種質外體蛋白複合物與原生質體級分分離。所述一種或多於一種質外體蛋白複合物包含含有植物來源的脂質包膜的vlp。本發明還提供了製備植物來源的vlp的方法,其包括獲取包含植物來源的vlp的植物或植物物質,用細胞壁降解酶組合物消化植物物質以產生消化級分,過濾消化級分以產生過濾級分,和從過濾級分回收植物來源的vlp。在這個方法中,原生質體的完整性可以不是必需的。原生質體是完全或部分去除細胞壁的植物細胞。原生質球可以部分去除細胞壁。原生質體、原生質球或原生質體和原生質球(原生質體/原生質球)均如本文所述使用,並且本文使用的這些術語是可以互換的。可以通過機械方式(例如通過勻漿、攪拌)破碎和去除細胞壁,可全部或部分地酶消化細胞壁,或可以通過機械和酶聯合的方法去除細胞壁,例如勻漿之後用酶處理以消化細胞壁。原生質體也可以從培養的植物細胞獲取,例如從液體培養的植物細胞或固體培養的植物細胞。給出植物組織培養物、培養的植物細胞和原生質體、原生質球生產等的一般原則的標準參考文獻包括:introductiontoplanttissueculture,mkrazdan著,第二版(sciencepublishers,2003年;通過引用併入本文),或例如參見下述url:molecular-plant-biotechnology.info/plant-tissue-culture/protoplast-isolation.htm。與原生質體(或原生質球)的生產和操作相關的方法和技術綜述於,例如,daveymr等,2005(biotechnologyadvances23:131-171;通過引用併入本文)。給出蛋白生物化學、分子生物學等的一般方法與原則的標準參考文獻包括,例如ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork(1998年和2001年的增刊;通過引用併入本文);sambrook等,molecularcloning:alaboratorymanual,第二版,coldspringharborlaboratorypress,plainview,newyork,1989(通過引用併入本文);kaufman等編.,handbookofmolecularandcellularmethodsinbiologyandmedicine,crcpress,bocaraton,1995(通過引用併入本文);mcpherson編,directedmutagenesis:apracticalapproach,irlpress,oxford,1991(通過引用併入本文)。消化或降解細胞壁以釋放原生質體或原生質球的酶是本領域技術人員已知的,可以包括纖維素酶(ec3.2.1.4)、果膠酶(ec3.2.1.15)、木聚糖酶(ec3.2.1.8)、幾丁質酶(ec3.2.1.14)、半纖維素酶或其組合。合適的酶的非限制性實例包括多組分酶的混合物,其包含纖維素酶、半纖維素酶和果膠酶,例如macerozymetm(約含:纖維素酶:0.1u/mg,半纖維素酶:0.25u/mg,和果膠酶:0.5u/mg)。另一些商業化酶、酶混合物的例子和供應商列於表1(參見:introductiontoplanttissueculture,mkrazdan第二版,sciencepublishers,2003年)。替代性的纖維素酶的名稱和種類包括內-1,4-β-d-葡聚糖酶;β-1,4-葡聚糖酶;β-1,4-葡聚糖內切水解酶;纖維素酶a;cellulosinap;葡聚糖內切酶d,鹼性纖維素酶;纖維素酶a3;纖維素糊精酶(celludextrinase);9.5纖維素酶;微晶纖維素酶;pancellasess和1,4-(1,3;1,4)-β-d-葡聚糖4-葡聚糖水解酶。替代性的果膠酶(多聚半乳糖醛酸酶)的名稱和種類包括果膠去聚合酶;果膠酶;多聚半乳糖醛酸內切酶;果膠酶(pectolase);果膠水解酶;果膠多聚半乳糖醛酸酶;多聚半乳糖醛酸內切酶;多聚-α-1,4-半乳糖醛酸聚糖水解酶;半乳糖醛酸內切酶;內-d-半乳糖醛酸酶和多聚(1,4-α-d-半乳糖醛酸)聚糖水解酶。替代性的木聚糖酶的名稱和種類包括半纖維素酶,內-(1→4)-β-木聚糖4-木聚糖水解酶;內-1,4-木聚糖酶;木聚糖酶;β-1,4-木聚糖酶;內-1,4-木聚糖酶;內-β-1,4-木聚糖酶;內-1,4-β-d-木聚糖酶;1,4-β-木聚糖木聚糖水解酶;β-木聚糖酶;β-1,4-木聚糖木聚糖水解酶;內-1,4-β-木聚糖酶;β-d-木聚糖酶。替代性的幾丁質酶的名稱和種類包括幾丁質糊精酶;1,4-β-多聚-n-乙醯氨基葡糖苷酶;多聚-β-氨基葡糖苷酶;β-1,4-多聚-n-乙醯氨基葡糖苷酶;多聚[1,4-(n-乙醯-β-d-氨基葡糖苷酶)]聚糖水解酶。表1:用於原生質體分離的市售酶的非限制性實例特定的酶或酶組合以及濃度和反應條件的選擇可取決於用於獲取原生質體和包含vlp的質外體級分的植物組織的類型。使用纖維素酶、半纖維素酶和果膠酶的混合物(例如,果膠酶macerozymetm或multifect)的濃度範圍可以是0.01%至2.5%(v/v),例如0.01、0.02、0.04、0.06、0.08、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5%(v/v)或其間任意值。macerozymetm或multifect可以單獨使用,或與其他酶(例如纖維素酶、果膠酶、半纖維素酶或其組合)聯合使用。使用纖維素酶的濃度範圍可以是0.1%至5%,例如0.1、0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4.0、4.25、4.5、4.75、5.0%(w/v)或其間任意值。酶溶液(或稱為細胞壁降解組合物,消化溶液)通常包含緩衝劑或緩衝體系、滲壓劑和一種或多於一種鹽、二價陽離子或其他添加劑。選擇緩衝劑或緩衝體系將ph維持在適於酶活性和蛋白或vlp穩定性的範圍內,以在例如在約ph5.0至約8.0或其間任意值的範圍內純化。所選的ph可以根據待回收的vlp而異,例如ph可以是5.0、5.2、5.4、5.6、5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8、8.0或其間任意ph。緩衝劑或緩衝體系的例子包括但不限於mes、磷酸鹽、檸檬酸鹽等。一種或更多種緩衝劑或緩衝體系可以與酶溶液(消化溶液)組合;一種或更多種緩衝劑存在的濃度可以是0mm至約200mm或其間任意值,例如10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180或190mm或其間任意值。根據適用程度,如期望的話可以添加滲壓劑成分。選擇滲壓劑及其濃度以提高酶溶液的滲透強度。滲壓劑的例子包括甘露糖醇、山梨醇或其他糖醇,聚合物長度不同的聚乙二醇(peg)等。滲壓劑的濃度範圍根據植物物種、使用的滲壓劑類型和所選植物組織類型(來源的物種或組織,例如葉或莖)而異——通常範圍為0m至約0.8m,例如0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.5、0.6、0.7或0.75m或其間任意值,例如0、50、100、150、200、250、300、350、400、450、500、550、600nm甘露糖醇或其間任意值。滲壓劑的濃度也可用百分比(w/v)表示。對於某些植物或組織類型,採用稍高滲的製劑可以是有利的,這可以促進植物細胞的質膜與細胞壁分離。在消化過程中也可以省略滲壓劑。另一個為植物消化設置的參數是溫度。如期望的話,可以在消化過程中控制溫度。有用的溫度範圍應在4℃至40℃之間或其間任意溫度,例如約4℃至約15℃或其間任意值,或約4℃至約22℃或其間任意溫度。根據選擇的溫度,可以調整其他消化實驗參數以保持最佳的提取條件。可以添加陽離子、鹽或二者以提高質膜穩定性,例如濃度為0.5-50mm或其間任意值的二價陽離子(如ca2+或mg2+),約0至約750mm或其間任意值(例如10、20、30、40、50、100、200、300、400、500、600、700或750mm)的鹽(如cacl2、nacl、cuso4、kno3等)。可以添加的其他添加劑包括螯合劑(例如但不限於,約0至約200mm或其間任意值(例如5、10、15、20、25、50、75、100、125、150、175、200mm或其間任意值)的edta、egta),防止氧化的還原劑(例如但不限於,0.005-0.4%或其間任意值(例如0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.15、0.2、0,25、0.3、0.35、0.4%或其間任意值)的亞硫酸氫鈉或抗壞血酸),特定的酶抑制劑(參見下文)以及(如期望的話)葉老化抑制劑,例如環己醯亞胺、激動素或一種或更多種聚胺。消化溶液還可以包含一種或更多種約0至約600mm的甘露糖醇、約0至約500mm的nacl、約0至約50mm的edta、約1%至約2%v/v的纖維素酶、約0至約1%v/v的果膠酶、約0.03至約0.04%的焦亞硫酸鈉、約0至約125mm的檸檬酸鹽或約0至75mm的napo4。可以處理植物物質以提高酶或酶組合物對植物細胞壁的接近程度。例如,在用酶組合物處理之前可將葉的表皮去除或「剝離」。可以將植物物質切成小塊(手工地,或用粉碎或切削裝置如urschel切片機);切碎的植物物質可以在部分真空下進一步用酶組合物滲透(nishimura和beevers1978年,plantphysiol62:40-43;newell等,1998年,j.expbotany49:817-827)。在酶組合物處理之前或過程中可以對植物組織施加機械擾動(giridhar等,1989年.protoplasma151:151-157)。另外,可以使用培養的細胞(無論是液體培養物還是固體培養物)製備原生質體或原生質球。期望使用缺少脂肪酶或蛋白酶或者含有滅活的脂肪酶或蛋白酶的酶組合物。在一些實施方案中,酶組合物中可以包含一種或更多種蛋白酶或脂肪酶抑制劑。脂肪酶抑制劑的例子包括rhc80267(sigmaaldrich);蛋白酶抑制劑的例子包括e-64、na2edta、胃酶抑素(pepstatin),抑肽酶(aprotinin)、pmsf,pefabloc、亮抑蛋白酶肽(leupeptin),bestatin等。可使用混合或攪拌酶組合物中植物物質的任何適合方法。例如,植物物質可以在碟或盤上或通過旋轉搖蕩器輕輕地轉動或搖動,在旋轉或擺動的圓桶中翻滾。在將原生質體(和/或原生質球)從消化液中移出之前應小心處理,以將對它們的損傷降低到最低。應相應地選擇消化容器。作為一個非限制性的例子,可以使用在500mm甘露糖醇、10mcacl2和5mmmes(ph5.6)中包含1.5%纖維素酶(onozukar-10)和0.375%的macerozymetm的酶組合物來從一些菸草(nicotiana)組織製備原生質體(或原生質球)。如本文所述,甘露糖醇的濃度也可以為約0至約500mm或其間任意值不等。本領域普通技術人員在知曉本文公開的信息後,可以針對菸草或用於製備vlp的其他物種的年齡和株系決定合適的酶組合物。破碎細胞壁或部分消化細胞壁後,獲得原生質體級分(包含原生質體和/或原生質球)和「質外體級分」。或者,可以獲得「消化級分」。如下所述,對於本文所述的蛋白質高產量製備,原生質體級分的完整性可以不是必需的,因此,可使用質外體級分或消化級分提取蛋白質,例如但不限於vlp、病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白、病毒外殼蛋白。「質外體級分」是指在滲壓劑和/或其他可用於協助保持原生質體完整性的成分的存在下,使用細胞壁降解酶酶消化或部分酶消化植物物質後獲得的級分。質外體級分可以包含破碎的原生質體(或原生質球)產生的一些成分。例如,質外體級分可以包含約0至約50%(v/v)或其間任意量的原生質體級分的成分,或0、0.1、0.5、1、5、10、15、20、25、30、35、40、45、或50%(v/v)或其間任意量的原生質體級分的成分。「消化級分」是指使用細胞壁降解酶酶消化或部分酶消化植物物質後剩餘的級分,但是,原生質體的完整性不是必需的,消化級分可以包含完整的、破碎的或者完整的和破碎的原生質體。用於產生消化級分的包含細胞壁降解酶的組合物可以包含滲壓劑,或者滲壓劑存在的量可以比用於獲得原生質體的標準方法中使用的量少,或組合物中不存在滲壓劑。消化級分包含質外體級分和原生質體/原生質球級分,但原生質體/原生質球級分可以是或不是完整的。消化級分包含細胞內成分和細胞外成分。如果使用滲壓劑來保持原生質體/原生質球的完整性,則可發現細胞內成分為原生質體/原生質球形式。如果消化溶液中沒有滲壓劑,則原生質體/原生質球可能被破壞並且消化級分中細胞內和細胞外成分可能合併在一起。如本文所述,可以通過任何合適的技術從消化級分的成分中分離vlp。不希望被理論所約束,細胞壁消化步驟可鬆動細胞壁的多聚成分並協助釋放vlp,使它們不會被約束在細胞壁內。該方案也可以最大限度地減少細胞內成分對vlp的汙染。可以在酶消化之後用低速離心然後過濾、深層過濾、沉降、沉澱(例如但不限於硫酸銨沉澱)或其組合來將vlp與細胞碎片分離,以獲得包含目的蛋白質或超結構蛋白的分離級分。如果採用滲壓劑,則可以用任何合適的技術(例如但不限於離心、過濾、深層過濾、沉降、沉澱或其組合)將原生質體/原生質球級分或包含原生質體的級分與質外體級分分離,來獲得包含vlp和/或包含含有vlp之原生質體/原生質球的分離級分。可以使用任何合適的技術(例如但不限於離心、過濾、深層過濾、沉降、沉澱或其組合)將原生質體(和原生質球)級分或包含原生質體的級分與質外體級分分離,以獲得分離的級分。分離級分可以是例如上清液(如果是離心、沉降或沉澱的話)或濾液(如果是過濾的話),並且富含vlp。分離級分可被進一步處理,以通過例如另外的離心步驟、沉澱、層析步驟(例如體積排阻、離子交換層析)、切向流過濾或其組合來分離、純化、濃縮(或其組合)vlp。純化的vlp的存在可通過例如非變性page或sds-page、使用合適的檢測抗體的western分析、毛細管電泳或本領域技術人員顯而易見的其他方法證實。質外體是質膜外的植物細胞部分,並且包含細胞壁和植物的細胞間隙。雖然優選在消化和進一步處理過程中保持原生質體(和/或原生質球)的完整性,但對於富集vlp來說,保持原生質體完整不是必需的。在合成過程中,vlp被排出到質膜外。vlp的平均大小為約20nm至1μm或其間任意量,例如60、65、70、75、80、85、90、95、100、105、110、120、130、140、150、160、170、180、190或200nm,或其間任意量,例如100nm,並且可包含脂質膜。由於它們的大小,一旦合成,vlp可能被困於質膜和細胞壁之間,可能無法使用用於獲得植物蛋白質的標準機械方法進行分離或進一步純化。為了將產量最大化,有利的可以是將細胞蛋白質對vlp級分的汙染最小化,保持vlp和(在一些實施方案中)結合的脂質包膜或膜的完整性,將對原生質體(和/或原生質球)的機械損傷最小化的破壞細胞壁釋放vlp的方法,例如本文所述的酶法。但是,在處理過程中保持所有的原生質體的完整性不是必需的。根據本發明的一些方面在植物中產生的vlp可以與植物來源的脂質複合。vlp可以包含ha0前體形式,或者ha1或ha2結構域通過二硫橋保持在一起的形式。植物來源的脂質可以是脂雙層的形式,並且還可以包含圍繞vlp的包膜。植物來源的脂質可包括產生vlp之植物的質膜脂質成分,包括但不限於磷脂醯膽鹼(pc)、磷脂醯乙醇胺(pe)、鞘糖脂、植物甾醇或其組合。植物來源的脂質可互換地稱為『植物脂質』。植物甾醇的例子在本領域已知,包括例如豆甾醇、谷甾醇、24-甲基膽固醇和膽固醇(mongrand等,2004年,j.biolchem279:36277-86)。對於vlp的組裝,期望病毒結構蛋白(如ha)正確摺疊並且形成ha三聚體。向對象施用時,相對於施用結構蛋白質單體,vlp(尤其是包含植物來源的脂質包膜的vlp)可以提供更優的免疫應答。在一些實施方案中,可以將多肽的表達靶向植物的任意細胞內或細胞外空間、細胞器或組織。為了將表達的多肽定位到特定位置,編碼多肽的核酸可以與編碼信號肽的核酸序列相連。信號肽也可稱為轉運肽或信號序列。引導表達的多肽定位於質外體的信號肽或肽序列包括但不限於大米澱粉酶信號肽(mccormick1999年,procnatlacadsciusa96:703-708)、胺基酸序列如下的蛋白二硫鍵異構酶信號肽(pdi):maknvaifgllfsllllvpsqifaee;seqidno.10,植物發病相關蛋白(plantpathogenesisrelatedprotein,prp;szyperski等pnas95:2262-2262)例如菸草植物發病相關蛋白2(prp)、人單克隆抗體信號肽(sp)或任何天然血凝素信號肽。在一些例子中,例如多肽在沒有信號肽或轉運肽的情況下表達並分泌時,表達的多肽可以在特定的細胞內或細胞外空間(如質外體)、細胞器或組織中累積。術語「病毒樣顆粒」或「vlp」(virus-likeparticle)是指自組裝並且包含病毒表面蛋白(例如流感ha蛋白或嵌合流感ha蛋白)的結構。vlp和嵌合vlp通常在形態和抗原性上類似於感染中產生的病毒粒,但缺乏足以進行複製的遺傳信息,從而不具備感染性。可以在適合的宿主細胞(包括植物宿主細胞)中生產vlp和嵌合vlp,如期望進行進一步純化。儘管本文中示例了流感vlp和嵌合流感vlp,本文所述方法可用於定位於或分泌到質外體的任何植物來源的vlp。「嵌合蛋白」或「嵌合多肽」是指包含兩種或多於兩種來源(例如但不限於融合為單個多肽的兩種或更多種流感類型或亞型)的胺基酸序列的蛋白或多肽。嵌合蛋白或多肽可以包含與多肽或蛋白的其餘部分相同來源(即天然)或異源的信號肽。嵌合蛋白或嵌合多肽可作為嵌合核苷酸序列的轉錄本產生並保持完整,或如果需要的話,嵌合蛋白或嵌合多肽可以在合成後被切割。完整的嵌合蛋白或嵌合蛋白之經切割部分可以結合形成多聚體蛋白。嵌合蛋白或嵌合多肽還可以包括含有經二硫橋連接之亞基的蛋白質或多肽(即多聚蛋白)。例如,包含兩種或多於兩種來源的胺基酸序列的嵌合多肽可被加工成亞基,並且所述亞基通過二硫橋相連來形成嵌合蛋白或嵌合多肽。多肽可以是流感血凝素(ha),並且構成多肽的兩種或多於兩種胺基酸序列中的每個均可獲得自不同的ha,從而產生嵌合ha或嵌合流感ha。嵌合ha還可以包含含有異源信號肽(其在合成後被切割)的胺基酸序列(嵌合ha前體蛋白)。可用於本發明的ha蛋白的例子可參見wo2009/009876;wo2009/076778;wo2010/003225(通過引用併入本文)。編碼嵌合多肽的核酸可稱為「嵌合核酸」或「嵌合核苷酸序列」。由嵌合ha構成的病毒樣顆粒可稱為「嵌合vlp」。嵌合vlp還在pct申請號pct/ca2010/000983(於2010年6月25日提交)和美國臨時申請號61/220,161(於2009年6月24日提交;通過引用併入本文)中描述。vlp可從天然或嵌合ha的表達獲得。按照本發明提供方法製備的vlp的ha包括已被開發或鑑定的已知序列和變體ha序列。另外,如本文所述製備的vlp不包含神經氨酸酶(na)或其他如m1(m蛋白)、m2、ns等的成分。但是,如果期望獲得包含ha和na的vlp,可以將na和m1與ha共表達。通常,術語「脂質」指脂溶性(親脂)天然分子。按照本發明的某些方面在植物中產生的嵌合vlp可以與植物來源的脂質複合。植物來源的脂質可以是脂雙層的形式,並且還可以包含圍繞vlp的包膜。植物來源的脂質可包括生成vlp的植物的質膜脂質成分,包括磷脂,三、二和單酸甘油酯以及脂溶性甾醇或包含甾醇的代謝物。例子包括磷脂醯膽鹼(pc)、磷脂醯乙醇胺(pe)、磷脂醯肌醇、磷脂醯絲氨酸、鞘糖脂、植物甾醇或其組合。或者植物來源的脂質可稱為「植物脂質」。植物甾醇的例子包括菜油甾醇、豆甾醇、麥角甾醇、菜子甾醇、δ-7-豆甾醇、δ-7-燕麥甾醇、daunosterol、谷甾醇、24-甲基膽固醇、膽固醇或β-谷甾醇(mongrand等,2004年,j.biolchem279:36277-86)。如本領域技術人員易於理解的,細胞質膜的脂質構成可隨獲得細胞的細胞或有機體或物種的培養或生長條件而異。細胞膜通常包含脂雙層以及多種功能的蛋白質。可以在脂雙層中發現特定脂質的局部聚集,稱為『脂質筏『。這些脂質筏微結構域可以富含鞘脂和甾醇。不希望被理論所約束,脂質筏可以在胞吞和胞吐、病毒或其他感染物的進出、細胞間信號轉導、與細胞或有機體的其他結構成分(如細胞內和細胞外基質)的相互作用中起重要作用。之前wo2009/009876;wo2009/076778和wo2010/003225(通過引用併入本文)已描述了包含脂質包膜的vlp。對於流感病毒,本文所用術語「血凝素」或「ha」指流感病毒顆粒的結構糖蛋白。本發明的ha可從任何亞型獲得。例如,ha可以是亞型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15或h16,或乙型或丙型流感。本發明的重組ha還可以包含基於任何血凝素序列的胺基酸序列。已很好地研究了流感血凝素的結構,並證明在二級、三級和四級結構上高度保守。甚至可以在胺基酸序列改變的情況下發現這種結構保守性(參見例如,skehel和wiley,2000年annrevbiochem69:531-69;vaccaro等2005年;通過引用併入本文)。編碼ha的核苷酸序列是公知的並且可獲得,例如從生物防禦和公眾健康資料庫(biodefenseandpublichealthdatabase)(現為流感研究資料庫;squires等,2008年nucleicacidsresearch36:d497-d503)例如url為:biohealthbase.org/gsearch/home.do?decorator=influenza)或由國家生物技術信息中心維護的資料庫(ncbi;例如url為:ncbi.nlm.nih.gov/sites/entrez?db=nuccore&cmd=search&term=influenza),兩者均通過引用併入本文。本發明還涉及製備、分離或者製備並分離vlp的方法,所述vlp包括感染人或宿主動物(例如靈長類動物、馬、豬、鳥、綿羊、鳥類水禽、候鳥、鵪鶉、鴨、鵝、家禽、雞、駱駝、犬科動物、狗、貓科動物、貓、虎、豹、麝貓、貂、石貂、雪貂、家養寵物、牲畜、小鼠、大鼠、海豹、鯨等)的病毒的流感vlp。一些流感病毒可以感染多於一種宿主動物。流感病毒血凝素可以耐受胺基酸變化。這種變化提供了不斷被鑑定出的新毒株。新毒株之間感染力可不同。然而,隨後形成vlp的血凝素三聚體的形成被保留。本發明還包括製備任何植物來源的vlp(無論ha亞型或序列或者形成vlp的嵌合ha或者物種來源為何)的方法。血凝素的正確摺疊對於蛋白質的穩定性、多聚體的形成、vlp的形成和ha的功能(凝血能力)以及其他流感血凝素特性可以是重要的。蛋白質的摺疊可被一個或更多個因素影響,包括但不限於蛋白質序列,蛋白質的相對豐度,細胞內擁擠的程度,可以結合摺疊、部分摺疊或未摺疊蛋白質或與其短暫相關聯的輔因子的可利用性,一種或更多種伴侶蛋白的存在等。熱休克蛋白(hsp)或應激蛋白是伴侶蛋白的例子,它可參與多種細胞過程,包括蛋白質合成、細胞內轉運、防止錯誤摺疊、防止蛋白質聚集、蛋白複合物的組裝和解組裝、蛋白質摺疊和蛋白質解聚。這種伴侶蛋白的例子包括但不限於hsp60、hsp65、hsp70、hsp90、hsp100、hsp20-30、hsp10、hsp100-200、hsp100、hsp90、lon、tf55、fkbp、親環素、clpp、grpe、泛素、鈣聯蛋白和蛋白質二硫鍵異構酶(參見例如,macario,a.j.l.,coldspringharborlaboratoryres.25:59-70.1995年;parsell,d.a.&lindquist,s.ann.rev.genet.27:437-496(1993);美國專利號5,232,833)。伴侶蛋白(例如但不限於hsp40和hsp70)可用於保證嵌合ha的摺疊(pct申請號pct/ca2010/000983,於2010年6月25日提交,美國臨時申請號61/220,161,於2009年6月24日提交;wo2009/009876和wo2009/076778,以上均通過引用併入本文)。還可以使用蛋白質二硫鍵異構酶(pdi;登錄號z11499)。回收後,可通過例如但不限於電子顯微鏡、光散射、體積排阻層析、hplc、western印跡分析或電泳來評估vlp的結構、大小效力或活性。用於評價vlp的大小、濃度、活性和構成的這些和其他評估方法是本領域公知的。對於製備型體積排阻層析,可通過本文所述方法獲得包含vlp的製備物,並且通過離心去除不溶性物質。用peg沉澱也可以是有益的。回收的蛋白質可通過常規方法(例如,bradford測定、bca)定量,提取物流經體積排阻柱(例如使用sephacryltm、sephadextm或類似基質),並且收集級分。可以用bluedextran2000或合適蛋白質作為校正標準。還可以將提取物通過陽離子交換柱並且收集活性成分。層析後,可根據期望通過蛋白質電泳、免疫印跡或兩者來進一步分析級分,以確認級分中vlp和蛋白質補充物的存在。可通過本領域公知的方法,使用凝血測定評估包含vlp之級分的凝血活性。不希望被理論所約束,ha結合不同動物來源的rbc的能力被ha對唾液酸α2,3或α2,3的親和力和rbc表面上這些唾液酸的存在所驅動。馬類和禽類的流感病毒ha凝集所有幾種物種(包括火雞、雞、鴨、豚鼠、人、綿羊、馬和牛)的紅細胞,;而人ha結合火雞、雞、鴨、豚鼠、人和綿羊的紅細胞(itot.等,1997年,virology,227:493-499;medeirosr等,2001年.virology289:74-85)。凝血抑制(hi或hai)測定也可用於證實疫苗或疫苗組合物(包含嵌合ha或可通過重組ha抑制紅細胞(rbc)凝集的嵌合vlp)所誘導的抗體的效力。可通過微滴定hai(aymard等1973年)評價血清樣品的凝血抑制性抗體效價。可以使用幾種物種(例如馬、火雞、雞等)中任意一種的紅細胞。該測定給出vlp表面ha三聚體組裝的間接信息,以確認ha上抗原性位點的正確呈遞。也可使用交叉反應性hai效價證明對與疫苗亞型相關的其他病毒株的免疫應答效力。例如,用包含含有第一流感類型或亞型之hdc的嵌合血凝素的疫苗組合物免疫的對象的血清可用在用第二株完整病毒或病毒顆粒進行的hai測試中,並且測定hai效價。包含vlp的轉基因植物、植物細胞、植物物質或種子的轉化和再生方法已在本領域中建立並為本領域技術人員所知。獲得轉化和再生植物的方法並非本發明的關鍵。「轉化」是指表現為基因型、表型或兩者兼有的遺傳信息(核苷酸序列)在種間的轉移。遺傳信息從嵌合構建體到宿主的種間轉移可以是可遺傳的(即整合到宿主的基因組中),並且認為遺傳信息的轉移是穩定的,或者轉移可以是瞬時的而且該遺傳信息的轉移是不可遺傳的。術語「植物物質」是指來源於植物的任何材料。植物物質可以包括整個植物、組織、細胞或任何其部分。此外,植物物質可以包括細胞內植物成分、細胞外植物成分,植物的液體或固體提取物或其組合。另外,植物物質可以包括來自植物的葉、莖、果實、根或其組合的植物、植物細胞、組織、液體提取物或其組合。植物物質可以包括沒有經受任何處理步驟的植物或其部分。植物部分可以包括植物物質。植物或植物物質可以通過任何方法收集或獲得,例如,可使用整個植株或者特別地移取以用於所述方法的葉或其他組織。表達和分泌vlp的轉基因植物也可以作為本文所述方法的原料使用。本發明的構建體可通過ti質粒、ri質粒、植物病毒載體、直接dna轉化、顯微注射、電穿孔、滲入等引入植物細胞。此類技術的綜述參見例如weissbach和weissbach,methodsforplantmolecularbiology,academypress,newyorkviii,421-463頁(1988年);geierson和corey,plantmolecularbiology,第二版(1988);miki和iyer,fundamentalsofgenetransferinplants,plantmetabolism,第二版.dt.dennis,dhturpin,ddlefebrve,dblayzell編,addison-wesley,langmansltd.london,pp.561-579(1997)。其他方法包括直接dna攝取、使用脂質體、電穿孔例如用原生質體、顯微注射、微彈(microprojectile)或晶須(whisker)和真空滲入。參見例如,bilang等(gene100:247-250(1991年),scheid等(mol.gen.genet.228:104-112,1991年),guerche等(plantscience52:111-116,1987年),neuhause等(theor.applgenet.75:30-36,1987年),klein等,nature327:70-73(1987年);howell等(science208:1265,1980年),horsch等(science227:1229-1231,1985年),deblock等,plantphysiology91:694-701,1989年),methodsforplantmolecularbiology(weissbach和weissbach,eds.,academicpressinc.,1988),methodsinplantmolecularbiology(schuler和zielinski編,academicpressinc.,1989年),liu和lomonossoff(j.virolmeth,105:343-348,2002年),美國專利號4,945,050;5,036,006;5,100,792;6,403,865;5,625,136,均通過引用併入本文。可以使用瞬時表達法表達本發明的構建體(參見liu和lomonossoff,2002,journalofvirologicalmethods,105:343-348;通過引用併入本文)。或者,可以使用基於真空的瞬時表達方法(描述於pct公開wo00/063400、wo00/037663(通過引用併入本文))。這些方法可以包括,例如但不限於農桿菌接種或農桿菌滲入法,但是,還可使用如上所述的其他瞬時方法。對於農桿菌接種或農桿菌滲入,包含期望核酸的農桿菌(agrobacteria)混合物進入組織(例如葉、植物的地上部分(包括莖、葉和花)、植物的其他部分(莖、根、花))或整個植株的細胞間隙。穿過表皮後,農桿菌侵染並將t-dna拷貝傳遞進細胞。t-dna被附加轉錄並且mrna被翻譯,使得所侵染細胞產生目的蛋白質,但t-dna在細胞核內的傳代是瞬時的。通過本發明方法製備的流感vlp可與現有流感疫苗聯合使用,以補充該疫苗使其更為有效或者降低所需的施用劑量。如本領域技術人員已知的,疫苗可針對一種或多於一種的流感病毒。合適疫苗的例子包括但不限於,從sanofi-pasteur、idbiomedical、merial、sinovac、chiron、roche、medimmune、glaxosmithkline、novartis、sanofi-aventis、serono、shirepharmaceuticals等購得的那些。如期望的話,本發明的vlp可以與本領域技術人員已知的合適佐劑相混合。此外,vlp可用於疫苗組合物中,該組合物包含用於治療上述目標生物的有效劑量的vlp。另外,根據本發明生產的vlp可與其他蛋白成分共表達或與其他vlp或流感蛋白質成分(例如神經氨酸酶(na)、m1和m2)重組。它也可以與其他疫苗蛋白(例如瘧疾抗原、hiv抗原、呼吸道合胞體病毒(rsv)抗原等)製得的vlp共表達或重組。本文所述的序列總結如下。本發明將在下面實施例中進一步說明。然而,應理解這些實施例僅用於說明目的,不應以任何方式用於限制本發明的範圍。表達盒的組裝可用於生成vlp的構建體描述於美國臨時申請號61/220,161(於2009年6月24日提交)、wo2009/009876、wo2009/076778和wo2010/003225,它們均通過引用併入本文。構建體還可以包括表2所列的那些。這些構建體的組裝描述於wo2009/009876、wo2009/076778、wo2010/003225和us61/220,161。但還可以將包含已知ha的其他構建體(包括但不限於表2提供的那些)與相似或不同調控元件和啟動子相組合使用來生成本文所述的vlp。表2:可用於生成血凝素的構建體的非限制性實例。cpmv-ht表達盒包含35s啟動子以控制包含目的編碼序列的mrna的表達,該編碼序列的5』端來自豇豆花葉病毒(cpmv)rna2的核苷酸1-512,其中在115和161位有突變的atg,3』端為來自cpmvrna2(對應於3』utr)的核苷酸3330-3481,其後為nos終止子。用質粒pbd-c5-1lc(sainsbury等2008年;plantbiotechnologyjournal6:82-92和pct公開wo2007/135480)組裝基於cpmv-ht的血凝素表達盒。用darveau等(methodsinneuroscience26:77-85(1995))提供的基於pcr的連接方法進行cpmvrna2的115和161位atg突變。用pbd-c5-1lc作為模板進行兩個獨立的pcr。第一擴增的引物是pbinplus.2613c(seqidno:3)和mut-atg115.r(seqidno:4)。第二擴增的引物是mut-atg161.c(seqidno:5)和lc-c5-1.110r(seqidno:6)。然後將兩個片段混合併作為第三擴增的模板,其使用pbinplus.2613c(seqidno:3)和lc-c5-1.110r(seqidno:6)作為引物。用paci和apai消化所得片段並克隆到用同樣的酶消化的pbd-c5-1lc。生成的表達盒命名為828。cpmv-ht表達盒中的h5a/印度尼西亞/5/2005(構建體號685)的組裝該表達盒的組裝描述於wo2009/009876、wo2009/076778和wo2010/003325,其通過引用併入本文。簡言之,如下將來自a/印度尼西亞/5/2005的h5編碼序列克隆到cpmv-ht中:用構建體號660(d'aoust等,plantbiotechnologyjournal6:930-940(2008))作為模板,以apai-h5(a-indo).1c(seqidno:7)和h5(a-indo)-stui.1707r(seqidno:8)為引物進行pcr擴增,以將限制性位點apai(緊鄰起始atg的上遊)和stui(緊鄰終止密碼子的下遊)添加到血凝素編碼序列。構建體660包括苜蓿質體藍素啟動子和5'utr、來自a/印度尼西亞/5/2005的h5血凝素編碼序列(構建體號660)、苜蓿質體藍素3'utr和終止子序列(seqidno:9;圖5)。用apai和stui限制性酶消化所得片段並克隆到預先用同樣的酶消化的構建體號828中。所得表達盒命名為構建體號685(圖1、2)。沉默抑制子。轉錄後基因沉默(ptgs)可參與限制植物中轉基因的表達,共表達馬鈴薯y病毒的沉默抑制子(hcpro)可用於對抗轉基因mrna的特異性降解(brigneti等,1998年)。替代的沉默抑制子是本領域公知的,並且可如本文所述使用(chiba等,2006年,virology346:7-14;通過引用併入本文),它們例如但不限於tev-p1/hc-pro(菸草蝕紋病毒(tobaccoetchvirus)-p1/hc-pro)、byv-p21、番茄叢矮病毒(tomatobushystuntvirus)的p19(tbsvp19)、番茄皺縮病毒(tomatocrinklevirus)的衣殼蛋白(tcv-cp)、黃瓜花葉病毒(cucumbermosaicvirus)的2b;cmv-2b)、馬鈴薯x病毒(potatovirusx)的p25(pvx-p25)、馬鈴薯m病毒(potatovirusm)的p11(pvm-p11)、馬鈴薯s病毒(potatoviruss)的p11(pvs-p11)、藍莓焦枯病毒(blueberryscorchvirus)的p16(bscv-p16)、柑橘腐根病毒(citrustristezavirus)的p23(ctv-p23)、葡萄卷葉相關病毒2(grapevineleafroll-associatedvirus-2)的p24(glrav-2p24)、葡萄a病毒(grapevinevirusa)的p10(gva-p10)、葡萄b病毒(grapevinevirusb)的p14(gvb-p14)、獨活潛伏病毒(heracleumlatentvirus)的p10(hlv-p10)或大蒜普通潛伏病毒(garliccommonlatentvirus)的p16(gclv-p16)。因此,沉默抑制子(例如但不限於hcpro、tev-p1/hc-pro、byv-p21、tbsvp19、tcv-cp、cmv-2b、pvx-p25、pvm-p11、pvs-p11、bscv-p16、ctv-p23、glrav-2p24、gbv-p14、hlv-p10、gclv-p16或gva-p10)可與編碼目的蛋白質的核酸序列一起共表達以進一步確保在植物中高水平地生產蛋白質。p19的構建描述於wo2010/0003225(通過引用併入本文)。簡言之,通過darveau等(methodsinneuroscience26:77-85(1995))提供的基於pcr的連接法將番茄叢矮病毒(tbsv)p19蛋白的編碼序列連到苜蓿質體藍素表達盒。在第一輪pcr中,用構建體660(描述於wo2010/0003225,通過引用併入本文)作為模板,用引物plasto-443c:gtattagtaattagaatttggtgtc(seqidno:11)和supp19-plasto.rccttgtatagctcgttccattttctctcaagatg(seqidno:12)擴增質體藍素啟動子區段。平行地,用引物supp19-1catggaacgagctatacaagg(seqidno:13)和supp19-saci.ragtcgagctcttactcgctttctttttcgaag(seqidno:14),使用voinnet等(theplantjournal33:949-956(2003年))描述的構建體35s:p19作為模板擴增包含p19編碼序列的另一片段。然後混合擴增產物並作為第二輪擴增(組裝反應)的模板,其中使用引物plasto-443c和supp19-saci.r。用bamhi(在質體藍素啟動子中)和saci(p19編碼序列末端)消化所得片段並克隆到預先用同樣的限制性酶消化的構建體號660中,以得到構建體號r472。通過電穿孔(mattanovich等,1989)用質粒轉化根癌農桿菌(agrobacteiumtumefaciens)(agl1;atcc,manassas,va20108,usa)。通過限制性圖譜確認所有根癌農桿菌菌株的完整性。包含r472的根癌農桿菌菌株被命名為「agl1/r472」。按照hamilton等(2002)所述製備hcpro構建體(35hcpro)。測序所有克隆以確認構建體的完整性。通過電穿孔(mattanovich等,1989)用質粒轉化根癌農桿菌(agl1;atcc,manassas,va20108,usa)。通過限制性圖譜確認所有根癌農桿菌株的完整性。植物生物質的製備,接種,農桿菌滲入和收集在填充有市售泥炭蘚培養基的平地(flat)中從種子培育本塞姆氏菸草(nicotianabenthamiana)植株。以16/8的光周期和白天25℃/夜晚20℃的溫度方案在溫室中培育植株。播種後三周,挑選出單個苗,移植到花盆裡並在相同環境條件下的溫室中再培育三周。六周後,植株的平均重量為80g,平均高度為30cm。通過d'aoust等2008(plantbiotechnologyjournal6:930-940)描述的方法,用如下所述的構建體轉染(電穿孔)農桿菌菌株agl1。在補充有10mm2-(n-嗎啉代)乙磺酸(mes)、20μm乙醯丁香酮、50μg/ml卡那黴素和25μg/ml羧苄青黴素的yeb培養基(ph5.6)中培養轉染的農桿菌,至od600為0.6至1.6。在使用前離心農桿菌懸液並用滲入介質(10mmmgcl2和10mmmesph5.6)重懸。通過d'aoust等(同上)描述的農桿菌滲入法處理植株。簡言之,對於真空滲入,離心根癌農桿菌懸液,在滲入介質中重懸,在4℃儲存過夜。在滲入當天,用2.5倍培養體積稀釋培養批次並在使用前溫熱。將整個本塞姆氏菸草植株倒置在20-40託真空下的氣密不鏽鋼罐的細菌懸液中2分鐘。除另外指出,所有的滲入均為與r472轉化細菌(agl1/r472株)以1∶1的比例共同滲入。真空滲入後,將植株被送回溫室孵育4-6天直到收集。葉的取樣和總蛋白質提取(機械勻漿)孵育4、5、6、7和8天後,收集植株的地上部分並立即使用。在3倍體積的含有1%tritonx-100和0.004%焦亞硫酸鈉的冷50mmtrisph8.0,0.15mnacl中通過勻漿植物組織提取總可溶性蛋白。用polytrontm通過杵臼研磨,或在1體積冷50mmtrisph8,0.15mnacl中用comitroltm對植物組織進行機械勻漿。comitroltm使用的緩衝液也包含0.04%焦亞硫酸鈉。勻漿後,在4℃下以5,000g離心地上植物材料的漿液5分鐘,保留粗提物(上清液)進行分析。用牛血清白蛋白作為參照標準,通過bradford測定(bio-rad,hercules,ca)檢測澄清粗提物的總蛋白質含量。通過細胞壁消化提取vlp從本塞姆氏菸草植株收集葉組織並切成~1cm2的片。在室溫(rt)下將葉片浸沒於500mm甘露糖醇中30分鐘。然後去除甘露糖醇溶液並換成酶混合物(原生質體化溶液(500mm甘露糖醇,10mmcacl2和5mmmes/koh(ph5.6)中的來自綠色木黴的纖維素酶混合物(onozukar-10;3%v/v)和來自根黴屬的果膠酶混合物(macerozymetm;0.75%v/v;均購自yakultpharmaceuticals))。使用的比例為每100ml溶液20g葉片。將該製備物均勻分散到淺容器(~11×18cm)中並用旋轉搖床以40rpm和26℃孵育16小時。或者,vlp提取可按如下方法進行:用agl1/#685按照實施例1所述對植株進行農桿菌滲入。在滲入後第6天從本塞姆氏菸草植株收集葉並切成~1cm2的片。以1∶2.5(w/v)的新鮮生物質∶消化緩衝液的比例,將multifect果膠酶fe、multifectcxcg和multifectcxb(genencor)(每個1.0%(v/v))添加到600mm甘露糖醇,75mm檸檬酸鹽,0.04%亞硫酸氫鈉緩衝液(ph6.0)中。在室溫下用軌道搖床消化生物質15小時。孵育後,通過過濾(250或400μm目的尼龍濾器)去除葉碎片。如下收集懸液中的原生質體:以200×g(15分鐘)離心,然後以5000×g(15分鐘)離心上清液以進一步澄清上清液。或者,可進行5000×g、15分鐘的單個離心步驟。然後以70,000×g離心70ml上清液30分鐘。所得沉澱用1.7mlpbs重懸並立即分析或凍存。蛋白質分析h5的凝血測定基於nayak和reichl(2004)描述的方法。簡言之,在含有100μlpbs的v形底96孔微滴定板中對測試樣品(100μl)進行系列兩倍稀釋,每孔留下100μl稀釋的樣品。向每孔加入100μl0.25%火雞紅細胞懸液(biolinkinc.,syracuse,ny),在室溫孵育板2小時。將顯示完全凝血的最高稀釋度的倒數記錄為凝血活性。平行地,用pbs稀釋重組ha5標準(a/越南/1203/2004h5n1)(proteinsciencecorporation,meriden,ct),並在每個板中作為對照。elisa用破碎(用1%tritonx-100處理,隨後在tissuelysertm(qiagen)機械攪拌1分鐘)的純化病毒樣顆粒製備ha5標準。在4℃用50mm碳酸鹽-碳酸氫鹽包被緩衝液(ph9.6)中的10μg/ml捕獲抗體(immunetechnologycorporation,#it-003-005i)包被u形底96孔微滴定板16-18小時。用含有0.1%tween-20的0.01mpbs(磷酸鹽緩衝鹽水)(ph7.4)進行所有洗滌。孵育後,洗滌微滴定板三次並在37℃下用pbs中的1%酪蛋白封閉1小時。封閉步驟後,洗滌板三次。用模擬提取物(製備自用單獨的agl1/r472滲入的葉組織)稀釋ha5標準以獲得500至50ng/ml的標準曲線。在加入微孔板之前用1%tritonx-100處理待定量的樣品。在37℃下再孵育板1小時。洗滌後,加入1∶1000稀釋的針對ha5(cber/fda)的綿羊多克隆抗體,在37℃下孵育板1小時。洗滌後,加入1∶1000稀釋的辣根過氧化物酶綴合的兔抗綿羊抗體,在37℃下孵育板1小時。最後一次洗滌後,在室溫下用surebluetmb過氧化物酶底物(kpl)孵育板20分鐘。加入1nhcl終止反應,用multiskanascent讀板器(thermoscientific)測量a450值。實施例1:酶法提取植物組織釋放相對活性提高的高產量ha。將用本發明酶提取法獲得之ha的量和相對活性與普通機械提取法獲得之ha的數量和相對活性進行比較。用agl1/685滲入本塞姆氏菸草植株,5-6天的孵育期後收集葉。如下製備葉勻漿:用polytron勻漿器將2g葉勻漿;用杵臼研磨4g葉;以及用comitroltm處理機(urschellaboratories)在提取緩衝液(50mmtris,150mmnaclph8.0,比例1∶1w/v)中對25kg葉進行勻漿。酶提取如下進行:用上述macerozyme果膠酶和onozukar-10纖維素酶消化20g收集的葉。消化後,通過過濾(250μm目的尼龍濾器)去除葉碎片。通過以下去除懸液中的原生質體:200×g(15分鐘)離心,然後通過5000×g(15分鐘)離心進一步澄清上清液。每個這些植物提取物中的ha的量和相對活性見表3。與用機械方法相比,酶提取法獲得的ha的量顯著較多。表3:機械和酶提取植物葉獲得的ha的相比的量和相對活性。所有的數據均被調整以計入每個提取方法添加的液體體積差異。為了本發明的比較性分析,選擇comitroltm提取法作為標準值。提取方法相對活性量*comitroltm提取物100%100%polytron提取物50%150%臼提取物100%220%消化提取物440%570%*通過elisa分析對量進行評測實施例2:用酶消化植物組織所釋放的ha組成vlp用差速離心和體積排阻層析(sec)的組合證實通過本文所述的酶提取法獲得的ha組成vlp。如實施例1中所述用agl1/685對本塞姆氏菸草植株進行農桿菌滲入。如實施例1中所述滲入6天後從植株收集葉並切成~1cm2的片,然後消化、粗濾並離心。然後以70,000×g離心澄清樣品以分離vlp。在上樣到sec柱之前,將包含vlp的離心沉澱小心重懸於1/50體積的磷酸鹽緩衝鹽水(pbs;0.1m磷酸鈉,0.15mnaclph7.2)中。用平衡/洗脫緩衝液(50mmtris,150mmnacl,ph8)準備32mlsephacryltms-500高解析度珠(s-500hr:gehealthcare,uppsala,sweden,cat.no.17-0613-10)的sec柱。將1.5mlvlp樣品上樣到平衡好的柱並用45ml平衡/洗脫緩衝液洗脫來進行sec層析。洗脫液收集於1.7ml的級分中,通過將10μl洗脫級分與200μl稀釋的bio-rad蛋白染色劑(bio-rad,hercules,ca)混合來評估每個級分的蛋白含量。每次分離之前均用bluedextran2000(gehealthcarebio-sciencecorp.,piscataway,nj,usa)進行校準。對於每次分離都比較bluedextran2000和宿主蛋白質兩者的洗脫譜,以確保分離的一致性。sec洗脫級分的蛋白質分析以牛血清白蛋白作為參照標準,用bradford測定(bio-rad,hercules,ca)檢測澄清粗提物的總蛋白含量。用丙酮沉澱存在於sec洗脫級分中的蛋白質(bollag等,1996),用0.25體積或0.05體積的變性上樣緩衝液(0.1mtrisph6.8,0.05%溴酚藍,12.5%甘油,4%sds和5%β-巰基乙醇)重懸以分別進行sds-page分析或免疫印跡分析。在還原條件下通過sds-page進行分離,用考馬斯亮藍r-250對蛋白染色。h5的凝血測定基於nayak和reichl(2004)描述的方法。簡言之,在含有100μlpbs的v形底96孔微滴定板中對測試樣品(100μl)進行系列雙倍稀釋,每孔留下100μl稀釋的樣品。向每孔加入100μl0.25%火雞紅細胞懸液(biolinkinc.,syracuse,ny),在室溫孵育板2小時。將顯示完全凝血的最高稀釋度的倒數記錄為凝血活性。平行地,用pbs稀釋重組h5標準(a/越南/1203/2004h5n1)(proteinsciencecorporation,meriden,ct),並在每個板中作為對照。圖3a顯示凝血活性集中在對應於柱空隙體積的級分,證明凝血活性來源於高分子量結構組織。sds-page分析(圖3b)表明那些相同的空隙體積級分(級分7-10)也存在最高的ha含量,其中對應於ha0單體的條帶在約75kda處可檢測到。實施例3:植物組織的酶消化釋放具有更少汙染物的ha-vlp如實施例1中所述以agl1/685對本塞姆氏菸草植株進行農桿菌滲入。如實施例1中所述在滲入後第6天收集葉並切成~1cm2的片,然後消化、粗濾並離心。葉的受控酶消化去除(至少部分地)細胞壁,從而允許存在於細胞壁和質膜間的間隙中的蛋白質和成分釋放入提取基質。由於大多數細胞內蛋白質和成分仍未被破壞並包含在幾乎完整的原生質體中,初始的離心步驟可以去除它們,從而提供包含細胞壁降解酶以及細胞外植物蛋白質和成分(質外體級分)的圖4所示的所得溶液。圖4顯示了上述的葉組織受控酶消化後所獲得的溶液的sds-page分析,其中泳道1顯示所用的酶混合物,泳道2顯示酶消化後所得的溶液。泳道3提供從comitroltm得到的粗提物的蛋白質含量以供比較。生物質:緩衝液的比例對於泳道2的提取物是1∶5(w/v),對於泳道3是1∶1(w/v)。因此泳道2和3各自包含源自等量起始原料的蛋白。對於大約相同的緩衝液:植物比例,機械植物提取物包含濃度約3.5-4mg/ml的蛋白質,而根據本發明方法獲得的酶植物提取物的蛋白質濃度約為1mg/ml。發現泳道3中存在的主要汙染物是rubisco(核酮糖-1,5-二磷酸羧化酶加氧酶),它由兩種蛋白亞基形成:大鏈(l,約55kda)和小鏈(s,約13kda)。通常總共八條大鏈二聚體和八條小鏈彼此之間組裝成較大複合物rubisco540kda。儘管在源自機械提取法的植物提取物中發現大量的該植物蛋白汙染物(如圖4箭頭所示),它幾乎在本文所述酶消化法所獲得的植物提取物中不存在。因此,本方法允許在處理的早期去除該主要的植物蛋白汙染物以及其他汙染物。實施例4:植物組織的酶消化在可以直接用陽離子交換樹脂捕獲ha-vlp的條件下釋放ha-vlp。按照實施例1中所述用agl1/685對本塞姆氏菸草植株進行農桿菌滲入。在滲入後第6天收集葉,切成~1cm2的片,用軌道搖床室溫消化15小時。消化緩衝液包含1.0%(v/v)multifect果膠酶fe,1.0%(v/v)multifectcxcg或和1.0%(v/v)multifectcxb(均購自genencor),每個均在600mm甘露糖醇,75mm檸檬酸鹽,0.04%亞硫酸氫鈉緩衝液(ph6.0)中,使用1∶2.5(w/v)的生物質∶消化緩衝液比例。消化後,將質外體級分用400μm尼龍濾器過濾,以去除粗的未消化的植物組織(<5%的起始生物質)。然後在室溫下以5000×g離心經過濾提取物15分鐘,以去除原生質體和細胞內汙染物(蛋白質、dna、膜、囊泡、色素等)。然後在進行層析之前,用0.65μm玻璃纖維濾器(sartopore2/sartoriusstedim)和0.45/0.2μm濾器深層過濾上清液(以澄清)。將澄清的質外體級分上樣到用平衡/洗脫緩衝液(50mmnapo4,100mmnacl,0.005%tween80ph6.0)平衡好的陽離子交換柱(poroshsappliedbiosystems)。uv回歸到0後,用包含升高濃度的nacl(500mm)的平衡/洗脫緩衝液分步洗脫提取物。必要時,使用裝配有10kdamwco的amicontm裝置將層析級分濃縮10倍。蛋白分析按照之前實施例所述進行。在上述條件下,大多數酶和植物蛋白質不與陽離子交換樹脂結合而ha-vlp結合,從而在洗脫級分中提供ha-vlp的可觀富集(圖6)。此外,如圖6所示,在ph在7以下時泳道4和5的纖維素酶和果膠酶不與陽離子交換柱結合。因此,根據ha凝血活性,ha-vlp的回收在上樣至陽離子交換柱前為92%,在洗脫級分中為66%。在陽離子交換樹脂的洗脫級分中檢測到純化因子為194。實施例5:向消化緩衝液中添加nacl按照實施例1所述用攜帶表達目的血凝素的構建體(h1/calwt,b/flo,h5/indo或h1/calx179a)的農桿菌株agl1對本塞姆氏菸草植株進行農桿菌滲入。在滲入後第6天收集葉,切成~1cm2的片並按照實施例4所述消化(除非以下特別註明)。按照實施例4所述進行過濾、離心和澄清。向消化緩衝液中添加nacl以評估其對ha-vlp回收率的潛在作用。所猜測的優點是可能能夠阻止ha非特異性地與澄清過程中去除的植物細胞或懸液顆粒相關聯,以及可對獲得和/或維持和/或提高ha-vlp的膠體穩定性有潛在作用。向消化緩衝液中加入500mmnacl使得在通過離心去除原生質體和細胞碎片之後,每克生物質的ha-vlp回收得率提高。但是,該提高只見於h1/calwt和b/flo株,而通過這種方法h5的回收得率並沒有顯著提高(表4)。表4:在消化步驟中添加nacl對ha-vlp回收得率的作用(通過凝血活性單位測量,dil:稀釋度的倒數)1有nacl時的得率(dil/g)除以無nacl時的得率(dil/g)對h1/calwt和h1/calx-179a兩毒株,在消化過程中添加500mmnacl進一步使消化過程中ha-vlp釋放增加,這繼而導致澄清後的回收得率提高(表5),但對h5/indo株不是如此。表5:在澄清步驟之後向消化步驟添加nacl對ha-vlp回收得率的作用(通過凝血活性單位測量)1回收率表示為深層過濾後獲得的凝血活性佔離心消化提取物的活性的百分比。在酶消化過程中添加和不添加nacl時,用納米顆粒追蹤分析法(nta)對h5/indo和h1/calwt的ha-vlp的結合狀態進行了分析(分別見圖7a和7b)。在無nacl時進行消化對於h5觀察到顆粒的單分散製備物,而h1/cal製備物顯示顆粒類型更大的陣列。如圖7c中良好的單分散顆粒分布所示,向消化緩衝液中添加nacl降低h1/calha-vlp的自結合。通過向消化緩衝液中添加500mmnacl,150nm的h1/calwt-vlp顆粒數增加(約5倍)。實施例6:色素的控制釋放按照實施例1所述用攜帶表達目的血凝素的構建體(h5/indo)的農桿菌株agl1對本塞姆氏菸草植株進行農桿菌滲入。在滲入後第6天收集葉,切成~1cm2的片,並按照實施例4所述進行消化,其中向消化緩衝液中添加500mmnacl或500mmnacl和25mmedta。按照實施例4所述進行過濾、離心和澄清。酶消化步驟中釋放的綠色成分使純化的vlp製備物呈淺綠色。因此研究並調整細胞壁消化溶液的成分以獲得綠色減少的vlp純化製備物,從而獲得增加的純度。不希望被理論所約束,由於ca2+在將細胞壁的中間片層成分保持在一起中起關鍵作用,並且考慮到植物細胞壁通常具有高濃度的ca2+這一事實,添加ca2+-螯合劑edta可促進細胞壁的酶促解聚,從而保留完整的細胞內細胞器(例如葉綠體),並防止綠色素成分的釋放。見表6,如通過測量製備物吸光度(od672nm-od650nm)差異所評估的,向消化緩衝液中添加25mmedta使純化的h5-vlp製備物的綠色減少。當綠色成分大量釋放或未被適當去除時,vlp製備物表現出的δod>0.040。表6:添加25mmedta至消化緩衝液對h5-vlp產物中的綠色的影響。實施例7:替代性的消化緩衝液成分按照實施例1所述用攜帶表達目的血凝素的構建體(h5/indo)的農桿菌株agl1對本塞姆氏菸草植株進行農桿菌滲入。在滲入後第6天收集葉,切成~1cm2的片並按照實施例4所述進行消化,其中將消化緩衝液改變為包含0%、0.25%、0.5%、0.75%或1%v/vmultifect果膠酶fe、multifectcx-cg纖維素酶和multifectcxb纖維素酶(如表7-9所示)。按照實施例4所述進行過濾、離心和澄清。如下表7和8所示,證實果膠酶在消化緩衝液中不是必需的。在存在或不存在果膠酶的情況下,可以提取到相似水平的h5/indo或h1/calwtvlp。此外,發現與之前實施例相比,降低纖維素酶濃度與對提取質量沒有顯著的影響(表9)。表7:消化本塞姆氏菸草葉後h5/indovlp的釋放。所有的條件均重複測試。(ha-vlp濃度通過凝血活性測量,dil:稀釋度的倒數)*multifectcxgc表8:消化本塞姆氏菸草葉後h1/calwtvlp的釋放。所有的條件均重複測試。(ha-vlp濃度通過凝血活性測量,dil:稀釋度的倒數)*multifectcxgc和multifectcxb每個1%表9:消化本塞姆氏菸草葉後h1/calwtvlp的釋放。所有的條件均進行重複測試。(ha-vlp濃度通過凝血活性檢測,dil:稀釋度的倒數)*multifectcxgc實施例8:接近中性ph條件下的酶消化控制消化過程中的ph對於某些vlp的提取可以是關鍵的。考慮到消化步驟中發生的細胞壁的解聚可以釋放酸性糖,這在適當緩衝液溶液的存在下會使溶液酸化(即ph6至5),並且已證實某些vlp(如包含h3/bris和b/floha的那些)對輕度酸性環境有很強的敏感性,所以研究了這種可能的酸化對vlp產率的影響。按照實施例1所述用攜帶表達目的血凝素的構建體(b/flo、h5/indo、h3/bris)的農桿菌株agl1對本塞姆氏菸草植株進行農桿菌滲入。在滲入後第6天收集葉,切成~1cm2的片並按照實施例4所述進行消化,其中將消化條件改變為包含500mmnacl;25或50mmedta;0.03或0.04%硫酸氫鈉;0、100、200或600mm甘露糖醇,75、125或150mm檸檬酸鹽;和/或75mmnapo4;消化緩衝液ph的調整如表10-14所示。按照實施例4所述進行過濾、離心和澄清。測試不同的消化緩衝液成分是否在酶消化結束時達到約5.5的ph,包括增加的檸檬酸鹽濃度(緩衝能力在ph3.0至5.4之間)和添加磷酸鈉(緩衝能力在ph6.0以上)。表10顯示在消化後ph接近ph6.0時,來自b株的vlp能夠被更有效地提取。表10:消化緩衝液成分對b/flovlp提取率的影響。1所有緩衝液包含600mm甘露糖醇,焦亞硫酸鈉0.04%然後,檢測了為使最終ph值接近ph6.0而在更高ph起始消化的影響。如表11所示,在這種近中性條件下消化植物細胞壁是可以的,並未減少h5/indovlp的提取率。表11:消化緩衝液起始ph對h5/indovlp提取率的影響。1所有消化緩衝液包含600mm甘露糖醇,焦亞硫酸鈉0.04%,125mm檸檬酸鹽+75mmnapo4+500mmnacl+25mmedta還表明調整消化溶液的其他成分對vlp的提取率沒有不利影響。表12顯示了可以對消化溶液進行調整以提高b/flovlp的提取率同時獲得5.4-5.7的消化後ph。這種調整包括提高檸檬酸鹽的濃度和添加po4緩衝液。發現提高edta濃度通常導致更加酸化的提取物和更低的vlp提取率。表12:不同消化緩衝液成分對b/flovlp提取率的影響。1所有緩衝液包含500mmnacl,焦亞硫酸鈉0.04%。進一步調整緩衝液成分以提高h3/布裡斯班vlp的提取率(表13)表13:消化溶液中甘露糖醇和亞硫酸鈉濃度對h3/brisvlp提取率的影響。1所有緩衝液包含125mm檸檬酸鹽,75mmnapo4,500mmnacl,如表12和13所示,甘露糖醇濃度可降至200mm而不顯著影響vlp提取率。進一步降低甘露糖醇濃度到100mm甚至完全不將甘露糖醇添加至消化溶液不會顯著影響獲得的ha-vlp水平(表14)。表14:甘露糖醇濃度不同的緩衝液消化生物質所釋放的h5/indovlp1所有緩衝液包含75mm檸檬酸鹽ph6.0+焦亞硫酸鈉0.04%。2在不含甘露糖醇(實驗1)和含100mm甘露糖醇(實驗2)的情況下進行2個相比於600mm甘露糖醇的實驗以比較vlp的提取率。實施例9:酶消化對多種ha-vlp的適用性本文所述的植物生物質酶消化法有可能被應用到多種ha-vlp的提取中。除了提取之前實施例所示的包含h5/indo、h1/calwtvlp、h3/bris和b/flo的ha-vlp之外,本文所述方法還適用於季節性的h1/bris和h1/nc的ha-vlp的提取,如表15所示。表15:消化農桿菌滲入的本塞姆氏菸草葉所釋放的季節性h1/bris和h1/ncvlp。(ha濃度通過凝血活性測量,dil:稀釋度的倒數)所有引用文獻通過引用併入本文,就像指名每個獨立出版物專門並單獨地通過引用併入本文並在本文中給出全文那樣。本文引用的參考文獻不應理解為或視為承認這些參考文獻是本發明的現有技術。已通過示例方式描述了一個或多個目前優選的本發明實施方案。本發明包括基本如上所述並且參照實施例和附圖的所有實施方案、改變和變化。對本領域技術人員來說顯而易見的是,大量的變化和改變可在不偏離本發明權利要求所限定範圍的情況下獲得。這些修改的例子包括用已知的等同方案替換本發明的任何方面以實質相同的方式獲得同樣的結果。以下部分對應於母案申請的原始權利要求書:1.製備植物來源的vlp的方法,其包括:a.獲取包含定位於質外體的vlp的植物或植物物質,b.產生原生質體/原生質球級分和質外體級分;和,c.回收所述質外體級分,所述質外體級分包含所述植物來源的vlp。2.項1的方法,其中在所述產生步驟(步驟b)中,通過用細胞壁降解酶組合物處理所述植物或植物物質來產生所述質外體級分和原生質體級分。3.項2的方法,其中所述細胞壁降解酶組合物包含一種或多於一種果膠酶、一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。4.項3的方法,其中所述細胞壁降解酶組合物不包含脂肪酶、蛋白酶或果膠酶中的一種或更多種。5.項1的方法,其中在所述獲取步驟(步驟a)中,用編碼選自以下組的蛋白質的核酸序列轉化所述植物:病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白,以及收集所述植物或植物物質。6.項5的方法,其中所述核酸以瞬時方式引入所述植物中。7.項5的方法,其中所述核酸穩定整合進所述植物的基因組。8.項1的方法,其中在所述獲取步驟(步驟a)中,培養所述植物並收集所述植物或植物物質。9.項5的方法,其中所述核酸編碼流感血凝素。10.項1的方法,其中所述植物來源的vlp不包含神經氨酸酶或m蛋白。11.項1的方法,其中所述植物物質選自葉和培養的植物細胞的組。12.項1的方法,其還包括步驟d)從所述質外體級分中純化所述植物來源的vlp。13.項12的方法,其中所述純化步驟包括利用深層過濾來過濾所述質外體級分以產生澄清的提取物,然後用陽離子交換樹脂來層析所述澄清的提取物。14.製備包含植物來源之脂質包膜的植物來源vlp的方法,其包括:a.獲取包含定位於質外體的vlp的植物或植物物質,b.用酶組合物處理所述植物或植物物質,以產生原生質體/原生質球級分和一種或多於一種包含所述vlp的質外體蛋白複合物;以及c.將所述一種或多於一種質外體蛋白複合物與所述原生質體級分分離。15.項14的方法,其中所述酶組合物包含一種或多於一種果膠酶、一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。16.項14的方法,其中所述酶組合物不包含脂肪酶、蛋白酶或果膠酶中的一種或更多種。17.項14的方法,其還包括步驟d)從所述質外體級分中純化所述植物來源的vlp。18.項17的方法,其中所述純化步驟包括利用深層過濾來過濾所述質外體級分以產生澄清的提取物,然後用陽離子交換樹脂來層析所述澄清的提取物。19.項14的方法,其中在所述獲取步驟(步驟a)中,用編碼選自以下組的蛋白質的核酸序列轉化所述植物:病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白,以及收集所述植物或植物物質。20.項19的方法,其中所述核酸以瞬時方式引入所述植物中。21.項19的方法,其中所述核酸穩定整合進所述植物的基因組。22.項14的方法,其中在所述獲取步驟(步驟a)中,培養所述植物並收集所述植物或植物物質。23.項19的方法,其中所述vlp包含流感血凝素。24.項14的方法,其中所述植物物質選自葉和培養的植物細胞的組。25.項14的方法,其中所述vlp不包含神經氨酸酶或m蛋白。26.製備植物來源的vlp的方法,其包括:a.獲取包含植物來源的vlp的植物或植物物質;b.用細胞壁降解酶組合物消化所述植物物質以產生消化級分;c.過濾所述消化級分以產生過濾級分,從所述過濾級分中回收所述植物來源的vlp。27.項26的方法,其中所述細胞壁降解酶組合物包含一種或多於一種果膠酶、一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。28.項27的方法,其中所述細胞壁降解酶組合物包含一種或多於一種果膠酶、一種或多於一種纖維素酶,或者一種或多於一種果膠酶和一種或多於一種纖維素酶。29.項27的方法,其中在所述獲取步驟(步驟a)中,用編碼選自以下組的蛋白質的核酸序列轉化所述植物:病毒包膜蛋白、病毒結構蛋白、病毒衣殼蛋白和病毒外殼蛋白,以及收集所述植物或植物物質。30.項29的方法,其中所述核酸以瞬時方式引入所述植物中。31.項29的方法,其中所述核酸穩定整合進所述植物的基因組。32.項29的方法,其中所述植物來源的vlp包含流感血凝素。33.項27的方法,其中所述植物物質選自葉和培養的植物細胞的組。34.項26的方法,其還包括步驟d)將所述過濾級分中的vlp與細胞碎片和不溶物質分離開。35.項34的方法,其中所述分離步驟通過離心進行。36.項34的方法,其中所述分離步驟通過深層過濾進行。37.項27的方法,其還包括步驟d)從所述過濾級分中純化所述植物來源的vlp。38.項34的方法,其中所述純化步驟包括深層過濾所述過濾級分以產生澄清的提取物,然後用陽離子交換樹脂來層析所述澄清的提取物。medicagoinc.vezina,louis-philippedargis,michelecouture,manonpaquet,danyd'aoust,marc-andre製備植物來源的vlp的方法v82324wo61/244,7862009-09-2214patentinversion3.513067dna人工序列合成的構建體6851ttaattaagaattcgagctccaccgcggaaacctcctcggattccattgcccagctatct60gtcactttattgagaagatagtggaaaaggaaggtggctcctacaaatgccatcattgcg120ataaaggaaaggccatcgttgaagatgcctctgccgacagtggtcccaaagatggacccc180cacccacgaggagcatcgtggaaaaagaagacgttccaaccacgtcttcaaagcaagtgg240attgatgtgatatctccactgacgtaagggatgacgcacaatcccactatccttcgcaag300acccttcctctatataaggaagttcatttcatttggagaggtattaaaatcttaataggt360tttgataaaagcgaacgtggggaaacccgaaccaaaccttcttctaaactctctctcatc420tctcttaaagcaaacttctctcttgtctttcttgcgtgagcgatcttcaacgttgtcaga480tcgtgcttcggcaccagtacaacgttttctttcactgaagcgaaatcaaagatctctttg540tggacacgtagtgcggcgccattaaataacgtgtacttgtcctattcttgtcggtgtggt600cttgggaaaagaaagcttgctggaggctgctgttcagccccatacattacttgttacgat660tctgctgactttcggcgggtgcaatatctctacttctgcttgacgaggtattgttgcctg720tacttctttcttcttcttcttgctgattggttctataagaaatctagtattttctttgaa780acagagttttcccgtggttttcgaacttggagaaagattgttaagcttctgtatattctg840cccaaatttgtcgggcccatggagaaaatagtgcttcttcttgcaatagtcagtcttgtt900aaaagtgatcagatttgcattggttaccatgcaaacaattcaacagagcaggttgacaca960atcatggaaaagaacgttactgttacacatgcccaagacatactggaaaagacacacaac1020gggaagctctgcgatctagatggagtgaagcctctaattttaagagattgtagtgtagct1080ggatggctcctcgggaacccaatgtgtgacgaattcatcaatgtaccggaatggtcttac1140atagtggagaaggccaatccaaccaatgacctctgttacccagggagtttcaacgactat1200gaagaactgaaacacctattgagcagaataaaccattttgagaaaattcaaatcatcccc1260aaaagttcttggtccgatcatgaagcctcatcaggagttagctcagcatgtccatacctg1320ggaagtccctccttttttagaaatgtggtatggcttatcaaaaagaacagtacataccca1380acaataaagaaaagctacaataataccaaccaagaggatcttttggtactgtggggaatt1440caccatcctaatgatgcggcagagcagacaaggctatatcaaaacccaaccacctatatt1500tccattgggacatcaacactaaaccagagattggtaccaaaaatagctactagatccaaa1560gtaaacgggcaaagtggaaggatggagttcttctggacaattttaaaacctaatgatgca1620atcaacttcgagagtaatggaaatttcattgctccagaatatgcatacaaaattgtcaag1680aaaggggactcagcaattatgaaaagtgaattggaatatggtaactgcaacaccaagtgt1740caaactccaatgggggcgataaactctagtatgccattccacaacatacaccctctcacc1800atcggggaatgccccaaatatgtgaaatcaaacagattagtccttgcaacagggctcaga1860aatagccctcaaagagagagcagaagaaaaaagagaggactatttggagctatagcaggt1920tttatagagggaggatggcagggaatggtagatggttggtatgggtaccaccatagcaat1980gagcaggggagtgggtacgctgcagacaaagaatccactcaaaaggcaatagatggagtc2040accaataaggtcaactcaatcattgacaaaatgaacactcagtttgaggccgttggaagg2100gaatttaataacttagaaaggagaatagagaatttaaacaagaagatggaagacgggttt2160ctagatgtctggacttataatgccgaacttctggttctcatggaaaatgagagaactcta2220gactttcatgactcaaatgttaagaacctctacgacaaggtccgactacagcttagggat2280aatgcaaaggagctgggtaacggttgtttcgagttctatcacaaatgtgataatgaatgt2340atggaaagtataagaaacggaacgtacaactatccgcagtattcagaagaagcaagatta2400aaaagagaggaaataagtggggtaaaattggaatcaataggaacttaccaaatactgtca2460atttattcaacagtggcgagttccctagcactggcaatcatgatggctggtctatcttta2520tggatgtgctccaatggatcgttacaatgcagaatttgcatttaaaggcctattttcttt2580agtttgaatttactgttattcggtgtgcatttctatgtttggtgagcggttttctgtgct2640cagagtgtgtttattttatgtaatttaatttctttgtgagctcctgtttagcaggtcgtc2700ccttcagcaaggacacaaaaagattttaattttattaaaaaaaaaaaaaaaaaagaccgg2760gaattcgatatcaagcttatcgacctgcagatcgttcaaacatttggcaataaagtttct2820taagattgaatcctgttgccggtcttgcgatgattatcatataatttctgttgaattacg2880ttaagcatgtaataattaacatgtaatgcatgacgttatttatgagatgggtttttatga2940ttagagtcccgcaattatacatttaatacgcgatagaaaacaaaatatagcgcgcaaact3000aggataaattatcgcgcgcggtgtcatctatgttactagattctagagtctcaagcttcg3060gcgcgcc30672568prt人工序列由seqidno:1編碼的合成的胺基酸2metglulysilevalleuleuleualailevalserleuvallysser151015aspglnilecysileglytyrhisalaasnasnserthrgluglnval202530aspthrilemetglulysasnvalthrvalthrhisalaglnaspile354045leuglulysthrhisasnglylysleucysaspleuaspglyvallys505560proleuileleuargaspcysservalalaglytrpleuleuglyasn65707580prometcysaspglupheileasnvalproglutrpsertyrileval859095glulysalaasnprothrasnaspleucystyrproglyserpheasn100105110asptyrglugluleulyshisleuleuserargileasnhispheglu115120125lysileglnileileprolyssersertrpserasphisglualaser130135140serglyvalserseralacysprotyrleuglyserproserphephe145150155160argasnvalvaltrpleuilelyslysasnserthrtyrprothrile165170175lyslyssertyrasnasnthrasnglngluaspleuleuvalleutrp180185190glyilehishisproasnaspalaalagluglnthrargleutyrgln195200205asnprothrthrtyrileserileglythrserthrleuasnglnarg210215220leuvalprolysilealathrargserlysvalasnglyglnsergly225230235240argmetgluphephetrpthrileleulysproasnaspalaileasn245250255phegluserasnglyasnpheilealaproglutyralatyrlysile260265270vallyslysglyaspseralailemetlyssergluleuglutyrgly275280285asncysasnthrlyscysglnthrprometglyalaileasnserser290295300metprophehisasnilehisproleuthrileglyglucysprolys305310315320tyrvallysserasnargleuvalleualathrglyleuargasnser325330335proglnarggluserargarglyslysargglyleupheglyalaile340345350alaglypheilegluglyglytrpglnglymetvalaspglytrptyr355360365glytyrhishisserasngluglnglyserglytyralaalaasplys370375380gluserthrglnlysalaileaspglyvalthrasnlysvalasnser385390395400ileileasplysmetasnthrglnpheglualavalglyarggluphe405410415asnasnleugluargargilegluasnleuasnlyslysmetgluasp420425430glypheleuaspvaltrpthrtyrasnalagluleuleuvalleumet435440445gluasngluargthrleuaspphehisaspserasnvallysasnleu450455460tyrasplysvalargleuglnleuargaspasnalalysgluleugly465470475480asnglycysphegluphetyrhislyscysaspasnglucysmetglu485490495serileargasnglythrtyrasntyrproglntyrserglugluala500505510argleulysargglugluileserglyvallysleugluserilegly515520525thrtyrglnileleuseriletyrserthrvalalaserserleuala530535540leualailemetmetalaglyleuserleutrpmetcysserasngly545550555560serleuglncysargilecysile565324dna人工序列合成的寡核苷酸pbinplus.2613c3aggaagggaagaaagcgaaaggag24456dna人工序列合成的寡核苷酸mut-atg115.r4gtgccgaagcacgatctgacaacgttgaagatcgctcacgcaagaaagacaagaga56552dna人工序列合成的寡核苷酸mut-atg161.c5gttgtcagatcgtgcttcggcaccagtacaacgttttctttcactgaagcga52625dna人工序列合成的寡核苷酸lc-c5-1.110r6tctcctggagtcacagacagggtgg25739dna人工序列合成的寡核苷酸apai-h5(a-indo).1c7tgtcgggcccatggagaaaatagtgcttcttcttgcaat39837dna人工序列合成的寡核苷酸h5(a-indo)-stui.1707r8aaataggcctttaaatgcaaattctgcattgtaacga3793111dna人工序列合成的寡核苷酸構建體6609agaggtaccccgggctggtatatttatatgttgtcaaataactcaaaaaccataaaagtt60taagttagcaagtgtgtacatttttacttgaacaaaaatattcacctactactgttataa120atcattattaaacattagagtaaagaaatatggatgataagaacaagagtagtgatattt180tgacaacaattttgttgcaacatttgagaaaattttgttgttctctcttttcattggtca240aaaacaatagagagagaaaaaggaagagggagaataaaaacataatgtgagtatgagaga300gaaagttgtacaaaagttgtaccaaaatagttgtacaaatatcattgaggaatttgacaa360aagctacacaaataagggttaattgctgtaaataaataaggatgacgcattagagagatg420taccattagagaatttttggcaagtcattaaaaagaaagaataaattatttttaaaatta480aaagttgagtcatttgattaaacatgtgattatttaatgaattgatgaaagagttggatt540aaagttgtattagtaattagaatttggtgtcaaatttaatttgacatttgatcttttcct600atatattgccccatagagtcagttaactcatttttatatttcatagatcaaataagagaa660ataacggtatattaatccctccaaaaaaaaaaaacggtatatttactaaaaaatctaagc720cacgtaggaggataacaggatccccgtaggaggataacatccaatccaaccaatcacaac780aatcctgatgagataacccactttaagcccacgcatctgtggcacatctacattatctaa840atcacacattcttccacacatctgagccacacaaaaaccaatccacatctttatcaccca900ttctataaaaaatcacactttgtgagtctacactttgattcccttcaaacacatacaaag960agaagagactaattaattaattaatcatcttgagagaaaatggagaaaatagtgcttctt1020cttgcaatagtcagtcttgttaaaagtgatcagatttgcattggttaccatgcaaacaat1080tcaacagagcaggttgacacaatcatggaaaagaacgttactgttacacatgcccaagac1140atactggaaaagacacacaacgggaagctctgcgatctagatggagtgaagcctctaatt1200ttaagagattgtagtgtagctggatggctcctcgggaacccaatgtgtgacgaattcatc1260aatgtaccggaatggtcttacatagtggagaaggccaatccaaccaatgacctctgttac1320ccagggagtttcaacgactatgaagaactgaaacacctattgagcagaataaaccatttt1380gagaaaattcaaatcatccccaaaagttcttggtccgatcatgaagcctcatcaggagtt1440agctcagcatgtccatacctgggaagtccctccttttttagaaatgtggtatggcttatc1500aaaaagaacagtacatacccaacaataaagaaaagctacaataataccaaccaagaggat1560cttttggtactgtggggaattcaccatcctaatgatgcggcagagcagacaaggctatat1620caaaacccaaccacctatatttccattgggacatcaacactaaaccagagattggtacca1680aaaatagctactagatccaaagtaaacgggcaaagtggaaggatggagttcttctggaca1740attttaaaacctaatgatgcaatcaacttcgagagtaatggaaatttcattgctccagaa1800tatgcatacaaaattgtcaagaaaggggactcagcaattatgaaaagtgaattggaatat1860ggtaactgcaacaccaagtgtcaaactccaatgggggcgataaactctagtatgccattc1920cacaacatacaccctctcaccatcggggaatgccccaaatatgtgaaatcaaacagatta1980gtccttgcaacagggctcagaaatagccctcaaagagagagcagaagaaaaaagagagga2040ctatttggagctatagcaggttttatagagggaggatggcagggaatggtagatggttgg2100tatgggtaccaccatagcaatgagcaggggagtgggtacgctgcagacaaagaatccact2160caaaaggcaatagatggagtcaccaataaggtcaactcaatcattgacaaaatgaacact2220cagtttgaggccgttggaagggaatttaataacttagaaaggagaatagagaatttaaac2280aagaagatggaagacgggtttctagatgtctggacttataatgccgaacttctggttctc2340atggaaaatgagagaactctagactttcatgactcaaatgttaagaacctctacgacaag2400gtccgactacagcttagggataatgcaaaggagctgggtaacggttgtttcgagttctat2460cacaaatgtgataatgaatgtatggaaagtataagaaacggaacgtacaactatccgcag2520tattcagaagaagcaagattaaaaagagaggaaataagtggggtaaaattggaatcaata2580ggaacttaccaaatactgtcaatttattcaacagtggcgagttccctagcactggcaatc2640atgatggctggtctatctttatggatgtgctccaatggatcgttacaatgcagaatttgc2700atttaagagctctaagttaaaatgcttcttcgtctcctatttataatatggtttgttatt2760gttaattttgttcttgtagaagagcttaattaatcgttgttgttatgaaatactatttgt2820atgagatgaactggtgtaatgtaattcatttacataagtggagtcagaatcagaatgttt2880cctccataactaactagacatgaagacctgccgcgtacaattgtcttatatttgaacaac2940taaaattgaacatcttttgccacaactttataagtggttaatatagctcaaatatatggt3000caagttcaatagattaataatggaaatatcagttatcgaaattcattaacaatcaactta3060acgttattaactactaattttatatcatcccctttgataaatgatagtaca31111026prt紫花苜蓿(medicagosativa)10metalalysasnvalalailepheglyleuleupheserleuleuleu151015leuvalproserglnilephealagluglu20251125dna人工序列合成的寡核苷酸plasto-443c11gtattagtaattagaatttggtgtc251234dna人工序列合成的寡核苷酸supp19-plasto.r12ccttgtatagctcgttccattttctctcaagatg341320dna人工序列合成的寡核苷酸supp19-1c13atggaacgagctatacaagg201432dna人工序列合成的寡核苷酸supp19-saci.r14agtcgagctcttactcgctttctttttcgaag32當前第1頁12
