如何理解水溶液中的離子平衡(水溶液中的離子平衡)
2023-05-14 06:38:28 1
如何理解水溶液中的離子平衡? 水溶液中的離子平衡,下面我們就來說一說關於如何理解水溶液中的離子平衡?我們一起去了解並探討一下這個問題吧!
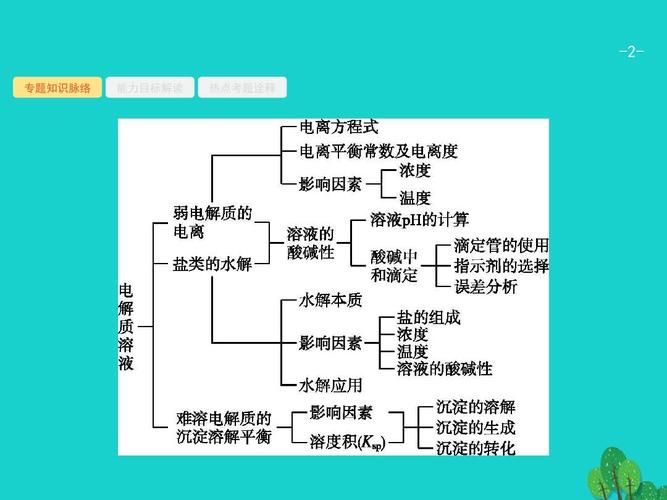
如何理解水溶液中的離子平衡
水溶液中的離子平衡
1. [2014·山東卷] 已知某溫度下CH3COOH和NH3·H2O的電離常數相等,現向10 mL濃度為0.1 mol·L-1的CH3COOH溶液中滴加相同濃度的氨水,在滴加過程中( )
A.水的電離程度始終增大 B.先增大再減小
C.c(CH3COOH)與c(CH3COO-)之和始終保持不變 D.當加入氨水的體積為10 mL時,c(NH)=c(CH3COO-)
2.[2014·新課標全國卷Ⅱ] 一定溫度下,下列溶液的離子濃度關係式正確的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀釋10倍後,其pH=b,則a=b+1
C.pH=2的H2C2O4溶液與pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三種溶液的c(Na+):①>②>③
3. [2013·海南卷] 0.1 mol/L HF溶液的pH=2,則該溶液中有關濃度關係式不正確的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF) C.c(OH-)>c(HF) D.c(HF)>c(F-)
4. [2014·福建卷] 下列關於0.10 mol·L-1 NaHCO3溶液的說法正確的是( )
A.溶質的電離方程式為NaHCO3===Na++H++CO B.25 ℃時,加水稀釋後,n(H+)與n(OH-)的乘積變大
C.離子濃度關係:c(Na+)+c(H+)=c(OH-)+c(HCO)+c(CO) D. 溫度升高,c(HCO)增大
5. [2014·天津卷] 下列有關電解質溶液中粒子濃度關係正確的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO)+c(OH-)
B.含有AgCl和AgI固體的懸濁液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO)=2c(CO)
D.含等物質的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O)+c(C2O)+c(H2C2O4)]
6. [2014·新課標全國卷Ⅱ] 一定溫度下,下列溶液的離子濃度關係式正確的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀釋10倍後,其pH=b,則a=b+1
C.pH=2的H2C2O4溶液與pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三種溶液的c(Na+):①>②>③
7. [2014·海南卷] 室溫下,用0.100 mol·L-1 NaOH溶液分別滴定20.00 mL 0.100 mol·L-1的鹽酸和醋酸,滴定曲線如圖所示。下列說法正確的是( )
A.Ⅱ表示的是滴定醋酸的曲線
B.pH=7時,滴定醋酸消耗的V(NaOH)小於20 mL
C.V(NaOH)=20.00 mL時,兩份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00 mL時,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
8. [2014·安徽卷] 室溫下,下列溶液中粒子濃度關係正確的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
9. [2014·新課標全國卷Ⅰ] 化學與社會、生活密切相關。對下列現象或事實的解釋正確的是( )
選項 | 現象或事實 | 解釋 |
A. | 用熱的純鹼溶液洗去油汙 | Na2CO3可直接與油汙反應 |
B. | 源白粉在空氣中久置變質 | 漂白粉中的CaCl2與空氣中的CO2反應生成CaCO3 |
C. | 施肥時,草木灰(有效成分為K2CO3)不能與NH4Cl混合使用 | K2CO3與HN4Cl反應生成氨氣會降低肥效 |
D. | FeCl3溶液可用於銅質印刷線路板製作 | FeCl3能從含Cu2+的溶液中置換出銅 |
10.[2014·重慶卷] 下列敘述正確的是( )
A.濃氨水中滴加FeCl3飽和溶液可製得Fe(OH)3膠體
B.CH3COONa溶液中滴加少量濃鹽酸後c(CH3COO-)增大
C.Ca(HCO3)2溶液與過量NaOH溶液反應可得到Ca(OH)2
D.25 ℃時Cu(OH)2在水中的溶解度大於其在Cu(NO3)2溶液中的溶解度
11. [2014·新課標全國卷Ⅰ] 利用如圖所示裝置進行下列實驗,能得出相應實驗結論的是( )
選項 | ① | ② | ③ | 實驗結論 |
A. | 稀硫酸 | Na2S | AgNO3與 AgCl的濁液 | Ksp(AgCl)> Ksp(Ag2S) |
B. | 濃硫酸 | 蔗糖 | 溴水 | 濃硫酸具有脫水性、氧化性 |
C. | 稀鹽酸 | Na2SO3 | Ba(NO3)2溶液 | SO2與可溶性 鋇鹽均可生成 白色沉澱 |
D. | 濃硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸> 碳酸>矽酸 |
12. [2014·新課標全國卷Ⅰ] 溴酸銀(AgBrO3)溶解度隨溫度變化的曲線如圖所示,下列說法錯誤的是( )
A.溴酸銀的溶解是放熱過程
B.溫度升高時溴酸銀溶解速率加快
C.60 ℃時溴酸銀的Ksp約等於6×10-4
D.若硝酸鉀中含有少量溴酸銀,可用重結晶方法提純
13. [2014·安徽卷] 中學化學中很多「規律」都有其適用範圍,下列根據有關「規律」推出的結論正確的是( )
選項 | 規律 | 結論 |
A | 較強酸可以製取較弱酸 | 次氯酸溶液無法製取鹽酸 |
B | 反應物濃度越大,反應速率越快 | 常溫下,相同的鋁片中分別加入足量的濃、稀硝酸,濃硝酸中鋁片先溶解完 |
C | 結構和組成相似的物質,沸點隨相對分子質量增大而升高 | NH3的沸點低於PH3 |
D | 溶解度小的沉澱易向溶解度更小的沉澱轉化 | ZnS沉澱中滴加CuSO4溶液可以得到CuS沉澱 |
14. [2014·江蘇卷] 25 ℃時,下列有關溶液中微粒的物質的量濃度關係正確的是( )
A.0.1 mol·L-1CH3COONa溶液與0.1 mol·L-1HCl溶液等體積混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液與0.1 mol·L-1氨水等體積混合(pH>7):c(NH3·H2O)>c(NH)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液與0.1 mol·L-1NaHCO3溶液等體積混合:
c(Na+)=c(CO)+c(HCO)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液與0.1 mol·L-1HCl溶液等體積混合(H2C2O4為二元弱酸):
2c(C2O)+c(HC2O)+c(OH-)=c(Na+)+c(H+)
15. [2014·廣東卷] 常溫下,0.2 mol·L-1的一元酸HA與等濃度NaOH溶液等體積混合後,所得溶液中部分微粒組分及濃度如圖所示,下列說法正確的是( )
A.HA為強酸 B.該混合溶液pH=7.0
C.該混合溶液中:c(A-)+c(Y)=c(Na+) D.圖中X表示HA,Y表示OH-,Z表示H+
16. [2014·四川卷] 下列溶液中粒子的物質的量濃度關係正確的是( )
A.0.1 mol/L NaHCO3溶液與0.1 mol/L NaOH溶液等體積混合,所得溶液中:c(Na+)>c(CO)>c(HCO)>c(OH-)
B.20 mL 0.1 mol/L CH3COONa溶液與10 mL 0.1 mol/L HCl溶液混合後溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室溫下,pH=2的鹽酸與pH=12的氨水等體積混合,所得溶液中:c(Cl-)+c(H+)>c(NH)+c(OH-)
D.0.1 mol/L CH3COOH溶液與0.1 mol/L NaOH溶液等體積混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
17.[2014·北京東城區期末] 關於常溫下,pH=2的醋酸溶液的敘述正確的是( )
A.c(CH3COOH)=0.01 mol/L B.c(H+)=c(CH3COO-)
C.加水稀釋100倍後,pH=4 D.加入醋酸銨固體,可抑制醋酸的電離
18.[2014·重慶六校聯考] 常溫常壓時,下列敘述不正確的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三種溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
B.pH=5的下列溶液(①NH4Cl溶液;②CH3COOH溶液;③稀鹽酸)中c(H+)水:①>②>③
C.pH=11的NaOH溶液與pH=3的醋酸溶液等體積混合後,滴入石蕊溶液呈紅色
D.0.1 mol/L的醋酸溶液的pH=a,0.01 mol/L的醋酸溶液的pH=b,則b<a+1
19.[2014·開封一模] 下列說法正確的是( )
A.0.1 mol/L (NH4)2SO4溶液中的c(NH)c(CH3COO-)
20.[2014·江西新餘期末] 下列說法正確的是( )
A.除零族元素外,短周期元素的最高化合價在數值上都等於該元素所屬的族序數
B.已知MgCO3的Ksp=6.82×10-6,則在含有固體MgCO3的MgCl2溶液和Na2CO3溶液中,都有c(Mg2+)=c(CO),且c(Mg2+)·c(CO)=6.82×10-6
C.Ksp(AB2)小於Ksp(CD),說明AB2的溶解度小於CD的溶解度
D.常溫下,反應C(s)+CO2(g)===2CO(g)不能自發進行,則該反應的ΔH>0
21.[2014·開封質檢] 25 ℃時,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。該溫度下,下列說法不正確的是( )
A.向同濃度的Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先析出
B.向BaCO3的懸濁液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的懸濁液中,=
D.向BaSO4的懸濁液中加入Na2CO3的濃溶液,BaSO4不可能轉化為BaCO3
22.[2014·山東威海一模] 已知難溶性物質K2SO4·MgSO4·2CaSO4在水中存在如下平衡:K2SO4·MgSO4·2CaSO4(s) 2Ca2++2K++Mg2++4SO。不同溫度下,K+的浸出濃度與溶浸時間的關係如圖K271所示,則下列說法錯誤的是( )
A.向該體系中加入飽和NaOH溶液,溶解平衡向右移動
B.向該體系中加入飽和碳酸鈉溶液,溶解平衡向右移動
C.升高溫度,反應速率增大,平衡向正反應方向移動
D.該平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO)
23. [2014·山東卷] 研究氨氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2 ΔH2」「7的原因是__________________________(用離子方程式表示)。
(4)將X、Y、Z各1 mol同時溶於水中製得混合溶液,則混合溶液中各離子的濃度由大到小的順序為____________________________________。
(5)Z溶液與W溶液混合加熱,可產生一種無色無味的單質氣體,該反應的化學方程式為____________ _______。
26.[2014·四川涼山州二診] 按要求回答下列問題:
(1)實驗室中通常用NaOH溶液進行洗氣和提純,當用100 mL 3 mol/L的NaOH溶液吸收標準狀況下4.48 L CO2時,所得溶液中各離子濃度由大到小的順序為______________________________________________。
(2)常溫下,向一定體積的0.1 mol/L的醋酸溶液中加水稀釋後,下列說法正確的是________。
A.溶液中導電粒子的數目減少 B.醋酸的電離程度增大,c(H+)亦增大
C.溶液中不變 D.溶液中減小
(3)①常溫下將0.15 mol/L的稀硫酸V1 mL與0.1 mol/L的NaOH溶液V2 mL混合,所得溶液的pH為1,則V1∶V2=__________(溶液體積的變化忽略不計)。
②常溫下若溶液由pH=3的HA溶液V1 mL與pH=11的NaOH溶液V2 mL混合而得,則下列說法正確的是
A.若混合後溶液呈中性,則c(H+)+c(OH-)=2×10-7mol/L B.若V1=V2,混合後溶液的pH一定等於7
C.若混合後溶液呈酸性,則V1一定大於V2 D.若混合後溶液呈鹼性,則V1一定小於V2
(4)常溫下,濃度均為0.1 mol/L的下列五種溶液的pH如表所示:
溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根據表中數據,將濃度均為0.01 mol/L的下列四種酸的溶液分別稀釋100倍,pH變化最小的是__________。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根據以上數據,判斷下列反應可以成立的是________。
A.CH3COOH+Na2CO3===NaHCO3+CH3COONa B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2+H2O+2NaClO===Na2CO3+2HClO D.NaHCO3+HCN===NaCN+H2O+CO2↑
(5)幾種離子開始沉澱時的pH如下表:
離子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
當向含相同濃度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液時,________(填離子符號)先沉澱,Ksp[Fe(OH)2]________Ksp[Mg(OH)2](填「>」「=」或「 不變 升高溫度
(3)c(NO)>c(NO)>c(CH3COO-) b、c
24.(1)H3PO2H2PO+H+ (2)①+1 ②H3PO4 ③正鹽 弱鹼性
(3)2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
(4)①2H2O-4e-===O2↑+4H+
②陽極室的H+穿過陽膜擴散至產品室,原料室的H2PO穿過陰膜擴散至產品室,二者反應生成H3PO2 ③PO H2PO或H3PO2被氧化
25.(1)NaOH NH4NO3 (2)NH4NO3===NH+NO (3)NO+H2OHNO2+OH-
(4)c(Na+)>c(NO)>c(NO)>c(OH-)>c(H+) (5)NaNO2+NH4NO3===NaNO3+N2↑+2H2O
26.(1)c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+) (2)CD (3)①1∶1 ②AD (4)①A ②AB (5)Cu2+ <
,





![2022愛方向和生日是在[質量個性]中](http://img.xinsiji.cc/20220215/1604989894118215680.jpg)



