拮抗CD40之抗體多肽的製作方法
2023-05-13 21:30:37
本發明是基於申請日為2012年4月20日,申請號為「201280030683.4」(國際申請號為pct/us2012/034519),發明名稱為「拮抗cd40之抗體多肽」的專利申請的分案申請。
發明領域
本發明提供靶向cd40且不展現cd40促效劑活性之抗體及其片段、包含前述者之組合物及使用前述者治療涉及cd40活性之疾病的方法。
相關申請的交叉引用
本發明要求2011年4月21日提交的美國臨時申請61/477,904的權益,在此將其全部內容援引併入本申請。
序列表
本申請案含有ascii格式之序列表且其據此以全文引用的方式併入本文中。2012年4月17日創建之該ascii複本被命名為200896wo.txt且大小為1,188,530位元組。
現有技術
cd40為屬於存在於抗原呈現細胞(antigenpresentingcell,apc)(包括樹突狀細胞、b細胞及巨噬細胞)上之腫瘤壞死因子(tumornecrosisfactor,tnf)受體超家族之協同刺激分子。apc在cd40結合th細胞上之其配位體cd154(cd40l)時活化。cd40介導之apc活化涉及多種免疫反應,包括細胞激素產生、協同刺激分子(諸如cd86)之上調及抗原呈現及b細胞增殖增強。cd40亦可由內皮細胞、平滑肌細胞、纖維母細胞及上皮細胞表現。
cd40活化亦涉及多種與例如自體免疫性、移植排斥反應或過敏反應相關之不當t細胞反應。控制不合乎需要之t細胞反應的一個策略為以拮抗性抗體靶向cd40。舉例而言,先前稱為chiron1212之單株抗體hcd122(魯卡木單抗(lucatumumab))有關治療某些cd40介導之發炎性疾病目前處於臨床試驗階段。參見網際網路之超文本傳送協議:clinicaltrialsfeeds.org/clinical-trials/show/nct01275209(2011年1月11日最後更新)上之「studyofhcd122(lucatumumab)andbendamustinecombinationtherapyincd40+rituximab-refractoryfollicularlymphoma」,clinicaltrialsfeeds。然而,單株抗體可顯示促效劑活性。舉例而言,抗cd40抗體chi220之適用性受限於其弱刺激潛能。參見adams等人,「developmentofachimericanti-cd40monoclonalantibodythatsynergizeswithlea29ytoprolongisletallograftsurvival」,j.immunol.174:542-50(2005)。
技術實現要素:
在臨床環境中仍需要不具有部分促效劑活性之抗cd40抗體拮抗劑。本發明提供特異性結合人類cd40之新穎抗原決定基之新穎抗體多肽。如由競爭分析及由自抗體多肽與cd40共結晶得到之結構所示,cd40抗原決定基不與chi220抗原決定基重迭。該等抗體多肽有利的是不展現cd40促效劑活性。該等抗體多肽適用於治療涉及cd40活化之疾病,包括自體免疫疾病、移植排斥反應及過敏反應。該等抗體多肽包含可變域。在一個實施例中,抗體多肽呈含有單一可變域之域抗體(dab)形式。在另一個實施例中,dab為包含可結合例如人類血清白蛋白(hsa)之第二可變域之雙特異性試劑。
本發明提供一種包含第一可變域之抗體多肽,其中該抗體多肽特異性結合人類cd40之抗原決定基,其中該抗原決定基包含seqidno:1之胺基酸序列,其中該抗體多肽與域抗體(dab)bms3h-56-269(seqidno:417)競爭結合,且其中該抗原決定基包含至少一個選自由trp109、leu121、his122、ser124、ser156、ala157、phe158、glu159及his162組成之群的cd40胺基酸殘基。
進一步提供一種抗體多肽,其中第一可變域包含選自由bms3h-37、bms3h-38、bms3h-56及bms3h-198組成之譜系群的抗體多肽之一之胺基酸序列,且其中第一可變域之表觀結合常數為1pm至100nm。進一步提供一種抗體多肽,其中第一可變域之表觀結合常數為1pm至10nm。
亦提供一種抗體多肽,其中第一可變域之胺基酸序列包含(a)與bms3h-56-269(seqidno:417)之cdr1區有至多兩個胺基酸不同的cdr1區、(b)與bms3h-56-269(seqidno:417)之cdr2區有至多兩個胺基酸不同的cdr2區、(c)與bms3h-56-269(seqidno:417)之cdr3區有至多兩個胺基酸不同的cdr3區、(d)與bms3h-56-269(seqidno:417)之fr1區有至多兩個胺基酸不同的fr1區、(e)與bms3h-56-269(seqidno:417)之fr2區有至多兩個胺基酸不同的fr2區、(f)與bms3h-56-269(seqidno:417)之fr3區有至多兩個胺基酸不同的fr3區及(g)與bms3h-56-269(seqidno:417)之fr4區有至多兩個胺基酸不同的fr4區。
亦提供一種抗體多肽,其中第一可變域之胺基酸序列包含(a)與bms3h-56-269(seqidno:417)之cdr1區有至多兩個胺基酸不同的cdr1區、(b)與bms3h-56-269(seqidno:417)之cdr2區有至多兩個胺基酸不同的cdr2區、(c)與bms3h-56-269(seqidno:417)之cdr3區有至多兩個胺基酸不同的cdr3區。
進一步提供一種抗體多肽,其中第一可變域之胺基酸序列與bms3h-56-258(seqidno:10)或bms3h-56-269(seqidno:417)之胺基酸序列有至多10個胺基酸不同。
進一步提供一種抗體多肽,其中第一可變域之胺基酸序列與bms3h-56-258(seqidno:10)或bms3h-56-269(seqidno:417)之胺基酸序列有至多5個胺基酸不同。
進一步提供一種抗體多肽,其中第一可變域之胺基酸序列與bms3h-56-258(seqidno:10)或bms3h-56-269(seqidno:417)之胺基酸序列有兩個胺基酸不同。
進一步提供一種抗體多肽,其中第一可變域之胺基酸序列與bms3h-56-258(seqidno:10)或bms3h-56-269(seqidno:417)之胺基酸序列有一個胺基酸不同。
進一步提供一種抗體多肽,其中該抗體多肽選自bms3h-56之譜系群,且其中第一可變域之胺基酸序列進一步包含:(a)具有序列x1-tyr-glu-y1-trp(seqidno:1274)之cdr1區,其中x1為asp或gly,且y1為met或leu;(b)具有序列ala-ile-asn-pro-x2-gly-y2-z2-thr-tyr-tyr-ala-asp-ser-val-a2-gly(seqidno:1275)之cdr2區,其中x2為gln、tyr、pro、trp或ala,y2為thr、ser、asn、gly、met或gln,z2為arg、leu、tyr、his或phe,且a2為lys或met;及(c)具有序列x3-pro-y3-z3-phe-a3-b3(seqidno:1276)之cdr3區,其中x3為leu或pro,y3為phe、gln、thr或met,z3為tyr、pro、leu、thr、ile、phe或met,a3為gln、his、asp、ser、lys、glu或gly,且b3為glu、asp或tyr。
進一步提供一種抗體多肽,其中第一可變域之胺基酸序列包含:(a)具有序列glu-val-gln-leu-leu-glu-ser-gly-gly-gly--leu-val-gln-pro-gly-gly-ser-x1-arg-leu-ser-cys-ala-ala-ser-gly-phe-thr-phe-y1(seqidno:1277)之fr1區,其中x1為leu或arg,且y1為arg或ala;(b)具有序列trp-val-arg-x2-ala-pro-gly-y2-z2-leu-glu-arg-val-ser(seqidno:1278)之fr2區,其中x2為gln或arg,y2為lys或arg,且z2為gly或val;(c)具有序列arg-phe-thr-ile-ser-arg-asp-asn-ser-lys-asn-x3-lys-tyr-leu-gln-met-asn-ser-leu-arg-ala-y3-asp-thr-z3-val-tyr-a3-cys-b3-lys(seqidno:1279)之fr3區,其中x3為thr或met,y3為glu或asp,z3為ala或ser,a3為tyr或his,且b3為ala或thr;及(d)具有序列x4-gly-y4-gly-thr-leu-val-thr-val-ser-z4(seqidno:1280)之fr4區,其中x4為trp或arg,y4為gln或pro,且z4為ser或asn。
進一步提供一種抗體多肽,其中第一可變域包含bms3h-56-258(seqidno:10)或bms3h-56-269(seqidno:417)之胺基酸序列。
進一步提供一種抗體多肽,其中該抗體多肽選自bms3h-37之譜系群,其中第一可變域包含序列glu-val-gln-leu-leu-glu-ser-gly-gly-gly-leu-val-x1-pro-gly-gly-ser-leu-arg-leu-ser-cys-ala-ala-ser-gly-phe-thr-phe-glu-trp-tyr-glu-met-gln-trp-val-arg-arg-ala-pro-gly-lys-gly-leu-glu-trp-val-ser-ala-ile-ser-gly-asp-gly-tyr-arg-thr-tyr-tyr-ala-asp-ser-val-lys-gly-arg-phe-thr-ile-ser-arg-asp-asn-ser-lys-asn-thr-leu-tyr-leu-gln-met-asn-ser-leu-arg-ala-glu-asp-thr-ala-val-tyr-tyr-cys-ala-lys-y1-leu-z1-a1-phe-asp-tyr-b1-gly-arg-gly-thr-leu-val-thr-val-ser-ser(seqidno:1281);且其中x1為gln或arg;y1為glu或gly;z1為ala、leu或glu;a1為phe
或tyr;且b1為trp或arg。
亦提供一種抗體多肽,其中該抗體多肽選自bms3h-38之譜系群,其中第一可變域包含序列glu-val-gln-leu-leu-ala-ser-gly-gly-gly-leu-val-gln-pro-gly-gly-ser-leu-arg-leu-ser-cys-ala-ala-ser-gly-phe-x1-phe-glu-glu-glu-glu-met-ile-trp-val-arg-gln-ala-pro-gly-lys-gly-leu-glu-trp-val-ser-y1-ile-ser-z1-a1-gly-b1-c1-thr-tyr-tyr-ala-asp-ser-val-lys-gly-arg-phe-thr-ile-ser-arg-asp-asn-ser-lys-asn-thr-leu-tyr-leu-gln-met-asn-ser-leu-arg-ala-glu-asp-thr-ala-val-tyr-tyr-cys-gly-lys-glu-pro-phe-d1-tyr-asp-tyr-trp-gly-gln-gly-thr-leu-val-thr-val-ser-ser(seqidno:1282);且其中x1為thr或pro;y1為ala或ser;z1為arg或gly;a1為arg、ser、asn、gln、gly、his或leu;b1為tyr、phe、trp或gly;
c1為ser或gly;且d1為arg、met或pro。
亦提供一種抗體多肽,其中該抗體多肽選自bms3h-198之譜系群,其中第一可變域包含序列glu-val-gln-leu-leu-glu-ser-gly-gly-gly-leu-val-gln-pro-gly-gly-ser-leu-arg-leu-ser-cys-ala-ala-ser-gly-phe-thr-phe-ala-gly-try-glu-x1-trp-trp-y1-arg-gln-ala-pro-gly-lys-gly-leu-glu-arg-val-ser-ala-ile-ser-gly-ser-gly-gly-ser-thr-tyr-tyr-ala-asp-ser-val-lys-gly-arg-phe-thr-ile-ser-arg-asp-z1-a1-lys-asn-thr-leu-tyr-leu-gln-met-asn-ser-leu-arg-ala-glu-asp-thr-ala-val-tyr-b1-cys-ala-c1-d1-pro-tyr-ser-e1-asp-tyr-f1-g1-h1-gly-thr-leu-val-thr-val-ser-ser(seqidno:1283);且其中x1為met或leu;y1為val或phe;z1為asp或asn;a1為ser或thr;b1為tyr或his;c1為lys或arg;d1為asp或glu;e1為tyr或phe;f1為trp
或arg;g1為gly或arg;且h1為gln或his。
進一步提供一種抗體多肽,其中該抗體多肽為域抗體(dab)。
進一步提供一種抗體多肽,其中可變域融合至fc域。
進一步提供一種抗體多肽,其中該抗體多肽進一步包含特異性結合第二抗原之第二可變域,其中該第二抗原為除人類cd40以外之抗原。
亦提供一種抗體多肽,其中第二抗原為分化簇(clusterofdifferentiation,cd)分子或主要組織兼容性複合體(majorhistocompatibilitycomplex,mhc)ii類分子。
亦提供一種抗體多肽,其中第二抗原為血清白蛋白(sa)。
本發明提供一種編碼本文所揭示之抗體多肽的核酸。
本發明亦提供一種包含本文所揭示之核酸的載體。
本發明亦提供一種包含本文所揭示之載體的宿主細胞。
本發明提供一種包含治療有效量之本文所揭示之抗體多肽及醫藥學上可接受之載劑的醫藥組合物。本發明亦提供一種進一步包含免疫抑制/免疫調節劑及/或消炎劑之醫藥組合物。
本發明提供一種治療需要該治療之患者的免疫疾病之方法,其包含向該患者投與治療有效量之本文所揭示之醫藥組合物。本發明亦提供一種方法,其中該醫藥組合物與免疫抑制/免疫調節劑及/或消炎劑組合投與。
本發明提供一種治療免疫疾病之方法,其中該免疫疾病為自體免疫疾病或移植相關疾病。本發明進一步提供一種治療免疫疾病之方法,其中該免疫疾病選自由以下組成之群:艾迪森氏病(addison'sdisease)、過敏症、僵直性脊椎炎、哮喘、動脈粥樣硬化、自體免疫性耳病、自體免疫性眼病、自體免疫肝炎、自體免疫腮腺炎、結腸炎、冠心病、克羅恩氏病(crohn'sdisease)、糖尿病(包括1型及/或2型糖尿病)、附睪炎、絲球體腎炎、葛瑞夫茲氏病(graves'disease)、格-巴二氏徵候群(guillain-barresyndrome)、橋本氏病(hashimoto'sdisease)、溶血性貧血、特發性血小板減少性紫癜、發炎性腸病、對重組藥品之免疫反應、全身性紅斑狼瘡、男性不育症、多發性硬化症、重症肌無力、天皰瘡、牛皮癬、風溼熱、類風溼性關節炎、類肉瘤病、硬皮病、休格連氏症候群(sjogren'ssyndrome)、脊椎關節病、甲狀腺炎、移植排斥反應、血管炎、aids、異位性過敏症、支氣管哮喘、溼疹、麻風病、精神分裂症、遺傳性抑鬱症、組織及器官之移植、慢性疲勞症候群、阿茲海默氏病(alzheimer'sdisease)、帕金森氏病(parkinson'sdisease)、心肌梗塞、中風、自閉症、癲癇症、阿瑟氏現象(arthus'sphenomenon)、全身性過敏反應、酒精成癮及藥物成癮。
本發明亦提供一種使用特異性結合包含seqidno:1之胺基酸序列的人類cd40之抗原決定基的第一可變域靶向cd40之方法,其中抗體多肽與域抗體(dab)bms3h-56-269(seqidno:417)競爭結合。
本發明提供抗體多肽或其醫藥學上可接受之鹽的醫學用途,該抗體多肽包含特異性結合包含seqidno:1之胺基酸序列的人類cd40之抗原決定基的第一可變域,其中該抗體多肽與域抗體(dab)bms3h-56-201(seqidno:9)競爭結合。
本發明提供抗體多肽或其醫藥學上可接受之鹽的用途,該抗體多肽包含特異性結合包含seqidno:1之胺基酸序列的人類cd40之抗原決定基的第一可變域,其中該抗體多肽與域抗體(dab)bms3h-56-201(seqidno:9)競爭結合,該用途系用於製備用以治療免疫疾病之藥劑。在一些實施例中,醫藥組合物與免疫抑制/免疫調節劑及/或消炎劑組合投與。在其他實施例中,免疫疾病為自體免疫疾病或移植相關疾病。在其他實施例中,該免疫疾病選自由以下組成之群:艾迪森氏病、過敏症、僵直性脊椎炎、哮喘、動脈粥樣硬化、自體免疫性耳病、自體免疫性眼病、自體免疫肝炎、自體免疫腮腺炎、結腸炎、冠心病、克羅恩氏病、糖尿病(包括1型及/或2型糖尿病)、附睪炎、絲球體腎炎、葛瑞夫茲氏病、格-巴二氏徵候群、橋本氏病、溶血性貧血、特發性血小板減少性紫癜、發炎性腸病、對重組藥品之免疫反應、全身性紅斑狼瘡、男性不育症、多發性硬化症、重症肌無力、天皰瘡、牛皮癬、風溼熱、類風溼性關節炎、類肉瘤病、硬皮病、休格連氏症候群、脊椎關節病、甲狀腺炎、移植排斥反應、血管炎、aids、異位性過敏症、支氣管哮喘、溼疹、麻風病、精神分裂症、遺傳性抑鬱症、組織及器官之移植、慢性疲勞症候群、阿茲海默氏病、帕金森氏病、心肌梗塞、中風、自閉症、癲癇症、阿瑟氏現象、全身性過敏反應、酒精成癮及藥物成癮。
本發明提供一種抗體多肽或其醫藥學上可接受之鹽,該抗體多肽包含特異性結合包含seqidno:1之胺基酸序列的人類cd40之抗原決定基的第一可變域,其中該抗體多肽與域抗體(dab)bms3h-56-201(seqidno:9)競爭結合,該抗體多肽或其醫藥學上可接受之鹽系用於製備用以治療免疫疾病之藥劑。該藥劑可例如與免疫抑制/免疫調節劑及/或消炎劑組合投與。免疫疾病可為例如自體免疫疾病或移植相關疾病。免疫疾病亦可選自由以下組成之群:艾迪森氏病、過敏症、僵直性脊椎炎、哮喘、動脈粥樣硬化、自體免疫性耳病、自體免疫性眼病、自體免疫肝炎、自體免疫腮腺炎、結腸炎、冠心病、克羅恩氏病、糖尿病(包括1型及/或2型糖尿病)、附睪炎、絲球體腎炎、葛瑞夫茲氏病、格-巴二氏徵候群、橋本氏病、溶血性貧血、特發性血小板減少性紫癜、發炎性腸病、對重組藥品之免疫反應、全身性紅斑狼瘡、男性不育症、多發性硬化症、重症肌無力、天皰瘡、牛皮癬、風溼熱、類風溼性關節炎、類肉瘤病、硬皮病、休格連氏症候群、脊椎關節病、甲狀腺炎、移植排斥反應、血管炎、aids、異位性過敏症、支氣管哮喘、溼疹、麻風病、精神分裂症、遺傳性抑鬱症、組織及器官之移植、慢性疲勞症候群、阿茲海默氏病、帕金森氏病、心肌梗塞、中風、自閉症、癲癇症、阿瑟氏現象、全身性過敏反應、酒精成癮及藥物成癮。
附圖簡要說明
圖1展示人類cd40(seqidno:1)之兩種不同共晶體結構之結合模式,一者具有dabbms3h-56-5(seqidno:321)及一者具有chi220抗體之fab'。bms3h-56-5及chi220fab'分子顯示為包含β-股(在dab中以箭頭表示)及非重複二級結構(在dab中以環表示)之草圖。亦顯示互補決定區(cdr),cd40亦顯示為包含人類cd40之bms3h-56-5抗原決定基殘基之草圖。亦顯示chi220抗原決定基殘基。亦顯示雙硫鍵。標記cd40之n端(n)及c端(c)。
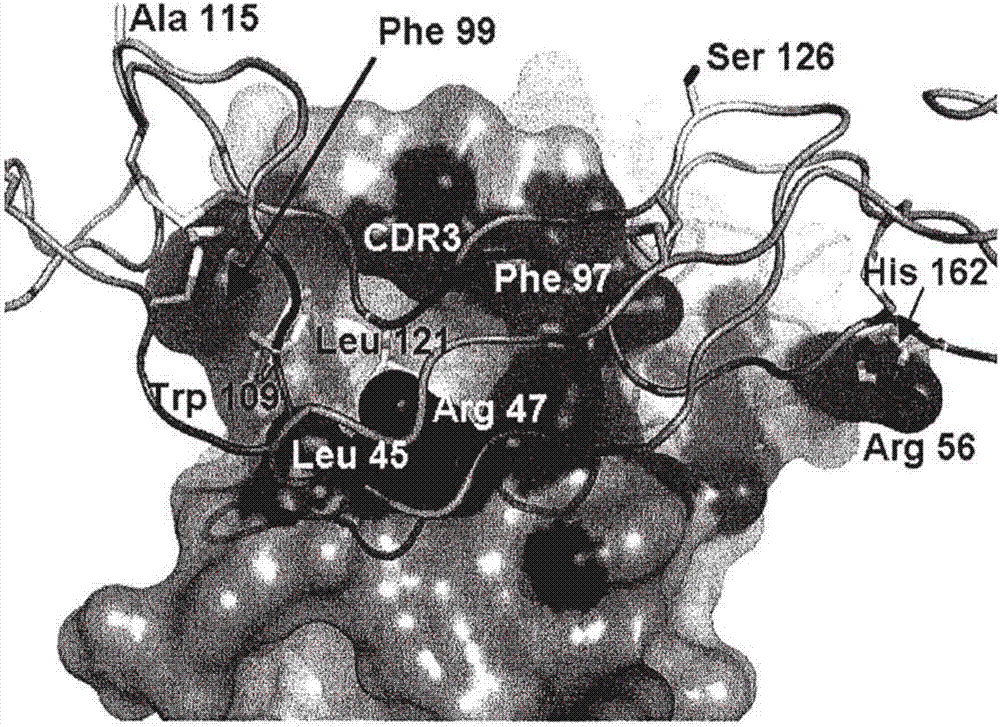
圖2展示接觸人類cd40(seqidno:1)之bms3h-56-5(seqidno:321)之空間填充模型,其以草圖顯示。顯示接觸cd40之dabbms3h-56-5之表面殘基。標記bms3h-56-5cdr3區及fr-2殘基leu45、arg47、arg56及phe99。在此圖中使用kabat編號(kabat等人,sequencesofimmunologicalinterest,第5版,美國健康與人類服務部(u.s.dept.health&humanservices),washington,d.c.(1991)),且與順序編號之不同之處在於使用插入殘基來保持β-股之殘基編號相同。因此,對於bms3h-56-5,順序殘基53變為殘基52a,順序殘基84、85及86分別變為82a、82b、82c,且kabat殘基編號100缺失(其將介於順序殘基103與104之間);cd40亦以包含非重複二級結構及bms3h-56-5抗原決定基之草圖表示。在人類與長尾獼猴(macacafascicularis)(食蟹獼猴(cynomolgusmonkey))之間不同的cd40殘基ala115、phe99、ser126、his162、leu121及trp109以棒圖標法顯示。作為bms3h-56-5抗原決定基之一部分的在人類與食蟹獼猴之間不同的cd40殘基為trp109、leu121及his162。cd40殘基trp109及leu121處於bms3h-56-5cdr3與fr-2之間的間隙中。trp109之突變大大降低或消除bms3h-56-5活性。
圖3展示來自人類及靈長類動物物種之血液樣品上聚乙二醇化抗人類cd40dabbms3h38-2c-p40br之結合。圖3a顯示bms3h38-2c-p40br結合至人類及獼猴b細胞;圖3b顯示bms3h38-2c-p40br結合至人類、恆河猴及黑猩猩b細胞。
圖4、圖5、圖6及圖7顯示分別來自譜系bms3h-56、bms3h-37、bms3h-38及bms3h-198之代表性域抗體多肽之clustalw2比對。
實施方式
本發明提供特異性結合至人類cd40之抗體多肽。該等抗體多肽不展現cd40促效劑活性,且該等抗體多肽適用於治療涉及cd40活化之疾病,諸如自體免疫疾病。該等抗體多肽可使用利用細胞結合分析之初步篩檢,隨後進行一或多輪易錯或簡併寡核苷酸定向親和力成熟來選擇。結果,提供一類特異性結合單一cd40抗原決定基之抗體多肽。
「譜系」為如以下實例中所揭示由常見前驅體藉由易錯或簡併寡核苷酸定向親和力成熟而製備且預期結合相同cd40抗原決定基之一組相關抗體多肽。使用抗體多肽之命名表示各種譜系。舉例而言,命名「bms3h-56」係指針對人類cd40所產生之譜系56之抗體多肽。「譜系bms3h-56」抗體多肽包括bms3h-56-1直至bms3h-56-33及bms3h-56-202直至bms3h-56-288。
因此,在一個實施方式中,抗體多肽包含特異性結合人類cd40之可變域,其中該抗體多肽與表3中所列之任一域抗體(dab)競爭結合。舉例而言,dab可能屬於選自由以下組成之群的譜系:例如bms3h-37、bms3h-38、bms3h-41、bms3h-43、bms3h-56、bms3h-131、bms3h-198及bms3h-202,諸如dabbms3h-56-5、bms3h-56-201或bms3h-56-258。在另一個實施方式中,抗體多肽特異性結合與表3中所列之任一dab相同之人類cd40抗原決定基。舉例而言,抗體多肽可包含特異性結合與例如dabbms3h-56-5、bms3h-56-201或bms3h-56-258相同之人類cd40抗原決定基的可變域。如下文所揭示,人類cd40抗原決定基可包含例如seqidno:1之胺基酸殘基trp109。
抗體多肽可為含有單一可變域之域抗體。抗體多肽亦可包含其他結構域,諸如fc域。舉例而言,抗體多肽可包含特異性結合人類血清白蛋白(hsa)之第二可變域。舉例而言,該等雙特異性抗體多肽可具有增加之半衰期。
在序列表中,seqidno:1為人類cd40之胺基酸序列;seqidno:2為長尾獼猴cd40之胺基酸序列。域抗體bms3h-56-5之胺基酸序列為seqidno:321。
如本文所用,「特異性結合」係指抗體多肽結合抗原之解離常數(kd)如例如藉由表面電漿子共振所量測,為約1μm或1μm以下。適當分析系統包括biacoretm表面電漿子共振系統及biacoretm動力學評估軟體(例如2.1版)。特異性結合相互作用之親和力或kd可為約500nm或500nm以下或約300nm或300nm以下。
術語「約」將為一般熟習此項技術者所了解且在使用其之情形下將有一定程度之變化。一般而言,約涵蓋加上/減去提及值之10%的數值範圍。
根據此實施方式,以下縮寫及定義適用。須注意,除非本文另外明確規定,否則如本文所用,單數形式「一(a)」、「一(an)」及「該」包括複數個指示物。因此,舉例而言,提及「抗體」包括複數個該等抗體,且提及「劑量」包括提及一或多個為熟習此項技術者所知之劑量及其等同量等。
1.cd40及cd40活性
提供結合人類cd40之抗體多肽。cd40亦稱為b細胞表面抗原cd40、bp50、cd40l受體、cdw40、cdw40、mgc9013、p50、tnfrsf5及腫瘤壞死因子受體超家族成員5。人類cd40之相關結構信息可例如以uniprot寄存編號p25942、q9byu0及q53gn5找到。「人類cd40」係指包含以下胺基酸序列之cd40:
亦已在小家鼠(musmusculus)、野豬(susscrofa)、歐洲牛(bostaurus)、雞(gallusgallus)、家犬(canisfamiliaris)、長尾獼猴(食蟹獼猴)、綿羊(ovisaries)、家馬(equuscaballus)及褐家鼠(rattusnorvegicus)中對cd40測序。
本發明抗體多肽與cd40之結合拮抗cd40活性。「cd40活性」包括(但不限於)t細胞活化(例如誘導t細胞增殖或細胞激素分泌)、巨噬細胞活化(例如誘生巨噬細胞中之活性氧物質及氧化氮)及b細胞活化(例如b細胞增殖、抗體同型轉換或分化成漿細胞)。cd40活性可藉由與其他分子相互作用來介導。「cd40活性」包括cd40與以下分子之間的功能相互作用,該等分子以其uniprot寄存編號於括號內標識:
calr(p27797);
erp44(q9bs26);
fbl(p22087);
polr2h(p52434);
rfc5(p40937);
sgk1(o00141);
slc30a7(q8new0);
slc39a7(q92504);
traf2(q5t1l5);
traf3(q13114);
traf6(q9y4k3);
txn(q5t937);
uggt1(q9nyu2);及
usp15(q9y4e8)。
舉例而言,cd40「活性」包括與traf2之相互作用。cd40/traf2相互作用活化nf-κb及jnk。參見davies等人,mol.cellbiol.25:9806-19(2005)。因此,此cd40活性可利用cd40依賴性細胞nf-κb及jnk活化相對於參照組來測定。
如本文所用,術語「活化(activate)」、「活化(activates)」及「活化(activated)」係指既定可量測cd40活性相對於參照組增加至少10%,例如至少10%、25%、50%、75%或甚至100%或100%以上。若活性相對於不存在拮抗劑之情況降低至少10%,且在一個例示性實施例中降低至少約20%、30%、40%、50%、60%、70%、80%、90%、95%、97%或甚至100%(亦即無可偵測活性),則cd40活性被「拮抗」。舉例而言,抗體多肽可拮抗一些或所有cd40活性,而不活化cd40。在一個實施例中,抗體多肽不活化b細胞增殖。在另一個實施例中,抗體多肽不活化t細胞之細胞激素分泌,其中細胞激素為至少一種選自由以下組成之群的細胞激素:il-2、il-6、il-10、il-13、tnf-α、ifn-γ。
2.cd40抗原決定基
使用人類cd40(seqidno:1)與dabbms3h-56-5(seqidno:321)之間的複合物之x射線結晶學來揭示由本發明之抗體多肽所識別之抗原決定基。針對電子密度數據擬合cd40及bms3h-56-5之結構模型以產生七種模型或型式之cd40/bms3h-56-5複合物,其來自三種呈一種晶形之結晶學獨立複合物及四種呈第二晶形之結晶學獨立複合物。該等型式之主鏈原子之真實空間相關係數(realspacecorrelationcoefficient)為約0.92且側鏈原子之真實空間相關係數為0.80。在七種型式中cd40分子具有一定量之可撓性,但所有型式中均保留cd40/bms3h-56-5相互作用之總體性質。該等型式在cd40殘基trp109與bms3h-56-5trp103(kabat編號,參見下文)之間的相互作用不同。bms3h-56-trp103與一種型式之cd40trp109形成邊對面相互作用,而與其他型式形成置換堆棧(亦即面對面)相互作用。
七種型式之形狀互補性統計值sc在0.70至0.77之範圍內,此顯示與典型抗體抗原複合物相比形狀互補性之程度較高。舉例而言,此等值可與四種蛋白酶/蛋白質抑制劑複合物之0.71至0.76之範圍、五種寡聚界面之0.70至0.74之範圍及六種抗體/抗原複合物之0.64至0.68之範圍比較。參見lawrence等人,「shapecomplementarityatprotein/proteininterfaces」,j.mol.biol.234:946-950(1993)。
圖1中顯示人類cd40/bms3h-56-5複合物模型。一個bms3h-56-5dab結合於一個cd40分子。bms3h-56-5抗原決定基不與chi220fab'片段抗原決定基重迭。所有型式之複合物界定一組接觸bms3h-56-5之cd40殘基:trp109、leu121、his122、ser124、ser156、ala157、phe158、glu159及his162(參考seqidno:1)。一些型式之複合物中接觸bms3h-56-5之cd40殘基為pro85、asn86、leu87、gly88、glu106、glu107、gly108、his110、thr112、cys119、val120、gln133、ile134、ala135、thr136、ser155及lys160。在所有型式中val154為內埋cd40殘基。在一些型式中內埋之其他cd40殘基為ser118、arg123、thr141、phe151、asp153、cys161及pro163。
如本文所用,術語「接觸」係指原子間距離,其最大值決定於如sheriff等人,j.mol.biol.197:273-296(1987)及sheriff,immunomethods3:191-196(1993)所定義之原子型距離依賴性。
如本文所用,術語「內埋」係指一殘基具有至少一個具有由程序ms(connolly,j.appl.crystallogr.16:548-558(1983))所定義之表面積、之探針球及如sheriff,immunomethods3:191-196(1993)所定義之原子型依賴性凡得瓦爾半徑(vanderwaalsradii)的原子。
圖2顯示包括接觸殘基及內埋殘基之bms3h-56-5(seqidno:321)之表面。cd40(seqidno:1)表示為帶狀圖,橙色表示非重複二級結構且洋紅色表示抗原決定基殘基。在各種非人類靈長類動物序列中所顯示之cd40殘基trp109、ala115、leu121、ser126及his162不同。cd40殘基ala115及ser126位於bms3h-56-5結合位點之對側。trp109及leu121在位於bms3h-56-5之cdr3與fr-2(殘基leu45及arg47)之間的間隙中結合。his162與bms3h-56-5之cdr2中之殘基,尤其lys56相互作用。總之,cd40抗原決定基包含一或多個表1中所列之殘基,參考seqidno:1中所用之編號。
表1
bms3h-56-5,如表3中所列之其他dab,系使用人類cd40作為抗原藉由下文更詳細描述之篩檢及親和力成熟方法來製備。預期由常見前驅dab藉由親和力成熟產生之dab將結合相同人類cd40抗原決定基。舉例而言,下文所述之競爭研究指示由常見前驅dab藉由親和力成熟產生之dab彼此競爭結合於人類cd40。然而,相同競爭研究顯示dab不與至少chi220或g28-5抗體競爭。
3.抗體多肽
抗體多肽包含可變域。在一個實施例中,抗體多肽呈含有單一可變域之dab形式。抗體多肽可為包含藉由雙硫鍵互連之兩個重(h)鏈及兩個輕(l)鏈之全長抗cd40免疫球蛋白分子。在此實施例中,各鏈之胺基末端部分包括主要經由其中所含之互補決定區(cdr)負責抗原識別的約100至110個胺基酸之可變域(vl或vh)。各重鏈之羧基末端「半部」界定主要負責效應功能之恆定區(fc)。
抗體多肽亦可為包含含特異性結合cd40之可變域的全長抗cd40免疫球蛋白分子之一部分的「片段」。因此,術語「抗體多肽」包括例如抗原結合重鏈、輕鏈、重鏈-輕鏈二聚體、fab片段、f(ab')2片段、fv片段、單鏈fv(scfv)及dab。因此,術語「抗體多肽」包括藉由重組工程改造及表現而產生之多肽,以及藉由天然重組及融合瘤細胞克隆分泌所產生之單株抗體。
輕鏈系分類為κ或λ,且如此項技術中所知其特徵在於特定恆定區cl。重鏈系分類為γ、μ、α、δ或ε,且將抗體之同型分別定義為igg、igm、iga、igd或ige。對於igg、igd及iga,重鏈恆定區包含三個結構域(ch1、ch2及ch3);且對於igm及ige,包含四個結構域(ch1、ch2、ch3及ch4)。抗cd40抗體可具有選自任一免疫球蛋白類別(iga、igd、igg、igm及ige)之重鏈恆定區。
各輕鏈可變域(vl)及重鏈可變域(vh)由三個cdr及四個構架區(fr)構成,自胺基末端至羧基末端按以下順序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。輕鏈之三個cdr被稱為「lcdr1、lcdr2及lcdr3」,且重鏈之三個cdr被稱為「hcdr1、hcdr2及hcdr3」。
如本文所用,術語「fc域」係指包含ch2及ch3恆定域之恆定區抗體序列,如kabat等人,sequencesofimmunologicalinterest,第5版,美國健康與人類服務部(u.s.dept.health&humanservices),washington,d.c.(1991)所界定。fc區可源自例如igg1或igg4fc區。可變域可融合至fc域。在此情況下,可變域(vl或vh域,包括dab)之羧基末端可連接或融合至fcch2域之胺基末端。或者,可變域之羧基末端可連接或融合至ch1域之胺基末端,ch1域之胺基末端本身融合至fcch2域。蛋白質可包含ch1與ch2域之間的鉸鏈區整體或部分。
cdr含有大部分與抗原形成特異性相互作用之殘基。如圖2中所示,例如cdr2及cdr3加上fr4殘基trp103形成cd40與dabbms3h-56-5之間的大部分接觸。舉例而言,抗體多肽之可變域包含具有與表3中所列之dab之一的cdr1、cdr2及cdr3區相同之胺基酸序列或各與cdr1、cdr2及cdr3區有一或兩個胺基酸不同之cdr1、cdr2及cdr3區。舉例而言,抗體多肽可包含具有與例如bms3h-56-5、bms3h-56-258或bms3h-56-201之cdr1、cdr2及cdr3區相同之胺基酸序列的cdr1、cdr2及cdr3區。
「域抗體」(dab)包含能夠特異性及單價結合抗原(諸如cd40)之單一可變(vl或vh)域。舉例而言,dab可具有駱駝科動物dab所特有之vhh結構。如本文所用,「vh域」意謂包括vhh結構。在另一個實施例中,本發明之vh域(包括作為本文之實施例呈現的所有特徵及特徵之組合)不為vhh域。dab可在溶液中形成均二聚體或雜二聚體。鹹信二價抗cd40抗體由於能夠交聯結合細胞表面上之cd40分子而展現促效劑活性。儘管不受任何特定理論限制,但鹹信單價dab不活化cd40,因為該等dab不與cd40交聯。
如本文所用,術語「可變域」係指由kabat等人,sequencesofimmunologicalinterest,第5版,美國健康與人類服務部,washington,d.c.(1991)所定義之免疫球蛋白可變域。可變域內cdr胺基酸殘基之編號及定位系根據熟知kabat編號約定確定。舉例而言,在表2中比較bms3h-56-5(seqidno:321)之kabat編號與依序編號之相同序列。在kabat編號中,bms3h-56-5具有插入殘基52a、82a、82b、82c,且殘基100。在兩種編號系統中,給予作為表現構築體之一部分的n端之ser及thr負編號。
表2
術語「人類」在應用於抗體多肽時意謂抗體多肽具有源自人類免疫球蛋白之序列,例如fr及/或ch域。當序列系:(a)自人類個體或自人類個體之細胞或細胞株分離而得;(b)自經選殖之人類抗體基因序列或人類抗體可變域序列之文庫分離而得;或(c)藉由自一或多個以上多肽突變及選擇而多樣化時,該序列系「源自」人類免疫球蛋白編碼序列。如本文所用,「經分離」之化合物意謂該化合物已與在自然界中與該化合物天然締合之至少一種組分分離。
可將抗體多肽投與人類患者,同時基本上避免通常藉由投與來自其他物種(例如小鼠)之抗體而引起的抗抗體免疫反應。舉例而言,鼠類抗體可根據此項技術中熟知之程序藉由將鼠類cdr移植於人類可變域fr上而「人類化」。然而,如本文所揭示之人類抗體可在不需要鼠類抗體序列之基因操控之情況下產生。
可變域可包含一或多個具有與由人類生殖系抗體基因區段編碼之相應構架區相同之胺基酸序列的構架區(fr)。舉例而言,域抗體可包含vh生殖系基因區段dp47、dp45或dp38、vκ生殖系基因區段dpk9、jh區段jh4b或jκ區段jκ1。
可改變抗體多肽序列,同時保留特異性結合cd40之能力。特定言之,抗體多肽(例如dab)可包含保留特異性結合與dabbms3h-56-5相同之cd40抗原決定基的功能之變異型可變域。參見表1。亦即,變異型可變域可結合包含seqidno:1之trp109、leu121、his122、ser124、ser156、ala157、phe158、glu159及his162中之至少一者的人類cd40抗原決定基。在一個實施例中,變異型可變域抗原決定基可包含trp109、leu121、his122、ser124、ser156、ala157、phe158、glu159及his162。或者,變異型可變域可特異性結合包含cd40殘基trp109之cd40抗原決定基。在又一個實施例中,變異型可變域可與bms3h-56-5競爭特異性結合於cd40。如以下實例中所揭示,易錯親和力成熟提供一種製造及鑑別具有特異性結合相同cd40抗原決定基之變異型序列的抗體多肽之例示性方法。
舉例而言,變異型可變域與表3中所列之可變域之一可有至多10個或其間之任何整數值個胺基酸不同,其中該變異型可變域特異性結合cd40。或者,變異型可變域相對於本發明序列表中所列之序列可具有至少90%序列一致性(例如至少92%、95%或98%序列一致性)。在兩個序列之間不同的非一致胺基酸殘基或胺基酸可表示胺基酸取代、添加或缺失。當兩個序列藉由諸如blast之任何適當胺基酸序列比對算法比對時,在兩個序列之間不同之殘基以非一致位置呈現。
其限制條件為可對個別fr區進行胺基酸取代,以便一或多個fr相對於由人類生殖系抗體基因區段編碼之相應fr之胺基酸序列包含至多兩個胺基酸差異。其限制條件進一步為變異型可變域在一或多個cdr中可含有一或兩個胺基酸取代。特異性結合cd40之代表性可變域列於表3中。
來自譜系bms3h-56、bms3h-37、bms3h-38及bms3h-198之抗體多肽之代表性可變域之間的clustalw2比對分別示於圖4、圖5、圖6及圖7中。通常,相關蛋白質序列之比對中胺基酸之保守程度與胺基酸位置對蛋白質功能之相對重要性成比例。亦即,所有相關序列中共有之胺基酸可能起重要作用且不能輕易被取代。另一方面,序列之間不同的位置可能經其他胺基酸取代或以其他方式修飾,同時維持蛋白質之活性。示於圖4、圖5、圖6及圖7中之比對以及例如由圖1及圖2確定之結構關係可引導特異性結合包含seqidno:1之胺基酸序列的人類cd40之抗原決定基的變異型抗體多肽之建構,其中該抗體多肽與dabbms3h-56-201(seqidno:9)競爭結合。該等變異型抗體多肽包括(但不限於)具有對應於關於表3中所列之任一可變域的取代、插入或缺失之胺基酸修飾的變異型抗體多肽。變異型抗體多肽亦包括具有對應於表3中所列序列之間保守之胺基酸修飾的胺基酸修飾之變異型抗體多肽。
關於重鏈及輕鏈基因之vl或vh域之邊界的信息可用於設計pcr引子以擴增來自編碼已知結合cd40之抗體多肽的經選殖之重鏈或輕鏈編碼序列之可變域。使用此項技術中熟知之技術,可將擴增之可變域插入適當表現載體(例如phen-1)(hoogenboom等人,(1991)nucleicacidsres.19:4133-4137)中且使其單獨地或以與另一多肽序列之融合物形式表現。基於所揭示之胺基酸及聚核苷酸序列,可產生融合蛋白且僅使用普通技術於任何適當哺乳動物宿主細胞株(諸如cho、293、cos、nso及其類似細胞株)中來純化,隨後使用一種方法或方法之組合來純化,該等方法包括蛋白質a親和層析法、離子交換法、逆相技術或其類似方法。
在一個實施方式中,抗體多肽為包含特異性結合包含seqidno:1之胺基酸序列的人類cd40之第一可變域的「雙特異性」抗體多肽。雙特異性抗體多肽包含特異性結合除人類cd40以外之第二抗原之第二可變域。
在另一個實施例中,第二抗原可為例如免疫效應細胞之細胞表面分子或可溶性分子(諸如細胞激素)。雙特異性抗體多肽之結合可用於拮抗cd40且拮抗第二抗原之生物活性。免疫效應細胞之細胞表面分子包括分化簇(cd)分子。代表性cd標記列於網際網路之超文本傳送協議en.wikipedia.org/wiki/list_of_human_clusters_of_differentiation上(2012年2月22日進行最後修改)。免疫效應細胞之細胞表面分子亦包括主要組織兼容性複合體(mhc)ii類分子。針對此等細胞表面分子之抗體在此項技術中為已知的且可作為可變域來源用於構築雙特異性抗體多肽。
在一個實施例中,雙特異性配位體之抗體多肽可藉由「胺基酸連接子」或「連接子」連接。舉例而言,dab可融合至胺基酸連接子之n端,且另一dab可融合至連接子之c端。儘管胺基酸連接子可為任何長度且由胺基酸之任何組合組成,但連接子長度可能相對較短(例如五個或五個以下胺基酸)以降低所連接結構域之間的相互作用。亦可調節連接子之胺基酸組成以減少具有龐大側鏈之胺基酸或可能引入二級結構中之胺基酸的數目。適當胺基酸連接子包括(但不限於)長度為至多3、4、5、6、7、10、15、20或25個胺基酸之胺基酸連接子。代表性胺基酸連接子序列包括(ggggs)n(seqidno:4),其中n可為1與5之間的任何整數。其他適當連接子序列可選自由以下組成之群:ast(seqidno:5)、tvaaps(seqidno:6)、tva(seqidno:7)及astsgps(seqidno:8)。
第二抗原之結合可增加抗體多肽之活體內半衰期。舉例而言,雙特異性抗體多肽之第二可變域可特異性結合血清白蛋白(sa),例如人類血清白蛋白(hsa)。經形式設計而可結合hsa之抗體多肽相對於相同的未經形式設計之抗體多肽可具有增加之活體內t-α(「α半衰期」)或t-β(「β半衰期」)半衰期。t-α及t-β半衰期量度物質分布於身體內且自身體內消除有多快。舉例而言,鍵聯至hsa可藉由抗體多肽與能夠特異性結合hsa之第二可變域之融合來實現。抗人類血清白蛋白抗體在此項技術中為熟知的。參見例如在網際網路之超文本傳送協議www.abcam.com/index.html上可獲知之人類血清白蛋白抗體ab10241、ab2406及ab8940,或在網際網路之超文本傳送協議www.genwaybio.com上可獲知之genwayalb抗體。特異性結合hsa之可變域可獲自任一此等抗體,且接著使用此項技術中熟知之重組技術融合至本發明之抗體多肽。
或者,抗體多肽連接至hsa可藉由使用熟練技術者熟知之技術使抗體多肽序列直接稠合至hsa編碼序列來實現。hsa編碼序列可藉由pcr使用源自例如可以genbank寄存編號nm000477獲得之cdna序列之引子來獲得。
在一個實施例中,經hsa連接之域抗體組合物之tα半衰期增加10%或10%以上。在另一個實施例中,經hsa連接之域抗體組合物之tα半衰期在0.25小時至6小時之範圍內。在另一個實施例中,經hsa連接之域抗體組合物之tβ半衰期增加10%或10%以上。在另一個實施例中,經hsa連接之域抗體組合物之tβ半衰期在12小時至48小時之範圍內。
在另一個實施例中,可藉由聚乙二醇化對抗體多肽進行形式設計以增加其活體內半衰期。在一個實施例中,將peg共價連接。在另一個實施例中,將peg連接至抗體多肽之半胱氨酸或賴氨酸殘基。在又一個實施例中,經peg連接之抗體多肽之流體動力學尺寸為至少24kd。在又一個實施例中,總peg尺寸為20kd至60kd且包括20kd及60kd。在又一個實施例中,經peg連接之域抗體之流體動力學尺寸為至少200kd。
聚乙二醇化可使用若干peg連接部分達成,該等peg連接部分包括(但不限於)n-羥基丁二醯亞胺活性酯、丙酸丁二醯亞胺酯、順丁烯二醯亞胺、乙烯碸或硫醇。peg聚合物可連接至抗體多肽之預定位置,或可任意地連接至域抗體分子。聚乙二醇化亦可經由連接至域抗體之肽連接子介導。亦即,peg部分可連接至融合至抗體多肽之肽連接子,其中該連接子提供用於peg連接之位點(例如游離半胱氨酸或賴氨酸)。聚乙二醇化抗體之方法在此項技術中熟知,例如如chapman等人,「pegylatedantibodiesandantibodyfragmentsforimprovedtherapy:areview」,adv.drugdeliv.rev.54(4):531-45(2002)中所揭示。
抗體多肽亦可經設計以形成二聚體、三聚體、四聚體或其他多聚體。抗體多肽(例如dab)可藉由此項技術中已知之若干方法(包括(但不限於)以融合蛋白形式表現單體、兩個或兩個以上單體經由單體之間的肽連接子鍵聯)、或藉由在轉譯之後彼此直接或藉由雙硫鍵經由連接子以化學方式接合單體、或藉由鍵聯至二價、三價或多價連接部分(例如多臂peg)來連接以形成多聚體。在一個實施例中,多聚體可結合單一cd40分子。
4.醫藥組合物及治療方法
醫藥組合物包含治療有效量之一或多種抗體多肽及視情況選用之醫藥學上可接受之載劑。醫藥學上可接受之載劑包括例如水、生理食鹽水、磷酸鹽緩衝鹽水、右旋糖、甘油、乙醇及其類似物以及其組合。醫藥學上可接受之載劑可進一步包含極少量之可增加融合蛋白之儲存期限或效用之助劑物質,諸如溼潤劑或乳化劑、防腐劑或緩衝劑。組合物可經調配以在投與之後提供活性成分之快速、持續或延遲釋放。適當醫藥組合物及其製備方法在此項技術中為熟知的。參見例如remington,thescienceandpracticeofpharmacy,a.gennaro等人編,第21版,mackpublishingco.(2005)。
醫藥組合物進一步可包含免疫抑制/免疫調節劑及/或消炎劑。治療需要該治療之患者的免疫疾病之方法可包含向患者投與治療有效量之醫藥組合物。拮抗cd40介導之t細胞活化可抑制例如自體免疫性、移植排斥反應或過敏反應期間發生之不當t細胞反應。抑制cd40介導之t細胞活化可減緩此等疾病之進展及/或嚴重程度。
如本文所用,「患者」意謂動物,例如哺乳動物,包括人類。患者可經診斷患有免疫疾病。「治療(treatment)」或「治療(treat)」或「治療(treating)」係指涉及減輕症狀、病症、病狀或疾病之進展或嚴重程度之方法。「免疫疾病」係指與個體中顯現免疫反應,包括細胞及/或體液免疫反應相關之任何疾病。免疫疾病之實例包括(但不限於)發炎、過敏症、自體免疫疾病或移植相關疾病。自體免疫疾病可選自由全身性紅斑狼瘡、多發性硬化症、類風溼性關節炎、糖尿病、牛皮癬、硬皮病、動脈粥樣硬化、發炎性腸病及潰瘍性結腸炎組成之群。
可藉由投與醫藥組合物治療之疾病可選自由以下組成之群:艾迪森氏病、過敏症、僵直性脊椎炎、哮喘、動脈粥樣硬化、自體免疫性耳病、自體免疫性眼病、自體免疫肝炎、自體免疫腮腺炎、結腸炎、冠心病、克羅恩氏病、糖尿病(包括1型及/或2型糖尿病)、附睪炎、絲球體腎炎、葛瑞夫茲氏病、格-巴二氏徵候群、橋本氏病、溶血性貧血、特發性血小板減少性紫癜、發炎性腸病、對重組藥品之免疫反應(例如血友病患者中之因子vii)、全身性紅斑狼瘡、男性不育症、多發性硬化症、重症肌無力、天皰瘡、牛皮癬、風溼熱、類風溼性關節炎、類肉瘤病、硬皮病、休格連氏症候群、脊椎關節病、甲狀腺炎、移植排斥反應及血管炎。自體免疫介導之病狀包括(但不限於)受影響之組織為主要目標,且在一些情況下為次要目標之病狀。該等病狀包括(但不限於)aids、異位性過敏症、支氣管哮喘、溼疹、麻風病、精神分裂症、遺傳性抑鬱症、組織及器官之移植、慢性疲勞症候群、阿茲海默氏病、帕金森氏病、心肌梗塞、中風、自閉症、癲癇症、阿瑟氏現象、全身性過敏反應、酒精成癮及藥物成癮。
醫藥組合物可單獨或以與免疫抑制/免疫調節劑及/或消炎劑之組合療法投與(亦即同時或依序)。不同免疫疾病可能需要使用適用於治療免疫疾病之特定助劑化合物,此可根據患者對患者之基準來確定。舉例而言,醫藥組合物可與一或多種例如細胞激素(例如il-10及il-13)或其他免疫刺激劑(例如趨化因子、腫瘤相關抗原及肽)之適當佐劑組合投與。適當佐劑在此項技術中為已知的。
可使用任何適當方法或途徑來投與抗體多肽或醫藥組合物。投藥途徑包括例如經口、靜脈內、腹膜內、皮下或肌肉內投與。投與之抗體多肽之治療有效劑量視許多因素而定,包括例如所治療之免疫疾病之類型及嚴重程度、組合療法之用途、抗體多肽或醫藥組合物之投藥途徑及患者之體重。域抗體之治療有效量之非限制性範圍相對於患者之體重為0.1mg/kg至20mg/kg,且在一個實施方式中,為1mg/kg至10mg/kg。在疾病病況之活體外及/或活體內模型中,抗體多肽之劑量可由為cd40拮抗作用所需之抗體多肽之量進一步引導。代表性模型描述於下文及實例中。
5.活體外及活體內模型
可在若干可獲得之活體外或活體內模型系統中之一者中測試本發明之抗體多肽拮抗cd40之能力。適當動物及細胞模型系統描述於下文。其他細胞分析系統描述於實例中。
5.1.發炎性腸病(ibd)模型:
ibd為不明病因之多因性免疫病症。類似ibd之若干黏膜發炎小鼠模型提供了有關控制正常與病理性黏膜免疫功能之機制的理解。ibd模型包括使用dewinter等人,am.j.physiol.276:g1317-1321(1999)之黏膜免疫及發炎系統。在一個實施方式中,將cd4(+)t淋巴細胞之子集(亦即cd4(+)cd45rbhigh細胞)注射至免疫缺陷小鼠中會引起腸發炎。發病機理部分系歸因於促炎性細胞因子之分泌。結腸炎之誘發可藉由共轉移另一cd4(+)亞群(亦即cd4(+)cd45rblowt細胞)來預防。就獲取活化標記及返回宿主腸而言,此群體之行為類似於cd4(+)cd45rbhigh群體。然而,活化時其淋巴介質概況不同,且cd4(+)cd45rblowt細胞分泌及/或誘導之消炎細胞激素會預防結腸炎。dewinter等人提供有關過繼性轉移模型及促進及預防結腸炎發病機理之因素的描述。
5.2.自發性關節炎模型:
kouskoff等人,cell87:811-822(1996)提供由全身性自體免疫性引起之器官特異性疾病之模型。類風溼性關節炎(rheumatoidarthritis,ra)為慢性關節病,其特徵為白血球侵襲及滑膜細胞活化,隨後為軟骨及骨破壞。kouskoff等人揭示藉由t細胞受體(tcellreceptor,tcr)轉殖基因系與nod系雜交產生之自發性小鼠ra模型。所有子代均顯現極易令人想起人類ra之關節病。鼠類病症之觸發為由轉殖基因tcr機會性識別nod源性主要組織兼容性複合體(mhc)ii類分子;關節炎之進展涉及cd4+t細胞、b細胞及可能存在之骨髓細胞。
5.3.膠原蛋白誘發之關節炎(collageninducedarthritis,cia)模型:
brand等人,methodsmol.med.102:295-312(2004)提供膠原蛋白誘發之關節炎之小鼠模型。膠原蛋白誘發之關節炎(cia)為可在齧齒動物(大鼠及小鼠)及非人類靈長類動物之易感染系中藉由用ii型膠原蛋白(cii)(亦即關節軟骨之主要成分蛋白質)免疫接種而引發的自體免疫疾病。在免疫接種後,動物顯現與ra共有若干臨床及組織特徵之自體免疫多發性關節炎。在齧齒動物中容易感染cia與主要組織兼容性複合體(mhc)ii類分子有關,且對cii之免疫反應之特徵在於刺激膠原蛋白特異性t細胞及產生高效價之對免疫原(異源cii)與自身抗原(小鼠cii)具特異性之抗體。在組織學上,鼠類cia之特徵在於與關節炎之臨床發作一致之嚴重滑膜炎。由於cia與ra之間具有病理相似性,故此實驗數據適用於評估cia。
5.4.抗原誘發之t細胞增殖活體內模型:
使用t細胞受體(tcr)-轉殖基因t細胞之過繼性轉移為抗原誘發之t細胞增殖提供活體內模型。pape等人,immunol.rev.156:67-78(1997)揭示均一地表現具有已知肽/mhc特異性之可識別tcr的tcr-轉殖基因t細胞之過繼性轉移。可使用該模型來監測抗原特異性t細胞之活體內行為。未處理t細胞最初在次級淋巴組織之t細胞區內活化以按b7依賴性方式增殖。若此時期內存在佐劑或發炎性細胞激素,則t細胞積聚數目增多,遷移至富b細胞之小囊中且獲得產生ifn-γ之能力且有助於b細胞產生igg2a。若發炎得以有效拮抗,則大部分最初活化之抗原特異性t細胞會消失而不進入小囊中,且倖存者為il-2及ifn-γ之不良產生者。
實施例
表3列出適用於本發明抗體多肽之代表性抗人類cd40可變域胺基酸序列。表4揭示編碼表3中所列之可變域序列之代表性核酸。如此項技術中所熟知,多個密碼子可編碼同一胺基酸。因此,編碼蛋白質序列之核酸包括具有密碼簡併性之核酸。表3中所示之抗體多肽特異性結合cd40且使用以下實施例中所述之反覆初始/初步篩檢及親和力成熟方法來製造。
表3
抗人類cd40可變域胺基酸序列
表4
編碼人類抗cd40可變域之核苷酸序列
實施例1
經由bms3h-225產生人類抗cd40可變域bms3h-1
以下實施例描述經由bms3h-225產生一系列命名為bms3h-1之抗人類cd40可變域。在噬菌體表面上重組表現單一免疫球蛋白可變域譜系之後,藉由使噬菌體譜系與固定目標抗原接觸,洗滌以移除未結合之噬菌體且傳播結合之噬菌體來進行選擇。此方法通常稱為「淘選」。其適用於篩檢單一免疫球蛋白可變域以及可在呈現文庫上表現之其他抗體片段,例如scfv、fab及fab'。或者,可藉由針對僅藉由折迭成員結合之固定通用配位體(例如蛋白質a或蛋白質l)淘選來預先選擇表現適當折迭之成員變異體之噬菌體。此有如下優勢:降低非功能成員之比例,由此增加可能結合目標抗原之成員的比例。舉例而言,wo99/20749中教示用通用配位體進行預先選擇。舉例而言,harrison等人,meth.enzymol.267:83-109(1996)大體描述了噬菌體抗體文庫之篩檢。
篩檢通常使用固定於固體支撐物(例如塑料管或孔)或層析基質(例如sepharosetm(pharmacia))上之純化抗原來執行。篩檢或選擇亦可在諸如細胞表面之複合抗原上執行(marks等人,biotechnology11:1145(1993);dekruif等人,proc.natl.acad.sci.usa92:3938(1995))。另一替代方法涉及藉由結合溶液中之經生物素標記之抗原來選擇,隨後捕捉於塗布抗生蛋白鏈菌素之珠粒上。
克隆bms3h-1至bms3h-69:
使用遞減濃度之抗原(第1輪100nm;第2輪10nm;第3輪1nm)針對經生物素標記之人類cd40單體(由bms供應,每莫耳cd401.5莫耳生物素)與經生物素標記之人類cd40-ig(由bms供應,每莫耳cd40-ig3.3莫耳生物素)並行進行三輪選擇。在起始選擇之前,如下組合來自未處理4g及6gdomantisdab文庫之噬菌體:
1)4g+6gvhcdr3長度在7至9個胺基酸之間。
2)4g+6gvhcdr3長度在10至12個胺基酸之間。
3)4g+6gvhcdr3長度在13至15個胺基酸之間。
4)4gvk
5)6gvk
各輪選擇涉及將所要濃度之抗原添加至750μl來自未處理文庫池之一之噬菌體或後續選擇輸出之噬菌體與750μlpbs+2%marvel(含有2%(w/v)marvel[premierfoods,uk]之磷酸鹽緩衝鹽水)之混合物中且在室溫下藉由翻滾混合來培育1小時。接著藉由添加100μl再懸浮m-280抗生蛋白鏈菌素[invitrogen,uk]來捕捉經生物素標記之抗原噬菌體複合物,且在室溫下藉由翻滾混合來培育5分鐘。接著使用kingfisher磁力分離器[thermofisherscientific,uk]回收且用7×1mlpbs+0.1%吐溫20(含有0.1%(v/v)聚氧乙烯脫水山梨糖醇單月桂酸酯[sigma-aldrich,uk]之pbs,pbst),隨後用1×1mlpbs洗滌。藉由與500μl胰蛋白酶-pbs(50μl溶解於50mmtris-hcl(ph7.4)、1mmcacl2中之10mg/ml胰蛋白酶[sigma-aldrich,uk]添加至450μlpbs中)一起培育來溶離保留在經洗滌上之結合噬菌體。回收含有噬菌體之溶液,且在37℃下使用250μl感染1.75ml對數生長期大腸桿菌(e.coli)tg1(od600為0.4)30分鐘。在微量離心機中在11,600g下離心大腸桿菌tg1噬菌體感染之培養物1分鐘。使所得細胞集結粒再懸浮於1ml2xty(1公升中有16g胰蛋白腖、10g酵母萃取物及5gnacl,在121℃下用高壓釜處理15分鐘)中且接種於含有補充有15μg/ml四環素之ty的9cm皮式培養皿(petridish)上。在37℃下培育培養盤隔夜。接著將2ml補充有15%甘油之2xty添加至各培養盤中,並用玻璃散布器分散該等細胞且充分混合。使用50μl刮落細菌接種50ml補充有15μg/ml四環素之2xty,且在37℃下在250rpm振蕩下生長隔夜。在3,300g下離心隔夜培養物15分鐘以集結細菌。為了沉澱析出噬菌體,將10mlpeg/nacl(20%聚乙二醇8000,2.5mnacl)添加至40ml上清液中。混合噬菌體/peg溶液且靜置於冰上1小時,接著在4℃下在3,300g下離心30分鐘,且去除上清液。使集結粒再懸浮於2mlpbs中且在微量離心機中在11,600g下離心10分鐘,移除剩餘細菌碎片。含有噬菌體之所得上清液接著用於下一輪針對適當經生物素標記之cd40抗原之選擇。
在第2輪及第3輪選擇之後,進行單株噬菌體elisa。使用3次250μlpbst之洗滌,隨後3次250μlpbs之洗滌執行所有洗滌。在4℃下,用每孔50μl1μg/ml中性鏈親和素(thermoscientific,uk)於0.2m碳酸鹽-碳酸氫鹽緩衝液(ph9.4)中之混合物塗布培養盤隔夜。洗滌培養盤,且接著在室溫下用2%mpbs(含2%w/vmarvel脫脂奶粉[premierfoods]之pbs)阻斷1小時。接著洗滌培養盤且與每孔50μl0.7μg/ml經生物素標記之人類cd40於2%mpbs中之混合物一起培育。洗滌培養盤,且將噬菌體上清液添加至等體積之2%mpbs中。接著在室溫下培育培養盤1小時。洗滌培養盤且用用2%mpbs以1:5000稀釋之抗m13-hrp結合物(gehealthcare,uk)偵測結合噬菌體,且在室溫下培育1小時。洗滌培養盤,且使用sureblue單組分tmbmicrowell過氧化酶溶液(kplinc,usa)進行elisa顯色。藉由與塗有中性鏈親和素但無生物素標記cd40之培養盤相比較來鑑別特異性噬菌體。使用midiprep自pdom4(domantis)第2輪及第3輪輸出分離dabv-基因,且選殖至pdom5(domantis)中。wo2007/085815中所揭示之pdom4為fd噬菌體載體之衍生物,其中基因iii信號肽序列經酵母醣脂錨定表面蛋白(yeastglycolipidanchoredsurfaceprotein,gas)信號肽置換(wo2005/093074)。pdom4亦在前導序列與基因iii之間含有c-myc標籤,此將基因iii放回框架中。
如下鑑別結合dab。在37℃下,在costar96孔細胞培養集群(corningincorporated,usa)中在250rpm振蕩下自各輸出選取96個個別菌落(於pdom5中)至200μl含有onex自體誘導介質(novagen,uk)之terrific培養液中隔夜。離心培養物以集結細胞,且藉由cd40結合dab之抗原結合elisa分析上清液。在4℃下用每孔50μl1μg/ml中性鏈親和素於0.2m碳酸鹽-碳酸氫鹽緩衝液(ph9.4)中之混合物塗布maxisorp96孔免疫培養盤(nunc,usa)隔夜。所有洗滌系如噬菌體elisa所述。在室溫下用200μl含有1%吐溫20之pbs阻斷培養盤1小時。接著洗滌培養盤且與每孔50μl0.7μg/ml經生物素標記之人類cd40於0.1%mpbs中之混合物一起培育。將澄清之含有dab之培養物上清液添加至具有等體積0.1%pbs之telisa培養盤中。在室溫下培育培養盤1小時且接著洗滌。使用兩步方法偵測結合dab:首先在室溫下添加用0.1%pbst以1:2000稀釋之9e10(抗mycigg,sigma-aldrich,uk)持續1小時,接著洗滌,隨後在室溫下添加用0.1%pbst以1:2000稀釋之抗小鼠fc-hrp(sigma-aldrich,uk)持續1小時。洗滌培養盤,且使用sureblue單組分tmbmicrowell過氧化酶溶液(kplinc,usa)進行elisa顯色。允許顯色,且藉由添加等體積1mhcl中止比色反應。在450nm下讀取elisa培養盤。藉由與塗有中性鏈親和素但無生物素標記cd40之培養盤相比較來鑑別特異性噬菌體。
在基於珠粒或基於elisa之受體結合分析(receptor-bindingassay,rba)中測試對cd40具特異性之克隆以評估cd40配位體結合之抑制。在b細胞增殖分析中,且接著在多種其他活體外細胞分析中測試在rba中顯示抑制作用之域抗體。下文更詳細描述此等分析。
bms3h-106至bms3h-225:
bms3h-106至bms3h-225系自針對如關於bms3h-1至bms3h-69所述但具有以下修飾之生物素標記cd40或生物素標記cd40-fc之選擇來分離。在起始選擇之前,如下組合來自未處理4g及6g文庫之噬菌體:
6)4gvhcdr3長度在7至9個胺基酸之間。
7)4gvhcdr3長度在10至12個胺基酸之間。
8)4gvhcdr3長度在13至15個胺基酸之間。
9)6gvhcdr3長度在7至9個胺基酸之間。
10)6gvhcdr3長度在10至12個胺基酸之間。
11)6gvhcdr3長度在13至15個胺基酸之間。
12)4gvk
13)6gvk
對於cd40-fc在160nm之抗原濃度下執行第1輪,且對於cd40在100nm下執行。輸出效價在2.0×104至9.0×107tu/ml之範圍內(功能病毒效價)。
對於第2輪,來自第1輪之富集噬菌體在用於選擇之前被成對組合:
1)4g+6gvhcdr3長度在7至9個胺基酸之間(來自第1輪之池1+池4)。
2)4g+6gvhcdr3長度在10至12個胺基酸之間(來自第1輪之池2+池5)。
3)4g+6gvhcdr3長度在13至15個胺基酸之間(來自第1輪之池3+池6)。
4)4g+6gvk(來自第1輪之池7+池8)
在100nm之抗原濃度下進行選擇,且使用與中性鏈親和素(thermofisherscientific,uk)偶合之m-280甲苯磺醯基活化(invitrogen)捕捉抗原-噬菌體複合物。輸出效價在6.5×107tu/ml至7.5×108tu/ml之範圍內。
在20nm之抗原濃度下且在cd40-fc選擇之情況下,在6.7μm游離人類fc尾(bms)存在下執行第3輪。輸出效價在4.3×107tu/ml至1.6×109tu/ml之範圍內。
如關於第2輪所述但在2nm之抗原濃度下且在存在及不存在500倍過量未標記cd40-fc之情況下執行第4輪。在最初使噬菌體與生物素標記抗原一起培育1小時之後添加此競爭劑,且接著如前所述培育混合物隔夜。包括此競爭步驟,目的在於增強對具有較慢解離速率之dab之選擇。在無競爭之情況下輸出效價在1.8×107tu/ml至4.4×107tu/ml之範圍內,且在有競爭之情況下在1.8×106tu/ml至2.3×107tu/ml之範圍內。
為了監測選擇之進展,在第2輪及第3輪之後進行單株噬菌體elisa。如關於bms3h-1至bms3h-69所述執行此等操作。如關於bms3h-1至bms3h-69所述鑑別結合dab,其中例外為在vk文庫篩檢之情況下,包括最終濃度為0.8μg/ml之蛋白質l。添加蛋白質l會藉由使dab交聯而增加信號強度。
bms3h-70至bms3h-105:
bms3h-70至bms3h-105系自針對已被動吸附至免疫管之抗原的選擇來分離。在起始選擇之前,如下組合來自未處理4g及6gdomantisdab文庫之噬菌體:
1)4gvhcdr3長度在7至9個胺基酸之間。
2)4gvhcdr3長度在10至12個胺基酸之間。
3)4gvhcdr3長度在13至15個胺基酸之間。
4)6gvhcdr3長度在7至9個胺基酸之間。
5)6gvhcdr3長度在10至12個胺基酸之間。
6)6gvhcdr3長度在13至15個胺基酸之間。
7)4gvk
8)6gvk
對於第一輪選擇,將1ml10μg/ml人類cd40-fc融合物(bms)於0.2m碳酸鹽-碳酸氫鹽緩衝液(ph9.4)中之混合物添加至nuncmaxisorp免疫管中且接著在4℃下,在滾動下培育隔夜。接著排空該管且用磷酸鹽緩衝鹽水(pbs)洗滌三次。接著藉由用mpbs填充至滿且在室溫下培育1小時來阻斷該管。接著排空該管且用pbs洗滌三次。將含文庫噬菌體之4mlmpbs添加至該管中且在室溫下,在旋轉翻滾下培育1小時。
排空該管且用pbst(具有0.1%(v/v)吐溫20之pbs)洗滌10次。在室溫下,藉由在旋轉翻滾下與500μl胰蛋白酶-pbs(50μl溶解於50mmtris-hcl(ph7.4)、1mmcacl2中之10mg/ml胰蛋白酶[sigma-aldrich,uk]添加至450μlpbs中)一起培育10min來溶離保留在經洗滌管上之結合噬菌體。回收含有噬菌體之溶液,且在37℃下使用250μl感染1.75ml對數生長期大腸桿菌tg1(od600為0.4)30分鐘。在微量離心機中在11,600g下離心大腸桿菌tg1噬菌體感染之培養物1分鐘,且使所得細胞集結粒再懸浮於1ml2xty(1公升中有16g胰蛋白腖、10g酵母萃取物及5gnacl,該懸浮液在121℃下以高壓釜處理15分鐘)中且接種於含有補充有15μg/ml四環素之lb瓊脂之9cm皮式培養皿中。在37℃下培育培養盤隔夜。接著將2ml補充有15%甘油之2xty添加至各培養盤中,且用玻璃散布器分散該等細胞且充分混合。
使用50μl刮落細菌接種50ml補充有15μg/ml四環素之2xty,且在37℃下在250rpm振蕩下生長隔夜。在3,300g下離心隔夜培養物15分鐘以集結細菌。為了沉澱析出噬菌體,將10mlpeg/nacl(20%聚乙二醇8000,2.5mnacl)添加至40ml上清液中。混合噬菌體/peg溶液且靜置於冰上1小時。接著在4℃下在3,300g下離心溶液30分鐘,且去除上清液。使集結粒再懸浮於2mlpbs中且在微量離心機中在11,600g下離心10分鐘,移除剩餘細菌碎片。含有噬菌體之所得上清液接著用於下一輪針對cd40-fc抗原之選擇。第1輪之輸出效價在7.5×104tu/ml至1.5×107tu/ml之範圍內(每毫升之感染單位)。
使用自第一輪選擇回收之富集噬菌體執行第二輪選擇。如上所述精確執行此操作且輸出效價在2.5×107tu/ml至1.2×108tu/ml之範圍內。
使用自第二輪選擇回收之富集噬菌體執行第三輪選擇。如上所述但在1μg/ml之抗原濃度下執行此等操作。輸出效價在5.1×107tu/ml至7.5×108tu/ml之範圍內。
為了監測選擇之進展,在第2輪及第3輪之後進行單株噬菌體elisa。將個別菌落之樣品選取至200μl補充有15μg/ml四環素之2xty中,且在37℃下,在costar96孔細胞培養集群(corningincorporated,usa)中在250rpm振蕩下培育隔夜。離心培養物以集結細胞,且藉由cd40結合噬菌體dab之抗原結合elisa分析上清液。使用3次250μlpbst之洗滌,隨後3次250μlpbs之洗滌執行所有洗滌。在4℃下用每孔50μl0.5μg/mlcd40-fc(bms)於0.2m碳酸鹽-碳酸氫鹽緩衝液(ph9.4)中之混合物塗布maxisorp96孔免疫培養盤(nunc,usa)隔夜。洗滌培養盤,且接著在室溫下用250μl2%mpbs阻斷1小時。洗滌培養盤,且將噬菌體上清液添加至等體積2%mpbs中且在室溫下培育1小時。洗滌培養盤且用用2%mpbs以1:5000稀釋之抗m13-hrp結合物(gehealthcare,uk)偵測結合噬菌體,且在室溫下培育1小時。洗滌培養盤,且使用sureblue單組分tmbmicrowell過氧化酶溶液(kplinc,usa)進行elisa顯色。藉由與塗有游離fc之培養盤相比較來鑑別特異性噬菌體dab。
將來自以上第2輪及第3輪選擇輸出中之每一者之dab基因以池形式次選殖至大腸桿菌菌株hb2151中之可溶性表現載體pdom5中。此載體允許在大腸桿菌中表現具有c-myc標籤之游離dab(rochediagnosticsgmbh)且分泌至上清液中。
如下鑑別來自被動選擇之cd40結合dab。在37℃下,在costar96孔細胞培養集群(corningincorporated,usa)中在250rpm振蕩下自各輸出選取96個個別菌落(於pdom5中)至200μl含有onex自體誘導介質(novagen,uk)之terrific培養液中隔夜。離心培養物以集結細胞,且藉由cd40結合dab之抗原結合elisa分析上清液。在4℃下用每孔50μl0.5μg/mlcd40-fc(bms)於0.2m碳酸鹽-碳酸氫鹽緩衝液(ph9.4)中之混合物塗布maxisorp96孔免疫培養盤(nunc,usa)隔夜。所有洗滌系如噬菌體elisa所述。在室溫下用250μl含有1%吐溫20之pbs(pbst)阻斷培養盤1小時。將澄清之含有dab之培養物上清液添加至具有等體積0.1%pbst之elisa培養盤中。在室溫下培育培養盤1小時且接著洗滌。使用兩步方法偵測結合dab:首先在室溫下添加用0.1%pbst以1:5000稀釋之生物素標記9e10(抗mycigg,sigma-aldrich,uk)持續1小時,接著洗滌,隨後在室溫下添加用0.1%pbst以1:5000稀釋之抗生蛋白鏈菌素-hrp(bendermedsystems,austria)持續1小時。洗滌培養盤且使用sureblue單組分tmb進行elisa顯色。藉由與塗有游離fc之培養盤相比較來鑑別特異性dab。
在基於珠粒或基於elisa之受體結合分析(rba)中測試對cd40具特異性之克隆以評估cd40配位體結合之抑制。表5中給出自rba獲得之效能量測(初步篩檢工作)。在b細胞增殖分析中,且接著在多種其他活體外細胞分析中測試在rba中顯示抑制作用之域抗體。
bms3h-210至bms3h-225
bms3h-210至bms3h-225系自針對完整細胞之選擇來分離。在起始選擇之前,如下組合來自未處理4g及6gdomantisdab文庫之噬菌體:
1)4g+6gvhcdr3長度在7至9個胺基酸之間。
2)4g+6gvhcdr3長度在10至12個胺基酸之間。
3)4g+6gvhcdr3長度在13至15個胺基酸之間。
4)4gand6gvk
在第1輪中,將用細胞表面表現之人類cd40(由bms供應)穩定轉染之dg44cho細胞株用作抗原。在針對此等細胞作選擇之前,使上文所述之文庫池與未經轉染之cho細胞一起培育以去除其對除cd40以外之細胞表面抗原具特異性之噬菌體呈現dab。藉由在評估存活力之前與凡爾生(versene)(invitrogen)一起培育來收集兩種類型之細胞。使六百萬個活的未經轉染之cho細胞再懸浮於4ml具有2%(w/v)bsa之pbs(pbs/bsa)中且在4℃下旋轉翻滾1小時以進行阻斷。除非另外說明,否則在4℃下執行所有後續步驟。在185g下離心細胞5分鐘,且將含有經去除之文庫噬菌體之上清液轉移至新鮮管中。向此管中添加含6×106個活cho-cd40細胞之1mlpbs/bsa,且旋轉混合物1小時。接著藉由在185g下離心5分鐘來洗滌該等細胞5次,且再懸浮於10mlpbs/bsa中。在最終洗滌後,如先前集結細胞且接著再懸浮於0.5ml1mg/ml牛胰腺之xiii型胰蛋白酶(sigmaaldrich,uk)於補充有5mmtris-hcl(ph7.4)、0.1mmcacl2之pbs中的混合物中,且轉移至微量離心管中。在室溫下旋轉細胞10分鐘,隨後在16000g下離心5分鐘。使用上清液中之溶離之噬菌體感染大腸桿菌,且輸出噬菌體效價經測定在5.1×105tu/ml與2.7×106tu/ml(每毫升之感染單位)之間。
使用自第一輪選擇回收之富集噬菌體執行第二輪選擇。如上所述但無初始去除(去選擇)步驟且使用ramos人類b細胞(atcc)替代cho-cd40來執行此等操作。輸出效價在2.3×105tu/ml至7.5×105tu/ml之範圍內。
如第二輪般執行第三輪選擇。輸出效價在1.9×108tu/ml至3.5×108tu/ml之範圍內。
將來自以上第2輪及第3輪選擇輸出中之每一者之dab基因以池形式次選殖至大腸桿菌菌株hb2151中之可溶性表現載體pdom5中。此載體允許在大腸桿菌中表現具有c-myc標籤之游離dab且分泌至上清液中。
在cho細胞受體結合分析(rba)中測試對cd40具特異性之克隆以評估cd40配位體結合之抑制。在b細胞增殖分析中,且接著在多種其他活體外細胞分析中測試在rba中顯示抑制作用之域抗體。
藉由易錯pcr進行親和力成熟
構築13個在下文實施例6中所述之b細胞增殖分析中顯示中和活性之bms3hdab的易錯噬菌體文庫(參見表17)。此系藉由使用mutazymeii聚合酶(來自agilenttechnologies之genemorphii套組之一部分)在擴增期間藉由聚合酶鏈反應(pcr)將錯誤任意引入dab基因中來執行。在gas1前導序列控制下將突變dab基因以與fd噬菌體基因iii蛋白質之基因融合物形式選殖至pdom4載體中,該載體含有為產生感染性噬菌體粒子所必需之所有fd基因。此等文庫之尺寸為約1×108個cfu(菌落形成單位),每個dab基因之錯誤率為2至5個胺基酸。
使由此等文庫產生之噬菌體經受三輪針對可溶性生物素標記人類cd40之選擇。第一輪噬菌體選擇系藉由將噬菌體文庫與2%mpbs(補充有2%(w/v)marvel幹脫脂奶粉之磷酸鹽緩衝鹽水)預混合且添加生物素標記人類cd40(bms)至最終濃度為於1ml之最終體積中20nm來執行。在室溫下,在翻滾混合下培育混合物至少1小時。接著使用50μlm-280抗生蛋白鏈菌素(invitrogen)捕捉抗原-噬菌體複合物且用1mlpbst洗滌7次,隨後用1mlpbs洗滌一次。藉由與0.5ml1mg/ml來自牛胰腺之xiii型胰蛋白酶(sigmaaldrich,uk)於補充有5mmtris-hcl(ph7.4)、0.1mmcacl2之pbs中的混合物一起培育而自抗原/珠粒複合物溶離洗滌之噬菌體。使用溶離之噬菌體感染大腸桿菌,且輸出噬菌體效價經測定在2×105tu/ml與9×107tu/ml(每毫升之感染單位)之間。
使用自第一輪選擇回收之富集噬菌體用最終濃度之2nm生物素標記cd40執行第二輪選擇,隨後如上所述使用抗生蛋白鏈菌素珠粒捕捉。輸出效價在3×104tu/ml至5×106tu/ml之範圍內。
使用2nm生物素標記cd40進行第三輪選擇,隨後使用抗生蛋白鏈菌素珠粒捕捉。溶離之噬菌體效價在8×104tu/ml至4×106tu/ml之範圍內。
biacoretm篩檢
將來自以上第3輪選擇輸出各自之dab基因以池形式次選殖至大腸桿菌hb2151中之可溶性表現載體pdom13(domantis)中。pdom13載體亦稱為pdom33且揭示於wo/2008/149143中。此載體允許在大腸桿菌中表現游離dab且分泌至上清液中。在37℃下,在costar96孔細胞培養集群(corningincorporated,usa)中在250rpm振蕩下自各輸出選取47個個別菌落且在200μl含有novagen隔夜表現自體誘導介質(merckchemicals,uk)之terrific培養液(tb)中表現隔夜。在相同培養盤中,用表現適當親本(野生型)dab之大腸桿菌接種單一孔。離心培養物以集結細胞,且用biacoretm3000儀器(gehealthcare)篩檢上清液與親本dab相比「解離速率」(亦即解離速率常數,kd)之改良。
將約1600個反應單位(ru)之生物素標記人類cd40(bms)固定於抗生蛋白鏈菌素(sa)biacoretm晶片之一個流槽上。將未固定有任何配位體之第二流槽用作參比流槽進行線內參比。用hbs-ep緩衝液(具有0.15mnacl、3mmedta及0.005%v/v界面活性劑p20之0.01mhepes(ph7.4),gehealthcare)以1:3稀釋各待分析之dab上清液。使用儀器之kinject功能將10微升各dab上清液注射於串聯之固定cd40之流槽及參比流槽上,線內減去來自參比槽之信號。在25℃及10μl/min之hbs-ep流速下執行實驗。各注射完成後,允許在緩衝液中自配位體解離dab120秒,隨後由注射5μl10mm甘氨酸(ph2.0)而再生。使用biaevaluation4.1軟體(gehealthcare)自各分析物跡線減去參比流槽跡線。使用同一軟體來近似擬合分析物跡線之解離階段的1:1(朗繆爾(langmuir))動力學模型。此模型產生各克隆之近似解離速率常數(「解離速率」或kd)且允許與野生型dab進行相對比較。
鑑別除bms3h-129及bms3h-197外之所有譜系的解離速率改良之克隆。如上所述,在基於珠粒或基於elisa之受體結合分析(rba)中測試解離速率改良之克隆以對效能之改良進行評估。在標註為「易錯成熟之克隆」的表中給出由rba獲得之效能量測結果。隨後在b細胞增殖分析中測試在rba中更有效之克隆以評估生物效能之提高,且表17中給出所獲得之此等量測結果。亦在多種其他活體外細胞分析中測試在b細胞增殖分析中效能改良之域抗體。
藉由三聯體掃描多樣化進行親和力成熟
選擇自易錯成熟分離的5種效能改良之dab,亦即bms3h-37-2、bms3h-38-2、bms3h-56-2、bms3h-193-25及bms3h-217-23,以藉由三重掃描多樣化進一步親和力成熟。基於如上針對易錯文庫所述之此等親本構築噬菌體文庫,其中例外為替代使用易錯pcr,使用一系列重迭簡併三聯寡核苷酸來多樣化各dab之互補決定(cdr)區。對於待親和力成熟之各dab,使用含有nns密碼子三聯體之寡核苷酸(參見arkin等人(1992)proc.nat'lacad.sci.usa89:7811-7815)藉由重迭延伸拼接(slicingbyoverlapextension,soe)pcr製得各cdr之許多文庫。利用寡核苷酸針對兩個密碼子重迭之既定cdr使三聯體多樣化,每個cdr產生2至4個文庫。bms3h-37-2文庫中多樣化之胺基酸殘基在位置30、31、32、33、35、50、52、53、55、56、95、96、97及98(kabat編號)。bms3h-38-2文庫中多樣化之殘基如同bms3h-37-2一般,但添加了位置100。bms3h-56-2文庫中多樣化之殘基如同bms3h-37-2一般,但添加了位置100及101。bms3h-193-25及bms3h-217-23文庫中多樣化之殘基在位置27、28、30、31、32、34、49、50、51、53、89、91、92、93、94及96。
由此等文庫產生之噬菌體藉由cdr混合且如上所述執行選擇,其中例外為對於bms3h-37-2、bms3h-38-2、bms3h-56-2及bms3h-193-25,第1輪、第2輪及第3輪所用抗原之濃度分別為10nm、1nm及0.1nm。對於bms3h-217-23,第1輪、第2輪及第3輪之所用抗原之濃度分別為20nm、2nm及0.2nm。對於對獼猴cd40具交叉反應性之bms3h-193-25,亦並行地針對獼猴cd40執行選擇。另外,分別在存在或不存在100倍或1000倍過量之未標記cd40之情況下執行第2輪及第3輪選擇。在最初使噬菌體與生物素標記抗原一起培育1小時之後添加此競爭劑,且接著如前所述再培育混合物1小時。包括此競爭步驟,目的在於增強對具有較慢解離速率之dab之選擇。第1輪效價在1.4×106至1.4×109之範圍內。在無競爭之情況下第2輪之效價為1.3×105至4.0×108,且在有競爭之情況下為8.6×104至1.3×108。在無競爭之情況下第3輪中之效價為1.2×105至1.9×108,且在有競爭之情況下為6.0×105至1.2×108。
如關於易錯親和力成熟所述次選殖且篩檢此等選擇輸出。鑑別除bms3h-193-25外之所有譜系的解離速率改良之克隆。在elisa受體結合分析(rba)中測試解離速率改良之克隆以對效能改良進行評估。在標註為「進一步成熟之克隆」的表中給出由rba獲得之效能量測結果。隨後在b細胞增殖分析中測試在rba中更有效之克隆以評估生物效能之提高,且表17中給出所獲得之此等量測結果。亦在多種其他活體外細胞分析中測試在b細胞增殖分析中效能改良之域抗體。
實施例2
使用受體結合分析(rba)進行篩檢
使用若干活體外受體結合分析(rba)測定實施例1中產生之抗人類cd40可變域胺基酸序列之cd40親和力。使用三種rba格式:(1)珠粒rba、(2)elisarba及(3)cho細胞rba。
珠粒rba:
經磷酸鹽緩衝鹽水(pbs)洗滌之sphero抗生蛋白鏈菌素聚苯乙烯粒子(saxoneurope,uk)用0.5μg/ml生物素標記人類iz-cd40l(bms)塗布。塗布之後,用pbs洗滌生物素標記cd40l粒子且用含0.1%(w/v)胎牛血清白蛋白(bsa)(sigma-aldrich,uk)之pbs分析緩衝液以1:10稀釋。在384孔透明底黑色壁培養盤(appliedbiosystems)中,等量組合稀釋範圍之純化dab、0.25μg/ml人類cd40(bms,cy24feb06-01)、1/5000小鼠抗人類igg(fc)mab克隆gg-7(sigma-aldrich,uk)、0.25μg/ml山羊抗小鼠alexafluor647(invitrogen,molecularprobes,uk)及生物素標記cd40l聚苯乙烯粒子且在無光存在下在室溫下培育6小時。培育之後,使用相對螢光用ab8200細胞偵測機制(appliedbiosystems)評估dab相對於人類cd40與生物素標記cd40l粒子之競爭性結合。
elisarba:
在4℃下用25μl1μg/ml中性鏈親和素於0.2m碳酸鹽碳酸氫鹽緩衝液(ph9.4)中之混合物塗布透明壁高結合384孔培養盤(corning,uk)隔夜。第二天,用0.1%(v/v)吐溫pbs緩衝液洗滌分析培養盤,在室溫下用含1%(w/v)bsa之pbs阻斷1小時且再次洗滌。在移除過量洗滌緩衝液之後,在室溫下使25μl1μg/ml生物素標記人類iz-cd40l(bms)與該等分析培養盤一起培育1小時。同時,稀釋範圍之純化dab與1μg/ml人類cd40(bms,cy24feb06-01)以1:1之比率複合。在洗滌分析培養盤之後,在室溫下,在輕微攪動下,在分析培養盤中培育dab:人類cd40複合物2小時。在1/5000小鼠抗人類igg(fc)mab克隆gg-7(sigma-aldrich,uk),隨後1/10,000辣根過氧化物酶(horseradishperoxidase,hrp)結合之山羊抗小鼠igg(fc)第二偵測抗體(sigma-aldrich,uk)相繼培育下,偵測dab相對於人類cd40與生物素標記cd40l之競爭性結合。在用1mhcl溶液中和之後,使用spectramaxm5e培養盤讀取器(moleculardevices)在450nm下量測吸亮度信號。
細胞分析:cd40cho細胞rba:
使用凡爾生(invitrogen)自細胞培養燒瓶分離穩定轉染之表現人類cd40之cho-dg44細胞或天然cho-dg44細胞(皆為bms)。將每孔4萬個細胞於具有稀釋範圍之dab、0.25μg/ml生物素標記人類iz-cd40l(bms)及0.25μg/ml抗生蛋白鏈菌素alexafluor647(invitrogen,molecularprobes,uk)之0.1%(w/v)bsapbs分析緩衝液中接種至96孔高結合黑色壁透明底培養盤(corning,uk)中。在無光存在下培育混合物6小時。培育之後,使用相對螢光用ab8200細胞偵測機制(appliedbiosystems)評估dab相對於人類cd40cho細胞與可溶性生物素標記iz-cd40l之競爭性結合。
表5至表7分別顯示測試之抗人類cd40dab之初步篩檢工作(「未處理克隆」)及後續各輪親和力成熟(「易錯成熟之克隆」及「進一步成熟之克隆」)的結果。
表5
初步篩檢工作:
表5
初步篩檢工作:
表6
易錯成熟之克隆:
表7
進一步成熟之克隆:
實施例3
cd40結合動力學
測定初步篩檢工作(「未處理克隆」)及後續各輪親和力成熟(「易錯成熟之克隆」)中所鑑別之抗人類cd40dab的結合動力學。所用之方法直接量測dab對cd40之親和力。
使用biacoretm3000儀器(gehealthcare)分析cd40特異性dab與cd40之結合動力學。將約600個反應單位(ru)之生物素標記人類cd40(bms)固定於抗生蛋白鏈菌素(sa)biacoretm晶片之一個流槽上。將未固定有任何配位體之第二流槽用作參比流槽進行線內參比。用hbs-ep緩衝液(具有0.15mnacl、3mmedta及0.005%v/v界面活性劑p20之0.01mhepes(ph7.4),gehealthcare)製備一系列適當二倍稀釋之各待分析之dab。使用儀器之kinject功能一式兩份注射180μl各dab。將各dab注射於串聯之固定cd40之流槽及參比流槽上,線內減去來自參比槽之信號。在25℃及30μl/min之hbs-ep流速下執行實驗。在各注射完成後,允許在緩衝液中自配位體解離dab300秒,隨後由注射10μl10mm甘氨酸(ph2.0)而再生。亦在相同條件下注射hbs-ep緩衝液空白參比注射劑(不包含分析物),以用作自各分析物跡線減去之第二參比。使用biaevaluation4.1軟體(gehealthcare)自各分析物跡線減去參比流槽跡線與緩衝液空白跡線。使用同一軟體同時整體擬合分析物稀釋液系列跡線之締合及解離階段的1:1(朗繆爾)動力學模型。此模型產生相互作用之締合及解離速率常數(分別為ka及kd)及平衡解離常數(kd);此等常數詳示於表8及表9中。
表8
未處理克隆:
表9
易錯成熟之克隆:
實施例4
生物物理表徵
藉由生物物理參數之分析進一步表徵初步篩檢工作(「未處理克隆」)及後續各輪親和力成熟(「易錯成熟之克隆」及「進一步成熟之克隆」)中所鑑別之抗人類cd40dab。為了量測dab之相對穩定性,藉由差示掃描熱量測定法(differentialscanningcalorimetry,dsc)測定其熔點。具有較高熔融溫度之dab更穩定。為了測定dab是否在溶液中形成多聚聚集體,藉由尺寸排阻層析法/多角雷射光散射(sizeexclusionchromatography/multianglelaserlightscattering,sec-malls)分析dab。結果示於表10至表12中。
表10
未處理克隆:
表11
易錯成熟之克隆:
表12
進一步成熟之克隆:
實施例5
競爭分析
使用biacoretm3000儀器(gehealthcare)分析cd40特異性dab是否結合相同cd40抗原決定基。將約600個反應單位(ru)之生物素標記人類cd40(bms)固定於抗生蛋白鏈菌素(sa)biacoretm晶片之一個流槽上。將未固定有任何配位體之第二流槽用作參比流槽進行線內參比。用hbs-ep緩衝液(具有0.15mnacl、3mmedta及0.005%v/v界面活性劑p20之0.01mhepes(ph7.4),gehealthcare)製備適當稀釋之各待分析之dab或fab。所選稀釋液為在如下文所述注射時對於特定抑制劑(典型地為1μm至10μm)產生>80%之最大可能結合ru的稀釋液。接著,製備與上文(在相同最終濃度下)相同之dab或fab與待進行競爭分析之第二dab或fab的混合物。使用儀器之coinject功能將60μl單一抑制劑稀釋液注射於串聯之固定cd40之流槽及參比流槽上,隨後立即注射60μl兩抑制劑混合物。藉由儀器之控制軟體線內減去來自參比槽之信號。在25℃及30μl/min之hbs-ep流速下執行實驗。各次共注射完成後,允許在緩衝液中自配位體解離抑制劑60秒,隨後由注射10μl10mm甘氨酸(ph2.0)而再生。記下獲得之第二注射劑(兩抑制劑之混合物)之最大ru且表示為單獨注射時獲得之相同抑制劑的ru之百分比。
若第二抑制劑保留在單獨注射其時通常結合之ru的至少100%,則此表示兩種抑制劑結合至個別抗原決定基。若觀測到第二抑制劑之結合小於100%,則此指示兩種抑制劑之間結合至cd40的競爭。此競爭存在若干可能原因:兩種抑制劑可結合至同一或重迭抗原決定基,可能存在結合之空間抑制,或第一抑制劑之結合可能誘發能阻止或減少第二抑制劑結合之抗原構形變化。
測試來自各譜系之實施例克隆(bms3h-217除外)與重迭群組中之其他dab之競爭。如表13及表14中所示,所有所測試之dab似乎會彼此競爭結合於cd40。此數據表明所有選自由譜系bms3h-37、bms3h-38、bms3h-41、bms3h-43、bms3h-56、bms3h-131、bms3h-198及bms3h-202組成之群的抗體多肽應與來自任一此等譜系之dab與人類cd40的結合競爭。
表13
競爭biacoretm:
表14
類似地,如表15及表16中所示,測試各種dab與chi220fab'之競爭。在此情況下,所有dab不與chi220fab'競爭,其中例外為bms3h-217,其顯示競爭。在結合之chi220或g28-5fab'存在下,bms3h-56-5及bms3h-193-12dab以至少100%之單一dabru結合,從而表明fab'結合與dab不同之抗原決定基。chi220fab'顯示在g28-5存在下結合ru降低。在相反次序之結合中觀測到相同之結果。此表明g28-5fab'結合與chi220fab'相同之抗原決定基。
表15
表16
實施例6
cd40活性分析
功能上分析抗人類cd40dab拮抗cd40活性之能力。所測試之cd40活性為藉由hcd40l驅動之初級人類單核細胞衍生之樹突狀細胞(dendriticcells,dc)活化進行之b細胞增殖及細胞激素產生。除非另外說明,否則所有分析均在補充有10%胎牛血清(fetalcalfserum,fcs)之rpmi培養基中執行。使用各種分析得到之結果示於表17中。
可溶性iz-hcd40l驅動之初級人類b細胞增殖:
在96孔圓底培養盤中以每孔200μl之最終體積用0.6μg/mliz-hcd40l以及不同滴定量之抗體多肽培育1×105個扁桃體人類b細胞。在37℃下培育培養盤72小時,接著添加胸腺嘧啶核苷(3h;0.5μci/孔)6小時。基於胸腺嘧啶核苷併入法定量b細胞增殖。
cho-hcd40l驅動之初級人類b細胞增殖:
用人類cd40l轉染cho細胞以產生以較高cd40l表現程度表現於細胞表面上之穩定細胞株。以10,000拉德(rad)照射cho-cd40l細胞,隨後用人類b細胞培育。在96孔圓底培養盤中以每孔200μl之最終體積用1×103個cho-cd40l細胞(cho-cd40l:人類b細胞之比率為1:100)以及不同滴定量之抗體多肽培育1×105個扁桃體人類b細胞。在37℃下培育培養盤72小時,隨後添加3h-胸腺嘧啶核苷(0.5μci/孔)6小時。基於胸腺嘧啶核苷併入法定量b細胞增殖。
可溶性iz-hcd40l驅動之獼猴脾人類b細胞增殖:
在96孔圓底培養盤中以每孔200μl之最終體積用0.5μg/mliz-hcd40l以及不同滴定量之抗體多肽培育1×105個獼猴脾b細胞。在37℃下培育培養盤72小時,隨後添加3h-胸腺嘧啶核苷(0.5μci/孔)6小時。基於胸腺嘧啶核苷併入法定量b細胞增殖。
初級t細胞驅動之人類b細胞增殖:
自人類周邊血液單核細胞(peripheralbloodmononuclearcells,pbmc)分離t細胞且使用綿羊紅血球(sheepredbloodcell,srbc)花結法富集。藉由將扁桃體組織均質化於單細胞懸浮液中分離人類扁桃體b細胞。藉由菲科爾分離(ficollseparation)獲得白血球,接著使用srbc花結法被動選擇b細胞且藉由去除花結細胞來富集。
在37℃下用pm-lcl(ebv轉化b細胞株;以10,000拉德照射)以5:1之比率(t:lcl)培養富集人類t細胞6天以產生同種異體t細胞群。在第6天,分離擴增之t細胞且以3000拉德照射,且接著在塗有抗cd3mab(okt3)之96孔平底培養盤中,用初級人類扁桃體b細胞(每孔1×105個b細胞)以1:2之比率培養(每孔5×104個t細胞)。將不同滴定量之抗體多肽添加至各孔中;各孔之最終體積為200μl。在37℃下培育測試培養盤3天。在最後18小時內經由添加3h-胸腺嘧啶核苷(0.5μci/孔)至培養物中測定人類b細胞增殖。
cho-hcd40l驅動之初級人類單核細胞衍生之樹突狀細胞(dc)活化:
藉由經由srbc花結法去除t細胞來使人類pbmc富集單核細胞。在37℃,下在6孔培養盤中用10ng/mlgm-csf及5ng/mlil-4培養富集單核細胞之pbmc6天。在第2天及第5天用新鮮培養基(具有gm-csf及il-4)補充所培養之培養盤。在細胞分析中在第6天使用未成熟樹突狀細胞(dc)。在96孔平底培養盤中,用4×103個cho-hcd40l細胞(以10,000拉德照射)以及不同滴定量之抗體多肽培養8×104個未成熟dc。24小時後,收集上清液且測試各種細胞激素(il-12、tnf、il-23)之存在。dc活化藉由細胞激素之產生量來測定。
表17
實施例7
結合cd40及血清白蛋白之雙特異性dab
構築特異性結合cd40及人類血清白蛋白(hsa)或獼猴血清白蛋白(csa)之雙特異性dab且在基於細胞之分析中測試其活性。白蛋白特異性dab稱為「albudab」。在此實施例中,albudab融合物包含結合cd40之bms3hdab及識別hsa之另一域抗體dom7h。將兩種dab在框架中融合至胺基酸連接子之胺基及羧基末端以形成串聯融合(inlinefusion,ilf)多肽。ilf多肽以重組方式表現為單一融合蛋白。表明albudabilf之活性的rba描述於下文,且結果示於表18中。表19概述所測試albudabilf中所用之連接子序列。藉由biacoretm分析測定之動力學結合數據示於表20中。
在上清液中偵測dab之人類cd40cho細胞elisa:
使用0.25%胰蛋白酶edta自細胞培養燒瓶分離穩定轉染之表現人類cd40之cho-dg44細胞或天然cho-dg44細胞(皆為bms),且將每孔100,000個細胞於生長培養基中接種至96孔組織培養物處理之培養盤(nunc)中。在37℃、5%co2下,在溼潤氛圍中使細胞黏附隔夜。分析當天,用pbs洗滌細胞片,隨後用2%三聚甲醛(sigma-aldrich)固定20分鐘。固定之後,再用pbs洗滌細胞片,隨後用含15%胎牛血清(fbs,paa)之pbs阻斷1小時。再洗滌培養盤一次,隨後添加每孔100μldab上清液且在室溫下培育2小時。用細胞培育dab上清液之後,洗滌培養盤且視dab為vh或vl域而定由培育辣根過氧化物酶(hrp)結合物抗蛋白質a或l來偵測dab結合。在用1mhcl中和之後,使用spectramaxm5e培養盤讀取器(moleculardevices)在450nm下量測吸亮度信號。
icam-1上調細胞分析:
使用凡爾生(invitrogen)自細胞培養燒瓶分離穩定轉染之表現人類cd40l之cos細胞。將每孔20,000個細胞於分析緩衝液(無酚紅(sigma-aldrich,uk)+1%青黴素/鏈黴素+10%fbsgold(皆來自paalaboratories,uk)之rpmi1640)中接種至96孔高結合黑壁透明底培養盤(corning,uk)中。在37℃及5%co2下,在溼潤氛圍中使細胞黏附隔夜。第二天,用100μl新鮮分析緩衝液補充含有非附著細胞之廢分析緩衝液。為此,除稀釋範圍之dab之外,在分析緩衝液中添加每孔20,000個ramos細胞。將分析培養盤再放回37℃及5%co2下之溼潤氛圍中24小時。對於陰性對照孔,不添加ramos細胞。dab抑制ramos細胞之細胞表面上的icam-1響應暴露於cos細胞之細胞表面上的cd40l而上調之能力藉由添加0.5μg/ml小鼠抗人類icam-1抗體(r&dsystems)及0.2μg/ml山羊抗小鼠alexaflour647(invitrogen,molecularprobes,uk)來評估。在無燈存在下3小時培育期之後,如由ab8200細胞偵測平臺(appliedbiosystems)所量測來偵測相對螢光。
結合至血清白蛋白之串聯融合(ilf)動力學分析
使用biacoretm3000儀器(gehealthcare)分析抗cd40-albudabilf對人類及獼猴血清白蛋白之結合動力學。使用胺偶合套組(gehealthcare)將約400反應單位(ru)之人類血清白蛋白(hsa)或獼猴血清白蛋白(csa)固定於cm5biacoretm晶片之流槽上。將未固定有任何配位體之第二流槽用作參比流槽進行線內參比。用hbs-ep緩衝液(具有0.15mnacl、3mmedta及0.005%v/v界面活性劑p20之0.01mhepes(ph7.4),gehealthcare)製備一系列適當二倍稀釋之各待分析之dab。使用儀器之kinject功能一式兩份注射兩種100微升各ilf。在串聯之固定血清白蛋白之流槽及參比流槽上進行注射,線內減去來自參比槽之信號。在25℃及40μl/min之hbs-ep流速下執行實驗。各注射完成後,允許在緩衝液中自配位體解離dab120秒,隨後由注射10μl10mm甘氨酸(ph2.0)而再生。亦在相同條件下注射hbs-ep緩衝液空白參比注射劑(不包含分析物),以用作自各分析物跡線減去之第二參比。使用biaevaluation4.1軟體(gehealthcare)自各分析物跡線減去參比流槽跡線與緩衝液空白跡線。使用同一軟體同時整體擬合分析物稀釋液系列跡線之締合及解離階段的1:1(朗繆爾)動力學模型。此模型產生相互作用之締合及解離速率常數(分別為ka及kd)及平衡解離常數(kd)。參數值示於表20中。
表21列出可特異性結合cd40及hsa或csa之代表性albudabilf之胺基酸序列。各ilf之名稱鑑別特定連接符序列:「gxs」意謂連接符具有「x」個甘氨酸殘基之後為絲氨酸,且「(gxs)y」意謂連接符具有y個gxs之重複單元。表22揭示編碼表21中所列之ilf序列之代表性核酸。如此項技術中所熟知,多個密碼子可編碼同一胺基酸。因此,編碼蛋白質序列之核酸包括具有密碼簡併性之核酸。
表21
雙特異性dab胺基酸序列
(表21揭示分別如seqidno5至7、1207至1209及8所示之「ast」、「tvaaps」、「tva」、「g4s」、「(g4s)3」、「(g4s)5」及「astsgps」)
表22
編碼雙特異性dab之聚核苷酸
(表22揭示分別如seqidno5至7、1207至1209及8所示之「ast」、「tvaaps」、「tva」、「g4s」、「(g4s)3」、「(g4s)5」及「astsgps」)
實施例8
抗獼猴cd40dab
本文所揭示之產生特異性結合人類cd40之抗體多肽之方法可用以產生特異性結合其他物種之cd40之抗體多肽。舉例而言,可使用目前揭示之方法產生抗獼猴cd40(anti-cynomolgus/anti-cyno)抗體多肽。舉例而言,可使用相同之初始/初步篩檢及親和力成熟流程產生抗獼猴cd40抗體多肽,作為抗人類cd40dab。且以下表23中揭示獲得抗獼猴cd40dab之方法且提供抗獼猴cd40dab之代表性實施例。
elisarba:
在4℃下,透明壁高結合384孔培養盤(corning,uk)用25μl1μg/ml中性鏈親和素於碳酸鹽緩衝液中之溶液塗布隔夜。第二天,用0.1%吐溫pbs緩衝液洗滌分析培養盤,在室溫下用含1%bsa之pbs阻斷1小時,且再次洗滌。移除過量洗滌緩衝液之後,在室溫下用分析培養盤培育25μl1μg/ml生物素標記人類iz-cd40l(bms,1.2mg/ml儲備液濃度)1小時。同時,稀釋範圍之純化dab與1μg/ml獼猴cd40(bms)以1:1之比率複合。洗滌分析培養盤之後,在室溫下,在輕微攪動下,在分析培養盤中培育dab:獼猴cd40複合物2小時。用辣根過氧化物酶(hrp)結合之抗人類(fc)二次抗體(sigma-aldrich,uk)偵測dab相對於獼猴cd40與生物素標記cd40l之競爭性結合。在用1mhcl中和之後,在450nm下,使用spectromaxm5e培養盤讀取器(moleculardevices)量測吸亮度信號。
使用ab8200fmat之獼猴cd40cho細胞rba:
使用凡爾生(invitrogen)自細胞培養燒瓶分離穩定轉染之表現獼猴cd40之cho-dg44細胞或天然cho-dg44細胞(bms)。將每孔40,000個細胞於具有稀釋範圍之dab、0.25μg/ml生物素標記人類iz-cd40,000l(bms,1.2mg/ml儲備液濃度)及0.25μg/ml抗生蛋白鏈菌素alexafluor647(invitrogen,molecularprobes,uk)之0.1%bsapbs分析緩衝液中接種至96孔高結合黑色壁透明底培養盤(corning,uk)中。在無光存在下培育混合物6小時。培育之後,如用ab8200細胞偵測平臺(appliedbiosystems)所量測,使用相對螢光評估dab相對於獼猴cd40cho細胞與可溶性生物素標記iz-cd40l之競爭性結合。
cho-hcd40l驅動之初級人類b細胞增殖:
用人類cd40l轉染cho細胞(atcc)以產生以較高cd40l表現程度表現於細胞表面上之穩定細胞株。以10,000拉德照射cho-cd40l細胞,隨後用人類b細胞培育。在96孔圓底培養盤中以每孔200μl之最終體積用1×103個cho-cd40l細胞(cho-cd40l:人類b細胞之比率為1:100)以及不同滴定量之dab或單株抗體培育1×105個扁桃體人類b細胞。在37℃下培育培養盤72小時,隨後添加胸腺嘧啶核苷(3h;0.5μci/孔)6小時。基於胸腺嘧啶核苷併入法定量b細胞增殖。除非另外說明,否則所有分析均在補充有10%胎牛血清(fcs)之rpmi培養基中執行。
可溶性iz-hcd40l驅動之獼猴脾b細胞增殖:
在96孔圓底培養盤中以每孔200μl之最終體積用0.5μg/mliz-hcd40l以及不同滴定量之dab或mab培育1×105個自食蟹獼猴脾臟分離之b細胞。在37℃下培育培養盤72小時,在此之後添加3h-胸腺嘧啶核苷(μci/孔)6小時。基於胸腺嘧啶核苷併入法定量b細胞增殖。除非另外說明,否則所有分析均在補充有10%胎牛血清(fcs)之rpmi培養基中執行。
表23
實施例9
抗人類cd40dab不結合獼猴cd40
如同人類cd40中,但獼猴cd40具有leu109殘基替代trp109。以下複製長尾獼猴cd40之胺基酸序列:
使用流式細胞測量方法測試抗人類cd40dab與食蟹獼猴、恆河猴及黑猩猩血液中b細胞及來自狨猿血液之淋巴細胞之交叉反應性。以下詳述之程序概述用於多個實驗中偵測cd40dab之方法。表24中所示之結果表明抗人類cd40dab不結合獼猴cd40。此情況與上文所揭示之跡象(參見圖1及圖2)一致,人類cd40中之trp109(獼猴cd40中不存在)對於dab與人類cd40之間的複合物形成十分重要。
方法:
在37℃下用旋轉器使聚乙二醇化抗人類cd40dab(bms3h-56-5c-40l及bms3h38-2c-p40br)或生物素結合dab(bms3h38-2-生物素)與人類及靈長類動物血液樣品一起培育1小時。將100μl各血液樣品等分至12×75mm管中且用facs緩衝液(0.5%fbs/pbs/0.1%迭氮化鈉)洗滌3次。在1500rpm下將管離心5分鐘,且在洗滌之間傾析上清液。洗滌之後,將管置於冰上且與人類igg一起培育5分鐘以經由fc受體阻斷非特異性結合。
對於聚乙二醇化dab偵測,將抗peg抗體(克隆ch-2074,silverlakeresearch,或克隆2-2,openbiosystems)添加至管中且培育30分鐘。用facs緩衝液洗滌樣品一次,接著在冰上用apc標記cd20抗體(克隆2h7,bdbiosciences)及pe標記抗小鼠igg(具fcγ1特異性;calbiochem)再培育30分鐘。
對於生物素結合dab偵測,將pe標記抗生蛋白鏈菌素(invitrogen)及apc標記cd20抗體(克隆2h7,bdbiosciences)添加至管中且在室溫下培育30分鐘。
另外,為量測人類及靈長類動物血液之cd40含量,在室溫下用與靈長類動物物種(克隆5c3,bdbiosciences)交叉反應之apc標記cd20抗體(克隆2h7,bdbiosciences)及pe標記抗人類cd40抗體培育各血液樣品之等分試樣30分鐘。
為在偵測抗體培育之後溶解紅血球且固定白血球,將facs溶解溶液(bdbiosciences)添加至所有管中,且在室溫下培育樣品15分鐘。離心樣品且再懸浮於facs溶解溶液中,且經bdfacscantotm藉由流式細胞測量術分析,對cd20+b細胞設門進行分析。對於狨猿樣品,cd20抗體不具有交叉反應性;因此對如前向及側向散射特性(尺寸)所鑑別之所有淋巴細胞執行分析。
結果:
根據上文方法,在人類及靈長類動物血液樣品中測試聚乙二醇化及生物素標記抗人類cd40dab之結合。偵測到抗人類cd40dab結合至人類血液樣品中之cd20+b細胞。相反,在獼猴、恆河猴或黑猩猩血液樣品中之cd20+b細胞上或在狨猿血液樣品中之淋巴細胞上未偵測到聚乙二醇化及生物素標記dab之結合。bms3h-38-2c-p40brdab之結果示於圖3畫面a及畫面b中。其他dab獲得類似結果。使用與靈長類動物cd40交叉反應之抗人類cd40抗體確定人類及靈長類動物物種之b細胞上cd40之可比含量。此等資料指示來自bms3h-56及bms3h-38譜系之人類cd40dab不能結合靈長類動物物種中之cd40。該等數據與cd40與抗cd40dab之間形成複合物中trp109殘基之重要性一致,如圖1及圖2中所示。
實施例10
cd40與dabbms3h-56-5之間的複合物之x射線結晶學
數據收集及處理:
在人類cd40(seqidno:1)/bms3h-56-5(seqidno:321)複合物之結構測定期間分析兩種不同晶體形式。自cd40/bms3h56-5複合物之晶體收集數據,驟冷且維持於100k,且安裝於rigakuafc-9測角器上。x射線源為使用具有micromaxtm共焦光學器件及saturn92偵測器之銅目標的rigakufr-e。在極高冗餘度下收集數據以增加硫反常繞射信號,希望使用彼信號以使數據分階段。用hkl2000處理數據(hklresearch;otwinowski等人,inmethodsenzymol.macromolecularcrystallography第a部分,carter等人編,第276卷,第307-326頁,academicpress,inc.,newyork,ny(1997))。此晶體之數據收集統計概述於下文及表24中:
空間群:i222;
單位晶胞:
鑲嵌度為0.59至0.84;排斥觀測:1028;0.06%。
表24
由驟冷至100k且安裝於rayonixmx-225偵測器上之晶體在加拿大光源束線cmcf1(canadianlightsourcebeamlinecmcf1)(08-id-1)下收集第二晶形,且波長為此等數據藉由夏姆洛克結構(shamrockstructures)(r.walter及g.ranieri)收集且用hkl2000處理。此晶體之數據收集統計概述於下文及表25中:
空間群:c2;
單位晶胞:β=118.2°;
鑲嵌度為0.62至0.71;排斥觀測:70;0.08%。
表25
分子置換模型:
dab之模型bms3h-56-5系源自pdbid2vyr鏈e殘基1至124,其中與cdr31至35、50至57及99至111對應之連續殘基藉由split_pdb(其與kabat編號31至35、50至56及95至100g)對應移除,且接著穿過mutate且最終藉由renumber重新編號。mutate使非一致殘基變為最小一致,亦即通常ala或gly,但例如tyr→phe及phe→tyr將產生phe。其不會建立任何原子,但對於thr→val、val→thr、cys→ser及ser→cys,其將取代適當原子名稱,而不會改變位置。renumber將編號變為kabat編號(kabat等人,sequencesofimmunologicalinterest,第5版,美國健康與人類服務部,washington,d.c.(1991)),其為直接描述cdr及構架殘基之抗體之標準編號系統。
使用phenix.ensembler(universityofcambridge,uk),自pdbids1jma(鏈b)、1ncf(鏈a)、1tnr(鏈r)、2hev(鏈r)、2hey(鏈r,t)及2uwi(鏈a、b)構築cd40模型,產生結構集合。此等分子之n端(殘基24至78)加6個殘基區段(殘基95至100)可與cα原子之可接受之均方根距離重迭,且用作cd40之n端區之模型。
分子置換方法:
使用程序phaser(mccoy等人,j.appl.crystallogr.40:658-674(2007))進行分子置換。監測轉譯功能z分數(translationfunctionz-score,tfz)及對數似然增益增加,判定是否存在實際溶液。8及8以上之tfz分數一般表示溶液。較小之tfz分數伴隨對數似然增益之實質增加(>50)亦為可接受之指示。
模型建立、密度改良及結晶改進方法:
用於分子圖形之模型建立手段包括coot程序(emsley等人,actacrystallogrsect.d60:2126-2132(2004);emsley等人,「featuresanddevelopmentofcoot」,actacrystallogrsect.d66:486-501(2010))。使用已知密度改良程序及計算分子之間的歐拉角(eulerianangle)及平移的其他程序執行使用非結晶對稱圖平均法之密度改良。使用自動buster進行改進(globalphasing,ltd.:bricogne等人,actacrystallogr.sect.d60:2210-2221(2004);tronrud等人,actacrystallogr.sect.a43:489-501(1987))。
域抗體編號系統:
用於域抗體之殘基編號系統遵循kabat。以下比較bms3h-56-5之kabat編號與直順序編號:
在kabat編號中,bms3h-56-5具有插入殘基52a、82a、82b、82c,且遺漏殘基100。在兩種編號系統中,給予作為表現構築體之一部分的n端之ser及thr負編號。
測定cd40/bms3h-56-5複合物之結構:
phaser能夠將4個bms3h-56-5dab分子定位於i222晶形中且將3個bms3h-56-5dab分子定位於c2晶形中。在i222晶形中,tfz分數在7.6至41.0之範圍內,且對數似然增益之增加在77至446之範圍內。用於bms3h-56-5dab分子之此等溶液經由i222晶體形成螺旋狀dab分子行,其藉由大信道與其他行分離。在c2晶形中,tfz分數在7.7至16.5之範圍內,且對數似然增益之增加在110至150之範圍內。將dab包裝於此晶形中並不重複或對稱。
使用cd40n端結構域之集合模型,可將cd40之n端結構域之4個分子置於i222晶形中,其中tfz分數在5.7至8.5之範圍內,且對數似然增益之增加在83至389之範圍內。i222晶形中cd40之4個n端結構域在4行dab分子之間的正中心形成凝塊。然而,其不會觸碰bms3h-56-5dab分子。在c2晶形中置放cd40之n端結構域之3個分子,其中tfz分數在5.8至12.1之範圍內,且對數似然增益之增加在100至198之範圍內。在此晶形中,n端結構域亦不接觸bms3h-56-5dab分子。
在i222晶形中,可將來自cd40/chi220fab複合物之cd40之n端結構域及來自2uwi之n端結構域重迭於cd40n端結構域上。將n端與特定bms3h-56-5dab關聯之能力允許使用非結晶對稱(ncs)圖平均法。ncs平均法之起始相關係數得到非對角值為0.71至0.81。最終非對角值為0.88至0.92。接近於n端區之電子密度是清楚的,且可追蹤bms3h-56-5dab之cdr3之路徑。將來自cd40/chi220fab'複合物之殘基82至94及101至121重迭於2uwi上之相應殘基上,且接著使用coot手動改良擬合。接著將cd40之第二結構域(殘基82至94及101至121)之此位置變換至其他三個n端結構域上。
進行一個改進周期,其中自由剩餘值(r-free)由0.437降至0.380且加工剩餘值(r-work)由0.447降至0.381,與理想之均方根鍵及角偏差有所改良。所得電子密度圖顯示殘基109具有與trp一致之側鏈,且顯示cd40之c端70個殘基中之至少一些殘基所存在之密度。
因為cd40具有小二級結構,從而證明使c端約70個殘基與電子擬合困難,所以搜索結構生物學合作研究協蛋白質資料庫(researchcollaboratoryforstructuralbioinformaticsproteindatabase)之適當模型以有助於引導鏈追蹤。44個中有16個一致及44個中有24個匹配之前兩個採樣數為2aw2及1jma,其具有相同序列:
一致殘基以適當單一字母碼記錄於共同序列在線,且類似殘基以星號記錄於共同序列在線。此情況與cd40之n端結構域之殘基41至84具有相同殘基段:
一致殘基以適當單一字母碼記錄於共同序列在線,且類似殘基以星號記錄於共同序列在線。
匹配雙硫鍵:
比較cd40之殘基41至84及125至168中之雙硫鍵
殘基41至84殘基125至168
c41-c59c125-c143
[c38]-c51
c62-c77c146-c161
c83[-c103]c167[-c186]
括號中之殘基不屬於序列重複中之殘基範圍。
以1jma/2aw2模型作為指導,使用coot程序擬合一個cd40鏈。接著將此擬合模型重迭於其他3個cd40鏈中之一者上。然而,似乎在其他兩個cd40鏈中此新穎殘基段之位置定向不用,且此時其不能擬合。進行一個改進周期,其中自由剩餘值由0.393降至0.366且加工剩餘值由0.400降至0.349,與理想之均方根鍵及角偏差有相當大改良。
將來自i222晶形中之一個分子的bms3h-56-5dab重迭於c2晶形中之3個dab中之每一者上。使用彼變換矩陣定向i222晶形之第二及c端結構域。使用coot程序重建該模型。進行一個改進周期,其中自由剩餘值由0.361降至0.334且加工剩餘值由0.375降至0.306,與理想之均方根鍵及角偏差有所改良。所得電子密度圖對置放更多cd40殘基提供指導。進行另一改進周期,其中自由剩餘值由0.302降至0.287且加工剩餘值由0.299降至0.270,與理想之均方根鍵及角偏差有所改良。
接著使用習知模型建立及改進完成結構測定。若干輪優化產生具有以下統計量之最終改進:自由剩餘值0.260,加工剩餘值0.228,均方根鍵均方根角1.4°。主鏈原子之真實空間相關係數為約0.92且側鏈原子之真實空間相關係數為0.80。最終模型具有13個水分子。
使用來自c2晶形之c端結構域之模型作為指導,使i222晶形中之cd40模型進一步改進。若干周期使用coot程序建立模型及用自動buster程序改進產生以下統計量:自由剩餘值0.323,加工剩餘值0.292,均方根鍵均方根角1.5°。主鏈原子之真實空間相關係數為0.91且側鏈原子之真實空間相關係數為0.80。該模型不包含水分子。
cd40/bms3h-56-5複合物之整體結構:
一個bms3h-56-5dab結合至一個cd40分子。如圖1中所示,bms3h-56-5結合至不同於抗體chi220之抗原決定基,其在n末區中結合。cd40殘基(seqidno:1)顯示為綠色,抗原決定基殘基除外。chi220之cd40抗原決定基殘基顯示為藍色;bms3h-56-5dab抗原決定基殘基顯示為青色。chi220fab及bms3h-56-5β-股顯示為紅色,cdr殘基顯示為洋紅色,且其他環顯示為橙色。具有硫原子之cd40、chi220及bms3h-56-5分子之雙硫鍵顯示為黃色。
i222晶形含有4個結晶學獨立cd40/bms3h-56-5複合物,且c2晶體含有3個結晶學獨立cd40/bms3h-56-5複合物。cd40分子具有一定量之可撓性,且結構域以7種唯一複合物型式不同地排列,但在所有情況下均保留相互作用之總體性質。
bms3h-56-5dab抗原決定基殘基:
bms3h-56-5之最小cd40抗原決定基定義為含有至少一個與bms3h-56-5原子之凡得瓦爾或氫鍵接觸之原子的cd40殘基。所有複合物中之最小抗原決定基含有以下關於seqidno:1之cd40殘基:trp109、leu121、his122、ser124、ser156、ala157、phe158、glu159及his162。在一些複合物中以下其他殘基以凡得瓦爾或氫鍵接觸:pro85、asn86、leu87、gly88、glu106、glu107、gly108、his110、thr112、cys119、val120、gln133、ile134、ala135、thr136、ser155、lys160。
最大cd40抗原決定基定義為含有藉由探針球內埋之原子的殘基。此等殘基包括以上所有殘基加所有複合物中之val154。在一些複合物中,其他內埋殘基為:ser118、arg123、thr141、phe151、asp153、cys161及pro163。
具有接觸殘基之bms3h-56-5之表面的描述示於圖2中。顯示接觸bms3h-56-5殘基。亦顯示內埋殘基。cd40表示為用橙色表示非重複二級結構且用洋紅色表示抗原決定基殘基之草圖。亦顯示為棒(呈青色之碳原子)的是cd40殘基trp109、ala115、leu121、ser126及his162,其為人類與食蟹獼猴(長尾獼猴)之間不同之七種殘基中之五者。ala115及ser126位於cd40之bms3h-56-5結合位點之相對側。trp109及leu121在位於cdr-3與fr-2(bms-3h-56-5殘基leu45及arg47)之間的bms-h-56-5之間隙中結合。cd40之his162與bms3h-56-5dab之cdr-2之arg56相互作用。trp109之突變會顯著降低或消除bms3h-56-5活性。
視結晶學獨立複合物而定,660至之cd40表面積由16至21個接觸殘基(更精確地表示為46至67個接觸原子)內埋。對於bms3h-56-5,660至之表面積由14至17個接觸殘基(更精確地表示為48至62個接觸原子)內埋。視結晶學獨立複合物而定,此等接觸產生3至7個氫鍵及111至142凡得瓦爾作用力。
實施例11
鑑別cd40上之dab結合抗原決定基
為了鑑別cd40上之dab結合抗原決定基,針對七種在殘基76、109或121處含有特定胺基酸殘基取代之cd40-fc融合蛋白測試dab結合。此等cd40-fc融合蛋白包括野生型人類cd40(wt-hcd40)、野生型食蟹獼猴cd40(wt-ccd40)及特定胺基酸殘基突變為來自食蟹獼猴cd40(m1、m2、m4、m5)或黑猩猩cd40(m3)之序列之相應殘基的五種突變型人類cd40蛋白(m1至m5)。胺基酸取代列於表26中。
野生型人類cd40細胞外域(1至193)之序列系來自refseq:寄存編號nm_001250.3。在表26所示之位置使用野生型序列之定點突變誘發產生獼猴及突變型構築體。細胞外域與凝血酶可裂解連接符dpgggggrlvprgfgtgdp(seqidno:1273)融合,該凝血酶可裂解連接符與人類igg1fc融合。該等蛋白質表現於用tig-pyd7-gatedurocher表現載體轉染之hek-293-6e細胞中。五天之後收集上清液。使用蛋白質a速流層析自條件培養基純化各cd40蛋白質。管柱用pbs(20mm磷酸鈉、0.15mnacl,ph7.2)洗滌,且接著使用80mm乙酸鈉(ph3)溶離至五分之一體積之1mtris-hcl(ph8)中。溶離液於pbs中流過superdex-200管柱。
表26
分析來自3h217、3h37、3h38及3h56譜系之代表性dab與表26中所列之cd40-fc融合蛋白的結合。用bioradproteonxpr36spr儀器執行分析。spr表面系藉由在乙醇胺阻斷下使用標準乙基(二甲基胺基丙基)碳化二亞胺(edc)/n-羥基丁二醯亞胺(nhs)化學反應,將8μg/ml抗人類igg(fc)抗體(biacore/gehealthcare)於10mm乙酸鈉(ph4.5)中之混合物固定於bioradglc傳感器晶片上來製備。用於固定及動力學結合分析之操作緩衝液為10mm磷酸鈉、130mm氯化鈉、0.05%吐溫20,ph7.1。在此等表面上經由fc尾在垂直方向上捕捉濃度為20μg/ml之cd40-fc融合蛋白,且將缺乏cd40-fc蛋白之參比表面用於參比減去。藉由在25℃下,使用240秒締合時間及420秒解離時間,以30μl/min之流速使405、135、45、15及5nmdab分析物水平方向流經捕捉之cd40-fc表面來執行動力學實驗。該等表面用30秒脈衝之3mmgcl2,隨後用操作緩衝液以60μl/min流過在水平與垂直方向再生。雙重參比傳感器圖譜數據,且接著使用bioradproteonmanagerv.2.1.0.38軟體擬合成1:1朗繆爾模型,以測定締合速率常數(ka)、解離速率常數(kd)及平衡解離常數(kd)。
發現3h-37、3h-38及3h-56譜系之所有dab以高親和力(kd<10-8m)結合至含有人類cd40殘基w109及l121之cd40-fc融合蛋白,但與具有來自食蟹獼猴cd40(l109、p121)或黑猩猩cd40(r109)之相應殘基之cd40-fc融合蛋白的結合顯著降低或不可偵測到。此情況指示來自3h37、3h38及3h56-譜系各者之dab特異性結合至包括人類cd40之殘基109及121之抗原決定基。相反,3h-217譜系之所有測試成員以類似親和力結合至所有所測試cd40-fc融合蛋白,指示3h-217譜系之成員結合至不包括殘基76、109或121之cd40上之位點。因此,3h-217譜繫結合至與3h-37、3h-38及3h-56譜系不同之抗原決定基。表27概示使用spr用proteonxpr36儀器針對dab結合至cd40-fc融合蛋白所測定之kd值。表27中之「x」意謂沒有任何證據表明在此等條件下存在結合。
表27
表28顯示使用spr用proteonxpr36儀器針對dab結合至cd40-fc融合蛋白所測定之締合速率常數(ka)、解離速率常數(kd)及平衡解離常數(kd)。表28中之「x」意謂沒有任何證據表明在此等條件下存在結合。
表28
實施例12
構築fc融合多肽
如本文所揭示,可構築各種組態之包含dab之抗體多肽。在此實施例中,各種dab與fc域融合產生抗人類cd40可變域構築體之fc融合多肽,諸如3h37-202、3h37-235、3h37-258及3h37-202。
在一個代表性實施例中,dabbms3h-56-269(seqidno:417)與經修飾之igg1(igg1*)fc域(seqidno:1284)融合。在dab-igg1*fc域融合多肽中,dabbms3h-56-269之c端融合至具有序列ala-ser-thr之連接符三肽,其又與igg1*fc域(seqidno:1284)融合。igg1*fc域含有修飾c5s,係指seqidno:1284中之位置編號。igg1fc域之c5通常與igg分子之輕鏈中之cys殘基形成雙硫鍵。igg1*fc域亦含有c11s及c14s突變以消除igg1鉸鏈區中之鏈間雙硫鍵。最終,igg1*fc域含有p23s突變以降低fc域效應功能。dab-igg1*fc融合多肽具有以下序列,其中ala-ser-thr連接符呈粗體且fc域之修飾呈粗斜體:
seqidno:1286中所示之dab-igg1*fc融合多肽為計算分子量為39,127da之單體。其可形成計算分子量為78,254da之二聚體。
或者,dabbms3h-56-269(seqidno:417)與人類igg4fc域(seqidno:1285)融合。dabbms3h-56-269之c端又融合至ala-ser-thr連接符,該ala-ser-thr連接符與igg4fc域(seqidno:1285)融合。igg4fc域含有修飾s10p,係指seqidno:1285中之位置編號。bms3h-56-269-igg4fc融合多肽具有以下序列,其中ala-ser-thr連接符呈粗體且s10p修飾呈粗斜體:
seqidno:1287中所示之bms3h-56-269-igg4fc融合多肽為計算分子量為38,867da之單體。其可形成計算分子量為77,734da之二聚體。
下文比對bms3h-56-269(seqidno:417)、bms3h-56-269-igg1*fc融合多肽(seqidno:1286)及bms3h-56-269-igg4fc融合多肽(seqidno:1287)之序列,其中fc域之起始用箭頭標出:
使用實施例11中所揭示之細胞培養方法表現fc融合多肽。管柱用pbs(20mm磷酸鈉、0.15mnacl,ph7.2)洗滌,且接著使用80mm乙酸鈉(ph3)溶離至五分之一體積之1mtris-hcl(ph8)中。溶離液於pbs中流過superdex-200管柱。
實施例13
cd40fc融合多肽活性分析
功能上分析抗人類cd40fc融合多肽拮抗cd40活性之能力。所測試之cd40活性為藉由hcd40l驅動之初級人類單核細胞源性樹突狀細胞(dc)活化發生之b細胞增殖及細胞激素產生。使用實施例6中所揭示之分析量測b細胞增殖及細胞激素產生。除非另外說明,否則所有分析均在補充有10%胎牛血清(fcs)之rpmi培養基中執行。dab-fc域融合多肽展示cd40依賴性活化之有效抑制作用(亦即拮抗作用)。注意到在任何人類cd40特異性dab-fc域融合多肽中無促效特性。使用各種分析得到之結果示於表29中。使用實施例11中所揭示之分析來分析3h56-269-igg4與固定之人類cd40之結合。對於3h56-269-igg4,在30pm、25℃下及在40pm、37℃下量測結合固定之人類-cd40的表觀親合力影響之kd值。
表29
儘管已根據上文實施例詳細描述了本發明實施例,但應了解在不背離此等實施例之精神的情況下可作出各種修改,且將易於為習此相關技藝之人士所知。
序列表
百時美施貴寶公司
多曼蒂斯有限公司
拮抗cd40之抗體多肽
200896-0004-00-wo(481834)
61/477,904
2011-05-18
1287
patentinversion3.5
1
277
prt
人
1
metvalargleuproleuglncysvalleutrpglycysleuleuthr
151015
alavalhisprogluproprothralacysargglulysglntyrleu
202530
ileasnserglncyscysserleucysglnproglyglnlysleuval
354045
seraspcysthrgluphethrgluthrglucysleuprocysglyglu
505560
serglupheleuaspthrtrpasnarggluthrhiscyshisglnhis
65707580
lystyrcysaspproasnleuglyleuargvalglnglnlysglythr
859095
sergluthraspthrilecysthrcysglugluglytrphiscysthr
100105110
serglualacysglusercysvalleuhisargsercysserprogly
115120125
pheglyvallysglnilealathrglyvalseraspthrilecysglu
130135140
procysprovalglyphepheserasnvalserseralapheglulys
145150155160
cyshisprotrpthrsercysgluthrlysaspleuvalvalglngln
165170175
alaglythrasnlysthraspvalvalcysglyproglnaspargleu
180185190
argalaleuvalvalileproileilepheglyileleuphealaile
195200205
leuleuvalleuvalpheilelyslysvalalalyslysprothrasn
210215220
lysalaprohisprolysglngluproglngluileasnpheproasp
225230235240
aspleuproglyserasnthralaalaprovalglngluthrleuhis
245250255
glycysglnprovalthrglngluaspglylysgluserargileser
260265270
valglngluarggln
275
2
278
prt
食蟹獼猴(macacafascicularis)
2
metvalargleuproleuglncysvalleutrpglycysleuleuthr
151015
alavaltyrprogluproprothralacysargglulysglntyrleu
202530
ileasnserglncyscysserleucysglnproglyglnlysleuval
354045
seraspcysthrgluphethrgluthrglucysleuprocysglyglu
505560
serglupheleuaspthrtrpasnarggluthrargcyshisglnhis
65707580
lystyrcysaspproasnleuglyleuargvalglnglnlysglythr
859095
sergluthraspthrilecysthrcysglugluglyleuhiscysthr
100105110
serglusercysglusercysvalprohisargsercysleuprogly
115120125
pheglyvallysglnilealathrglyvalseraspthrilecysglu
130135140
procysprovalglyphepheserasnvalserseralapheglulys
145150155160
cysargprotrpthrsercysgluthrlysaspleuvalvalglngln
165170175
alaglythrasnlysthraspvalvalcysglyproglnasparggln
180185190
argalaleuvalvalileproilecysleuglyileleuphevalile
195200205
leuleuleuvalleuvalpheilelyslysvalalalyslysproasn
210215220
asplysvalprohisprolysglngluproglngluileasnphepro
225230235240
aspaspleuproglyserasnproalaalaprovalglngluthrleu
245250255
hisglycysglnprovalthrglngluaspglylysgluserargile
260265270
servalglngluarggln
275
3
119
prt
人工序列
人工序列的描述:合成的
多肽
3
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserseralaalaala
115
4
25
prt
人工序列
人工序列的描述:合成的肽
misc_feature
(1)..(25)
thissequencemayencompass1to5"glyglyglyglyser"
repeatingunits
4
glyglyglyglyserglyglyglyglyserglyglyglyglysergly
151015
glyglyglyserglyglyglyglyser
2025
5
3
prt
人工序列
描述人工序列:合成的
肽
5
alaserthr
1
6
6
prt
人工序列
描述人工序列:合成的
肽
6
thrvalalaalaproser
15
7
3
prt
人工序列
描述人工序列:合成的
肽
7
thrvalala
1
8
7
prt
人工序列
描述人工序列:合成的
肽
8
alaserthrserglyproser
15
9
116
prt
人工序列
描述人工序列:合成的
多肽
9
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
10
116
prt
人工序列
描述人工序列:合成的
多肽
10
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
11
116
prt
人工序列
描述人工序列:合成的
多肽
11
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
12
116
prt
人工序列
描述人工序列:合成的
多肽
12
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
13
116
prt
人工序列
描述人工序列:合成的
多肽
13
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
14
123
prt
人工序列
描述人工序列:合成的
多肽
14
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyralametargtyralaargpheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
15
116
prt
人工序列
描述人工序列:合成的
多肽
15
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleupropheilepheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
16
119
prt
人工序列
描述人工序列:合成的
多肽
16
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrtyr
202530
hismetglntrpvalargglnalaproglylysglyleuglutrpval
354045
sermetileaspalaaspglyleuglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproglyproglnpheglyglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
17
121
prt
人工序列
描述人工序列:合成的
多肽
17
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserglytyr
202530
aspmetglntrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileseralaserglyvalphethrtyrtyralaaspserval
505560
lysglyargphethrthrserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrproasnargphealaleuasnasnpheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
18
108
prt
人工序列
描述人工序列:合成的
多肽
18
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalaglytrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
19
108
prt
人工序列
描述人工序列:合成的
多肽
19
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyralaserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
20
116
prt
人工序列
描述人工序列:合成的
多肽
20
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
21
120
prt
人工序列
描述人工序列:合成的
多肽
21
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetvaltrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
22
108
prt
人工序列
描述人工序列:合成的
多肽
22
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
23
119
prt
人工序列
描述人工序列:合成的
多肽
23
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprolysasn
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralailegluseraspglyglnalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysasnargileproaspleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
24
119
prt
人工序列
描述人工序列:合成的
多肽
24
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspalagly
202530
alametthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileasplysgluglyleuserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileproglyleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
25
119
prt
人工序列
描述人工序列:合成的
多肽
25
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyaspala
202530
alametthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileglnprometglyaspglythrtyrtyralaaspserval
505560
lysglyargphethrvalserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
26
119
prt
人工序列
描述人工序列:合成的
多肽
26
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluaspser
202530
prometthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralailethrserasnglytyrgluthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
27
119
prt
人工序列
描述人工序列:合成的
多肽
27
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspgluhis
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileglyproaspglyphehisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
28
119
prt
人工序列
描述人工序列:合成的
多肽
28
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglutyr
202530
hismetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargilethrproleuglythrleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileproserleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
29
119
prt
人工序列
描述人工序列:合成的
多肽
29
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglythrasn
202530
alametsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserproglyglyasptyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargvalproaspleuleupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
30
119
prt
人工序列
描述人工序列:合成的
多肽
30
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproserglu
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileseralaaspglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alalysglyargvalproaspleuleupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
31
119
prt
人工序列
描述人工序列:合成的
多肽
31
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealagluasp
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargilealavalaspglyaspargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglylysvalproserleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
32
119
prt
人工序列
描述人工序列:合成的
多肽
32
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargthrmet
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargilethrglyaspglymetasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalaglyaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
33
119
prt
人工序列
描述人工序列:合成的
多肽
33
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluargasp
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnalaglyglyvalhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
34
119
prt
人工序列
描述人工序列:合成的
多肽
34
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspaspasp
202530
sermetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserseraspglyalaserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
35
119
prt
人工序列
描述人工序列:合成的
多肽
35
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrgluglu
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspservalglygluglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
36
119
prt
人工序列
描述人工序列:合成的
多肽
36
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseraspser
202530
alametsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspasnproglyglnhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrvalprothrleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
37
119
prt
人工序列
描述人工序列:合成的
多肽
37
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglnhis
202530
sermetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspglyglyglytyrasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglygluvalproargleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
38
119
prt
人工序列
描述人工序列:合成的
多肽
38
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglnglu
202530
prometthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargilealatyrasnglyglyaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyilethrproasnleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
39
119
prt
人工序列
描述人工序列:合成的
多肽
39
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluasntyr
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnalathrglyserilethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalileprohisleumetpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
40
119
prt
人工序列
描述人工序列:合成的
多肽
40
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargilethrglythrglyasnserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglnglyvalvalprotyrleualapheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
41
119
prt
人工序列
描述人工序列:合成的
多肽
41
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglualaasp
202530
alametthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnvalaspglyaspargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrvalprothrleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
42
119
prt
人工序列
描述人工序列:合成的
多肽
42
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspargala
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserglygluglylyscysthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglymetvalproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
43
119
prt
人工序列
描述人工序列:合成的
多肽
43
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphehistrpglu
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnserserglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglymetvalproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
44
119
prt
人工序列
描述人工序列:合成的
多肽
44
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaaspglu
202530
prometthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileproprogluglyalaprothrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyilethrproasnleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
45
119
prt
人工序列
描述人工序列:合成的
多肽
45
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphehisasnhis
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserargglyglyleuglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyilevalproaspleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
46
119
prt
人工序列
描述人工序列:合成的
多肽
46
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnglutyr
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnglyaspglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyileileproalametglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
47
119
prt
人工序列
描述人工序列:合成的
多肽
47
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyaspval
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspprotyrglyserasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyilemetproserleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
48
119
prt
人工序列
描述人工序列:合成的
多肽
48
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasptyr
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileseralaleuglyalathrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglnleuproalaleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
49
119
prt
人工序列
描述人工序列:合成的
多肽
49
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphelysargtyr
202530
tyrmetthrtrpvalargglnalaproglylysaspleuglutrpval
354045
serglyilevalproserglyasnargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileproaspleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
50
122
prt
人工序列
描述人工序列:合成的
多肽
50
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasptyr
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserprothrglyglyglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalileprotyrleuserpheserpropheasptyrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
51
122
prt
人工序列
描述人工序列:合成的
多肽
51
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserlystyr
202530
trpmetglytrpalaargglnalaproglylysglyleuglutrpval
354045
serserileaspserhisglyalaglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargvalgluaspthralavaltyrtyrcys
859095
alalysglyalaprolysphemetthrthrtyrthrpheasptyrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
52
117
prt
人工序列
描述人工序列:合成的
多肽
52
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheleusertyr
202530
promethistrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspserargglyservalthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyhissertrpthrpheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
53
119
prt
人工序列
描述人工序列:合成的
多肽
53
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasnser
202530
asnmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnproaspglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluglyargileprothrleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
54
119
prt
人工序列
描述人工序列:合成的
多肽
54
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyproarg
202530
argmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspaspileglyargargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluglyalaglnglyvalleuleupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
55
117
prt
人工序列
描述人工序列:合成的
多肽
55
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluasptyr
202530
argmetvaltrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserthrserglygluleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluthralaglyglnphepheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
56
116
prt
人工序列
描述人工序列:合成的
多肽
56
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproglutyr
202530
glumetvaltrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserarggluglyargalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnasnleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
57
116
prt
人工序列
描述人工序列:合成的
多肽
57
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrtyr
202530
glumetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserserserglyasntyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleumetpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
58
116
prt
人工序列
描述人工序列:合成的
多肽
58
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspthrglu
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserproasnglyalaphethrphetyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproileleupheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
59
117
prt
人工序列
描述人工序列:合成的
多肽
59
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyhistyr
202530
aspmetvaltrpvalargglnalaproglyargglyleuglutrpval
354045
serthrileasnglyalaglyleuasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglnseralaserargilepheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
60
117
prt
人工序列
描述人工序列:合成的
多肽
60
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargsertyr
202530
glumetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserthrleuglythrlysthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglnserserthrhisilepheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
61
117
prt
人工序列
描述人工序列:合成的
多肽
61
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheileargtyr
202530
glumetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserserserglytrpthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysseraspalahisilepheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
62
117
prt
人工序列
描述人工序列:合成的
多肽
62
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphetyralatyr
202530
glumetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseraspaspglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspleuglyglnglypheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
63
119
prt
人工序列
描述人工序列:合成的
多肽
63
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasphis
202530
glymetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileglyproserglyglualathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
64
116
prt
人工序列
描述人工序列:合成的
多肽
64
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglusergln
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargserasppheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
65
117
prt
人工序列
描述人工序列:合成的
多肽
65
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyasptyr
202530
aspmettrptrpvalargglnalaproglylysglyleuglutrpval
354045
serargilearghisproglyglyvalthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalavalprolysglypheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
66
119
prt
人工序列
描述人工序列:合成的
多肽
66
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargvaltyr
202530
trpmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspproglnglyglymetthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaargileproasnleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
67
119
prt
人工序列
描述人工序列:合成的
多肽
67
gluvalglnleuleugluserglyglyglyleuvalglnproglyglu
151015
serleuargleusercysalaalaserglyphethrpheseralatyr
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnprothrglysertyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalalysileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
68
121
prt
人工序列
描述人工序列:合成的
多肽
68
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaaspser
202530
glumetmettrpvalargglnalaproglylysglyleuglutrpval
354045
serglyilealahisasnglyglyhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaglyhisproglnglnthrglualapheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
69
116
prt
人工序列
描述人工序列:合成的
多肽
69
glumetglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealathrtyr
202530
aspmettyrtrpvalargglnalaproglylysglyleuglutrpval
354045
serlysileserproasnglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrglnthrhispheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
70
116
prt
人工序列
描述人工序列:合成的
多肽
70
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheservaltyr
202530
aspmetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileserserserglythrtyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrprolysasnpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
71
117
prt
人工序列
描述人工序列:合成的
多肽
71
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserhisglu
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargthrargserlyspheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
72
120
prt
人工序列
描述人工序列:合成的
多肽
72
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglulystyr
202530
ilemetglytrpalaargglnalaproglylysglyleuglutrpval
354045
serthrileasptyrtrpglyglnhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargserhisleuileproleuglnpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
73
123
prt
人工序列
描述人工序列:合成的
多肽
73
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserasptyr
202530
alametglytrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilesertyrvalglytyrtyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyslysalaleuargglyglualaphethrgluargpheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
74
123
prt
人工序列
描述人工序列:合成的
多肽
74
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyprotyr
202530
metmethistrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilegluvalasnglyasnargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystrpvalglyserlysthrserserasplysserpheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
75
120
prt
人工序列
描述人工序列:合成的
多肽
75
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglythrthr
202530
glumetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileglyseralaglyalatrpthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysileglyglyhisproglnglyglnpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
76
119
prt
人工序列
描述人工序列:合成的
多肽
76
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproargglu
202530
trpmetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileglnprometglyglnthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrserargasnlysglyphepheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
77
119
prt
人工序列
描述人工序列:合成的
多肽
77
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrserglu
202530
tyrmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serserileglnargtyrglyserthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyshisgluserasntrpgluthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
78
123
prt
人工序列
描述人工序列:合成的
多肽
78
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheservaltyr
202530
sermetglntrpvalargglnalaproglylysglyleuglutrpval
354045
seralailethrproasnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysthrleuglyargglysertyrproglyvalasppheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
79
119
prt
人工序列
描述人工序列:合成的
多肽
79
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprosertyr
202530
alametthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargilethralaaspglythrvalthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyserileprometleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
80
120
prt
人工序列
描述人工序列:合成的
多肽
80
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrtyr
202530
aspmetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserproasnglythrglyiletyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysasnglnservalhishisalavalpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
81
119
prt
人工序列
描述人工序列:合成的
多肽
81
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluasntyr
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargilealaprohisglyargleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglnileprometleuasppheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
82
121
prt
人工序列
描述人工序列:合成的
多肽
82
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserhistyr
202530
metmetmettrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileserhispheglyaspilethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysasnaspmetvalmetlysasnglyglypheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
83
119
prt
人工序列
描述人工序列:合成的
多肽
83
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluargtyr
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspserargglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyleuvalprohisleuargpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
84
117
prt
人工序列
描述人工序列:合成的
多肽
84
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasnala
202530
glnmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspalametglyaspalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglylysvalproserileasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
85
117
prt
人工序列
描述人工序列:合成的
多肽
85
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasnala
202530
glnmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspalametglyaspalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalileproalapheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
86
118
prt
人工序列
描述人工序列:合成的
多肽
86
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglnasnasp
202530
argmethistrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralathrglyglyaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglnthrglythrasnargpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
87
119
prt
人工序列
描述人工序列:合成的
多肽
87
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnglnpro
202530
tyrmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspalaserglyglythrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alalysaspargileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
88
119
prt
人工序列
描述人工序列:合成的
多肽
88
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspasnglu
202530
asnmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspglyglyglytyrasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglnvalprogluleuleupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
89
119
prt
人工序列
描述人工序列:合成的
多肽
89
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphevalserser
202530
asnmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
90
119
prt
人工序列
描述人工序列:合成的
多肽
90
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphevalserser
202530
asnmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
91
119
prt
人工序列
描述人工序列:合成的
多肽
91
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseraspasp
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnaspalaglyserserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrileproleuleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
92
119
prt
人工序列
描述人工序列:合成的
多肽
92
glumetglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphevalserasp
202530
thrmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspglythrglyglyaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalaglyaspthralavaltyrtyrcys
859095
alalysglyleuileproaspleuglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
93
119
prt
人工序列
描述人工序列:合成的
多肽
93
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspgluglu
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileileglyglyglyhisgluthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrileproleuleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
94
119
prt
人工序列
描述人工序列:合成的
多肽
94
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspasnglu
202530
asnmetthrtrpvalargglnalaproglylysaspleuglutrpval
354045
serargilethrgluargglyaspvalthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrvalprothrleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
95
119
prt
人工序列
描述人工序列:合成的
多肽
95
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspgluglu
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileileglyglyglyhisgluthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrvalprothrleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
96
119
prt
人工序列
描述人工序列:合成的
多肽
96
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphehisgluthr
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileasnargleuglyglnaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileproglyleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
97
119
prt
人工序列
描述人工序列:合成的
多肽
97
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseraspasp
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnaspalaglyserserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglythrvalprothrleuglupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
98
119
prt
人工序列
描述人工序列:合成的
多肽
98
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspasnglu
202530
asnmetthrtrpvalargglnalaproglylysaspleuglutrpval
354045
serargilethrgluargglyaspvalthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
99
119
prt
人工序列
描述人工序列:合成的
多肽
99
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseraspasp
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasnaspalaglyserserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyilethrproasnleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
100
119
prt
人工序列
描述人工序列:合成的
多肽
100
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaaspglu
202530
prometthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileproprogluglyalaprothrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyleuileproaspleuglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
101
119
prt
人工序列
描述人工序列:合成的
多肽
101
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglnaspser
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralailealaalaproglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargileproasnleuargpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
102
119
prt
人工序列
描述人工序列:合成的
多肽
102
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphevalserasp
202530
thrmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspglythrglyglyaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglnvalprogluleuleupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
103
119
prt
人工序列
描述人工序列:合成的
多肽
103
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglnaspser
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralailealaalaproglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
104
119
prt
人工序列
描述人工序列:合成的
多肽
104
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaalaglyphethrpheaspleuala
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspgluaspglyalaserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alagluglyvalileproserleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
105
119
prt
人工序列
描述人工序列:合成的
多肽
105
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrasplys
202530
hismetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserproaspglythrtyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alagluglyvalileproserleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
106
119
prt
人工序列
描述人工序列:合成的
多肽
106
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealagluasp
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargilealavalaspglyaspargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargthrgluaspthralavaltyrtyrcys
859095
alalysglylysthrprohisleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
107
119
prt
人工序列
描述人工序列:合成的
多肽
107
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaalaglyphethrpheaspleuala
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspgluaspglyalaserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglnvalproalaleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
108
119
prt
人工序列
描述人工序列:合成的
多肽
108
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluaspser
202530
metmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspproglyglyalaglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
109
119
prt
人工序列
描述人工序列:合成的
多肽
109
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluhisala
202530
aspmetsertrpvalargglnalaserglylysglyleuglutrpval
354045
serargileaspasnserglyglnserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
110
119
prt
人工序列
描述人工序列:合成的
多肽
110
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesergluala
202530
glumetasntrpvalargglnalaproglylysglyleuglutrpval
354045
serargilethrthraspglyaspserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
111
119
prt
人工序列
描述人工序列:合成的
多肽
111
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspaspser
202530
aspmetthrtrpvalargglnalaproglylysserleuglutrpval
354045
sertyrileargglyaspaspaspgluthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysasnargileproaspleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
112
121
prt
人工序列
描述人工序列:合成的
多肽
112
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnvalala
202530
aspmetglntrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyshisalaserthrgluglyprothralapheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
113
116
prt
人工序列
描述人工序列:合成的
多肽
113
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyprotyr
202530
aspmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
sertrpileseralahisglyserphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystrpprotyrlyspheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
114
119
prt
人工序列
描述人工序列:合成的
多肽
114
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglysergly
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileglyserasnglyalaaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglymetvalproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
115
119
prt
人工序列
描述人工序列:合成的
多肽
115
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnargphe
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
116
119
prt
人工序列
描述人工序列:合成的
多肽
116
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglygluser
202530
aspmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserproserserargleulyspheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
117
119
prt
人工序列
描述人工序列:合成的
多肽
117
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspserser
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serserilegluasnglnglyglyalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspargileproasnleuvalpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
118
116
prt
人工序列
描述人工序列:合成的
多肽
118
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrleuaspalatyr
202530
promettyrtrpvalargglnalaproglylysglyleuglutrpval
354045
sertrpilealaserglyglyglyalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargthrlysasnpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
119
120
prt
人工序列
描述人工序列:合成的
多肽
119
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphemetsertyr
202530
sermetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serglyilethrserasnglyasnargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserthrglyalaasnserargasnpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
120
121
prt
人工序列
描述人工序列:合成的
多肽
120
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluglytyr
202530
leumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serserilealaalaasnglymetglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyslysproargglyiletrpaspglyasppheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
121
119
prt
人工序列
描述人工序列:合成的
多肽
121
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphehisgluser
202530
thrmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilearghisproglygluphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalaglyaspthralavaltyrtyrcys
859095
alalysglyleuileproaspleuglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
122
121
prt
人工序列
描述人工序列:合成的
多肽
122
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealamettyr
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serserilealaproproglyglyargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglnserleuthrglytyrserargserpheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
123
120
prt
人工序列
描述人工序列:合成的
多肽
123
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserglnasn
202530
prometsertrpvalarghisalaproglylysglyleuglutrpval
354045
serthrileproalaasnglyargprothrsertyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrserglnglnproglyargargpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
124
119
prt
人工序列
描述人工序列:合成的
多肽
124
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasntyr
202530
hismetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileproaspserglylysglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileproserleuleupheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
125
120
prt
人工序列
描述人工序列:合成的
多肽
125
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglntyr
202530
hismetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileasnaspileglyserasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysvalglyglyargglyserpheserpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
126
120
prt
人工序列
描述人工序列:合成的
多肽
126
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesersertyr
202530
aspmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileseralaserglyvalphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysarggluhisalaglyglnpropropheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
127
120
prt
人工序列
描述人工序列:合成的
多肽
127
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnglytyr
202530
alametsertrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileasnalaasnglylystyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyslysleuthrleualaserasntyrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
128
121
prt
人工序列
描述人工序列:合成的
多肽
128
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphemetasptyr
202530
aspmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
serserilethralaleuglylyslysthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspservallystyrproleuasnleupheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
129
120
prt
人工序列
描述人工序列:合成的
多肽
129
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprohistyr
202530
thrmetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileglnserproglytrpargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrglyaspglyleuproleuthrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
130
119
prt
人工序列
描述人工序列:合成的
多肽
130
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserglythr
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileglyaspgluglyglngluthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyvalthrproaspleuthrpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
131
119
prt
人工序列
描述人工序列:合成的
多肽
131
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserserser
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileglyseraspglyproserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
132
119
prt
人工序列
描述人工序列:合成的
多肽
132
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnprogly
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspglyserglyserserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalaaspaspthralavaltyrtyrcys
859095
alalysglyargileprothrleuhispheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
133
119
prt
人工序列
描述人工序列:合成的
多肽
133
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprogluser
202530
metmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serserileglytyrproglyalathrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglyserargaspaspasnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
134
124
prt
人工序列
描述人工序列:合成的
多肽
134
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglnhis
202530
sermethistrpvalargglnalaproglylysglyleuglutrpval
354045
serserileservalproglyprolysthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserleuargaspleuargproglyaspserlysserpheasp
100105110
tyrtrpglyglnglythrleuvalthrvalserser
115120
135
116
prt
人工序列
描述人工序列:合成的
多肽
135
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyserala
202530
alametasptrpvalargglnalaproglylysglyleuglutrpval
354045
serserileasnaspmetglyserasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglnglyglyargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
136
118
prt
人工序列
描述人工序列:合成的
多肽
136
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglytyrasp
202530
argmetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspglyproglyglyalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluglyargargvalproasppheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
137
119
prt
人工序列
描述人工序列:合成的
多肽
137
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglutyr
202530
glumetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileasppropheglysergluthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluglyvalvalproaspleuasnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
138
120
prt
人工序列
描述人工序列:合成的
多肽
138
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasplystyr
202530
valmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileglysertyrglyglyalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargleuthrleuseralathrlyspheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
139
120
prt
人工序列
描述人工序列:合成的
多肽
139
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluasptyr
202530
valmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilealahisargglyaspilethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargargargleuserasptyrargpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
140
119
prt
人工序列
描述人工序列:合成的
多肽
140
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglnphe
202530
aspmettyrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserproalaglythrglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaglyaspargserserleupheasptyrargglyglngly
100105110
thrleuvalthrvalserser
115
141
118
prt
人工序列
描述人工序列:合成的
多肽
141
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphelysaspthr
202530
glymetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserilesersertyrglyargaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alalysleuasnalaalaleuglypheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
142
118
prt
人工序列
描述人工序列:合成的
多肽
142
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyprotyr
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileasnalaproglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglnglnmetserserglyvalpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
143
118
prt
人工序列
描述人工序列:合成的
多肽
143
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserasngln
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspserserglyglnleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysvallysserleualaargpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
144
117
prt
人工序列
描述人工序列:合成的
多肽
144
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprogluser
202530
aspmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproalaglnvalleupheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
145
120
prt
人工序列
描述人工序列:合成的
多肽
145
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluglntyr
202530
valmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileglythrserglylystyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglnargargserleuthrargvalhispheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
146
119
prt
人工序列
描述人工序列:合成的
多肽
146
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyvalglu
202530
hismetsertrpvalargglnalaproglylysglyleuglutrpval
354045
seralailethrglyaspglyaspargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysthrvalsertrpasnglyargpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
147
117
prt
人工序列
描述人工序列:合成的
多肽
147
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealatrptyr
202530
asnmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serargilealaproserglyileilethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyleuargglylyspheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
148
116
prt
人工序列
描述人工序列:合成的
多肽
148
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserasntyr
202530
glumetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserseralaglythraspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglnserleuasnpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
149
116
prt
人工序列
描述人工序列:合成的
多肽
149
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysvalalaserglyphethrpheaspgluglu
202530
prometthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serileileaspproglyglyglyalathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserasnsermetpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
150
121
prt
人工序列
描述人工序列:合成的
多肽
150
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseralatyr
202530
promethistrpvalargglnalaproglylysglyleuglutrpval
354045
serserilealaserserglyilethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysphethrargleuhispheproalaglnpheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
151
119
prt
人工序列
描述人工序列:合成的
多肽
151
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasptyr
202530
alametglytrpvalargglnalaproglylysglyleuglutrpval
354045
serargileserprogluglyserargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuargprotyralaserlyspheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
152
116
prt
人工序列
描述人工序列:合成的
多肽
152
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargprotyr
202530
aspmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileserhisglnglyasnargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysvalserhishispheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
153
118
prt
人工序列
描述人工序列:合成的
多肽
153
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseralatyr
202530
asnmettrptrpalaargglnalaproglylysglyleuglutrpval
354045
sertrpileasnserthrglyserargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysasntrphisargglyargpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
154
117
prt
人工序列
描述人工序列:合成的
多肽
154
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspargtyr
202530
argmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileasnargleuglyglnserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysvallyslyshislyspheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
155
117
prt
人工序列
描述人工序列:合成的
多肽
155
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealahistyr
202530
asnmetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilethrlysthrglypheargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaglyglnpheasppheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
156
118
prt
人工序列
描述人工序列:合成的
多肽
156
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphetyrprotyr
202530
sermethistrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileaspglyserglymetphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluaspserleulysalaserpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
157
117
prt
人工序列
描述人工序列:合成的
多肽
157
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproleutyr
202530
glymettrptrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileglyprotyrglyhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyslysarglyslyslyspheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
158
117
prt
人工序列
描述人工序列:合成的
多肽
158
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproargtyr
202530
argmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serserilethrprotyrglyalahisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrglylystrptyrpheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
159
117
prt
人工序列
描述人工序列:合成的
多肽
159
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnglutyr
202530
alametargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileaspargleuglyleuhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserglyprophethrpheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
160
117
prt
人工序列
描述人工序列:合成的
多肽
160
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluargtyr
202530
asnmetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileaspargleuglyleualathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaglysertrpserpheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
161
118
prt
人工序列
描述人工序列:合成的
多肽
161
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyiletyr
202530
aspmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileserserserglythrhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrproglnprotyrpropheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
162
118
prt
人工序列
描述人工序列:合成的
多肽
162
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphetrpvaltyr
202530
aspmetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileseralathrglyvalhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrproproalaglyargpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
163
119
prt
人工序列
描述人工序列:合成的
多肽
163
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrtyr
202530
aspmetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserproasnglythrglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproproglnvalasnthrglupheasptyrargglyglngly
100105110
thrleuvalthrvalserser
115
164
116
prt
人工序列
描述人工序列:合成的
多肽
164
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglulysglu
202530
aspmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serhisileserproasnglytyralathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalyssertrpserserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
165
118
prt
人工序列
描述人工序列:合成的
多肽
165
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseralathr
202530
prometglutrpalaargglnalaproglylysglyleuglutrpval
354045
serthrilesergluserglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystrpasnserthrthrglypheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
166
117
prt
人工序列
描述人工序列:合成的
多肽
166
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnthrval
202530
aspmetglutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglualaprohisargalapheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
167
119
prt
人工序列
描述人工序列:合成的
多肽
167
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluasplys
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspalaleuglyaspserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluglymetvalproargleulyspheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
168
114
prt
人工序列
描述人工序列:合成的
多肽
168
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserasphis
202530
sermetmettrpvalargglnalaproglylysglyleuglutrpval
354045
seraspilegluprohisglyvalhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaasnprothrpheasptyrtrpglyglnglythrleuvalthrval
100105110
serser
169
122
prt
人工序列
描述人工序列:合成的
多肽
169
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserprohis
202530
thrmethistrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileglyproaspglythrthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargsertyrsertrpaspargglytrpthrpheasptyrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
170
119
prt
人工序列
描述人工序列:合成的
多肽
170
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphetyralaser
202530
aspmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserproasnglytrpaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaasptyrthrtyrhisserpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
171
117
prt
人工序列
描述人工序列:合成的
多肽
171
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealahistyr
202530
asnmetargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilethrlysthrglypheargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaglyglnpheasppheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
172
118
prt
人工序列
描述人工序列:合成的
多肽
172
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserhistyr
202530
hismetglytrpalaargglnalaproglylysglyleuglutrpval
354045
servalileglyproargglyileserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserproserarghisargpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
173
117
prt
人工序列
描述人工序列:合成的
多肽
173
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnglutyr
202530
alametargtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileaspargleuglyleuhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserglyprophethrpheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
174
123
prt
人工序列
描述人工序列:合成的
多肽
174
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyasntyr
202530
sermetlystrpalaargglnalaproglylysglyleuglutrpval
354045
serthrilethrproaspglytrptyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysvalglyaspalavaltrpglytrpileglyglypheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
175
116
prt
人工序列
描述人工序列:合成的
多肽
175
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyasptyr
202530
glymetlystrpvalargglnalaproglylysglyleuglutrpval
354045
seralailethrserasnglyaspphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserleutyrlyspheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
176
123
prt
人工序列
描述人工序列:合成的
多肽
176
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaglyserglyphethrpheprothrtyr
202530
lysmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serpheileasptyrtrpglytrpargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserprotyrsertrpthrhisaspserprohispheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
177
116
prt
人工序列
描述人工序列:合成的
多肽
177
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargprotyr
202530
thrmetcystrpalaargglnalaproglylysglyleuglutrpval
354045
sercysileseraspalaglyserphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargmetserserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
178
122
prt
人工序列
描述人工序列:合成的
多肽
178
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglnasntyr
202530
glnmetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileserglythrglylysasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysthrproglnasntyrpheservalargargpheasptyrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
179
118
prt
人工序列
描述人工序列:合成的
多肽
179
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyalatyr
202530
thrmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
serlysileserthrserglyglyglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproleuasntrptrpalapheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
180
117
prt
人工序列
描述人工序列:合成的
多肽
180
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheasnalatyr
202530
prometthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serargileaspglytyrglyarghisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyileileproasnpheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
181
119
prt
人工序列
描述人工序列:合成的
多肽
181
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyalaval
202530
aspmetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserproserglyseralathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargvalproaspleuglypheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
182
117
prt
人工序列
描述人工序列:合成的
多肽
182
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspsertyr
202530
alametglytrpalaargglnalaproglylysglyleuglutrpval
354045
seralaileglyalalysglyleuserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalaalaargglylyspheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
183
116
prt
人工序列
描述人工序列:合成的
多肽
183
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrargtyr
202530
glnmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
servalileasnvaltrpglyserserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysmetserglylysphealatyrtrpglyglnglythrleuval
100105110
thrvalserser
115
184
117
prt
人工序列
描述人工序列:合成的
多肽
184
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyasntyr
202530
sermetmettrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileileproalaglythrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproserileargleupheasptyrtrpglyglnglythrleu
100105110
valthrvalserser
115
185
116
prt
人工序列
描述人工序列:合成的
多肽
185
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyalatyr
202530
aspmetglytrpvalargglnalaproglylysglyleuglutrpval
354045
sertrpileserproasnglytyraspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyglyvallyspheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
186
123
prt
人工序列
描述人工序列:合成的
多肽
186
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphevaltrptyr
202530
glumetalatrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileglnalaaspglygluglnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalasertyralaleuvaltyrproprogluglupheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
187
122
prt
人工序列
描述人工序列:合成的
多肽
187
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrasntyr
202530
argmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileaspaspleuglyvalserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystrpargleulysasnserglnprothrasppheasptyrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
188
119
prt
人工序列
描述人工序列:合成的
多肽
188
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspglnala
202530
hismettrptrpvalargglnalaproglylysglyleuglutrpval
354045
serpheileasnproserglytyrtyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproserleuserproserserpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
189
118
prt
人工序列
描述人工序列:合成的
多肽
189
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluthrgly
202530
glnmetglytrpalaargglnalaproglylysglyleuglutrpval
354045
serasnileaspglyserglythrtyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysserthrglnasntyrargpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
190
119
prt
人工序列
描述人工序列:合成的
多肽
190
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyalatyr
202530
promettyrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserilehislysaspglyargilethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglnglythrprovalaspglypheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
191
121
prt
人工序列
描述人工序列:合成的
多肽
191
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproaspglu
202530
glymetthrtrpvalargglnalaproglylysglyleuglutrpval
354045
serthrilegluthrglyglythrvalthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysmetaspglyserglythrtrpglnthrpheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
192
116
prt
人工序列
描述人工序列:合成的
多肽
192
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspserleu
202530
glymetglytrpalaargglnalaproglylysglyleuglutrpval
354045
sertyrileargalagluglyalatyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrleualaaspserasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
193
120
prt
人工序列
描述人工序列:合成的
多肽
193
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesergluser
202530
tyrmetglutrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileasphisileglyglyglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspaspglyargglyglysermetpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
194
116
prt
人工序列
描述人工序列:合成的
多肽
194
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserglygly
202530
tyrmettrptrpvalargglnalaproglylysglyleuglutrpval
354045
serserileglyalaserglyalatyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysthrglyglyargleuasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
195
119
prt
人工序列
描述人工序列:合成的
多肽
195
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspglugly
202530
hismetglytrpvalargglnalaproglylysaspleuglutrpval
354045
sertyrileglyserleuglyleuhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargglupheserasnglyglypheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
196
121
prt
人工序列
描述人工序列:合成的
多肽
196
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphelysthrser
202530
promettyrtrpvalargglnalaproglylysglyleuglutrpval
354045
serserileaspargthrglyglyhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglnalaleuleuthraspalalysargpheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
197
120
prt
人工序列
描述人工序列:合成的
多肽
197
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspglyarg
202530
aspmetvaltrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserproserglyleuaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alagluargproglnmetleuvalthrasnpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
198
119
prt
人工序列
描述人工序列:合成的
多肽
198
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyasnasp
202530
prometsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileglyarggluglyaspserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspsermetarghisglnpropheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
199
119
prt
人工序列
描述人工序列:合成的
多肽
199
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspgluthr
202530
tyrmetlystrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileglyalaserglyalaaspthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysphethrhisleuasnglyargpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
200
119
prt
人工序列
描述人工序列:合成的
多肽
200
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglytrp
202530
prometglytrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileaspileaspglyalaprothrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluglualaglysertrpserpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
201
116
prt
人工序列
描述人工序列:合成的
多肽
201
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheseraspgln
202530
alamettrptrpalaargglnalaproglylysglyleuglutrpval
354045
serpheileglnglyaspglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysproserlyspropheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
202
118
prt
人工序列
描述人工序列:合成的
多肽
202
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluthrgly
202530
glnmetglytrpalaargglnalaproglylysglyleuglutrpval
354045
serasnileaspglyserglythrtyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysalavalargasnphealapheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
203
124
prt
人工序列
描述人工序列:合成的
多肽
203
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserglyhis
202530
aspmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserprohisglythrhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyileargglytrpileglyhisaspthrglnpropheasp
100105110
tyrtrpglyglnglythrleuvalthrvalserser
115120
204
119
prt
人工序列
描述人工序列:合成的
多肽
204
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluserlys
202530
aspmetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserseraspglythrhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaglngluleuglyglysertrpglnpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
205
122
prt
人工序列
描述人工序列:合成的
多肽
205
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaasparg
202530
aspmetvaltrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileglyalaserglythrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alalysglyglythrglyprothraspleutrpasppheasptyrtrp
100105110
glyglnglythrleuvalthrvalserser
115120
206
119
prt
人工序列
描述人工序列:合成的
多肽
206
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheaspaspglu
202530
lysmetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileservalserglyleuhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluglualaglysertrpserpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
207
119
prt
人工序列
描述人工序列:合成的
多肽
207
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglyglnglu
202530
argmetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seraspileseralaserglyglythrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluglualaglysertrpserpheasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
208
116
prt
人工序列
描述人工序列:合成的
多肽
208
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnsermetasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrargglyargglythrleuval
100105110
thrvalserser
115
209
116
prt
人工序列
描述人工序列:合成的
多肽
209
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
210
116
prt
人工序列
描述人工序列:合成的
多肽
210
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrargvalglnglythrleuval
100105110
thrvalserser
115
211
116
prt
人工序列
描述人工序列:合成的
多肽
211
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalarglysalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
212
116
prt
人工序列
描述人工序列:合成的
多肽
212
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargglnalaproglylysglyleuglutrpile
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrargvalglnglythrleuval
100105110
thrvalserser
115
213
116
prt
人工序列
描述人工序列:合成的
多肽
213
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnsergluasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
214
116
prt
人工序列
描述人工序列:合成的
多肽
214
gluvalglnleuleugluthrglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetaspserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalthrser
115
215
116
prt
人工序列
描述人工序列:合成的
多肽
215
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrphehistyrtrpglyargglythrleuval
100105110
thrvalserser
115
216
116
prt
人工序列
描述人工序列:合成的
多肽
216
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysvalalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargglnalaproglyasnglyleuglutrpile
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
217
116
prt
人工序列
描述人工序列:合成的
多肽
217
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuleumetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
218
116
prt
人工序列
描述人工序列:合成的
多肽
218
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalarglysalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrargglyargglythrleuval
100105110
thrvalserser
115
219
116
prt
人工序列
描述人工序列:合成的
多肽
219
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
sermetargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrargglyargglythrleuval
100105110
thrvalserser
115
220
116
prt
人工序列
描述人工序列:合成的
多肽
220
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
sermetileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
221
116
prt
人工序列
描述人工序列:合成的
多肽
221
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytrpargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglytyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
222
116
prt
人工序列
描述人工序列:合成的
多肽
222
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglytrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuleutyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
223
116
prt
人工序列
描述人工序列:合成的
多肽
223
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglyphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
224
116
prt
人工序列
描述人工序列:合成的
多肽
224
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglutyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
225
116
prt
人工序列
描述人工序列:合成的
多肽
225
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyleuglutyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
226
116
prt
人工序列
描述人工序列:合成的
多肽
226
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleualaphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
227
116
prt
人工序列
描述人工序列:合成的
多肽
227
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuleutyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
228
116
prt
人工序列
描述人工序列:合成的
多肽
228
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleugluphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
229
116
prt
人工序列
描述人工序列:合成的
多肽
229
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglnphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
230
116
prt
人工序列
描述人工序列:合成的
多肽
230
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuleuphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
231
116
prt
人工序列
描述人工序列:合成的
多肽
231
gluvalglnleuleugluserglyglyglyleuvalargproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleugluphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
232
116
prt
人工序列
描述人工序列:合成的
多肽
232
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuleuphepheasptyrargglyargglythrleuval
100105110
thrvalserser
115
233
116
prt
人工序列
描述人工序列:合成的
多肽
233
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheilepheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysasnleuglutyrpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
234
116
prt
人工序列
描述人工序列:合成的
多肽
234
gluvalargleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluleuglnphepheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
235
116
prt
人工序列
描述人工序列:合成的
多肽
235
gluvalglnleuleuglyserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
serlysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
236
116
prt
人工序列
描述人工序列:合成的
多肽
236
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
237
116
prt
人工序列
描述人工序列:合成的
多肽
237
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpile
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
238
116
prt
人工序列
描述人工序列:合成的
多肽
238
gluvalglnleuleuaspproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglylysglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserargasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
239
116
prt
人工序列
描述人工序列:合成的
多肽
239
gluvalglnleuleuglyserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
240
116
prt
人工序列
描述人工序列:合成的
多肽
240
gluvalglnleuleugluproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuleumetasnserleuargalagluaspthralavaltyrtyrcys
859095
serlysglupropheargpheasptyrtrpglyglnglyalaleuval
100105110
thrvalserser
115
241
116
prt
人工序列
描述人工序列:合成的
多肽
241
gluvalglnleuleuaspproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglylysglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
242
116
prt
人工序列
描述人工序列:合成的
多肽
242
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpile
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrilehisargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
serlysglupropheargpheasptyrargglyleuglythrleuval
100105110
thrvalserser
115
243
116
prt
人工序列
描述人工序列:合成的
多肽
243
gluvalglnleuleuaspproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglylysglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserargasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
244
116
prt
人工序列
描述人工序列:合成的
多肽
244
gluvalglnleuleuaspserglyglyglyphevalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpile
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
245
116
prt
人工序列
描述人工序列:合成的
多肽
245
gluvalglnleuleuaspproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpile
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserasnasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glyargglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
246
116
prt
人工序列
描述人工序列:合成的
多肽
246
gluvalargleuleugluserglygluglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
247
116
prt
人工序列
描述人工序列:合成的
多肽
247
gluvalglnglnleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
248
116
prt
人工序列
描述人工序列:合成的
多肽
248
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysgluprophetyrtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
249
116
prt
人工序列
描述人工序列:合成的
多肽
249
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysgluprophetyrpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
250
116
prt
人工序列
描述人工序列:合成的
多肽
250
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphegluglulys
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysgluprophephetyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
251
116
prt
人工序列
描述人工序列:合成的
多肽
251
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproglnglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
252
116
prt
人工序列
描述人工序列:合成的
多肽
252
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphephealaala
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
253
116
prt
人工序列
描述人工序列:合成的
多肽
253
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargproglythrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
254
116
prt
人工序列
描述人工序列:合成的
多肽
254
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargmetglypheserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
255
116
prt
人工序列
描述人工序列:合成的
多肽
255
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargtrpglyhisserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
256
116
prt
人工序列
描述人工序列:合成的
多肽
256
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargleuglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
257
116
prt
人工序列
描述人工序列:合成的
多肽
257
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargtrpglyalaserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
258
116
prt
人工序列
描述人工序列:合成的
多肽
258
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargglnglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
259
116
prt
人工序列
描述人工序列:合成的
多肽
259
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileservalserglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
260
116
prt
人工序列
描述人工序列:合成的
多肽
260
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargtrpglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
261
116
prt
人工序列
描述人工序列:合成的
多肽
261
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglyleuserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
262
116
prt
人工序列
描述人工序列:合成的
多肽
262
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyleuglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
263
116
prt
人工序列
描述人工序列:合成的
多肽
263
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileseralaleuglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
264
116
prt
人工序列
描述人工序列:合成的
多肽
264
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargargglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
265
116
prt
人工序列
描述人工序列:合成的
多肽
265
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserarghisglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
266
116
prt
人工序列
描述人工序列:合成的
多肽
266
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserargserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
267
116
prt
人工序列
描述人工序列:合成的
多肽
267
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargileglyasnserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
268
116
prt
人工序列
描述人工序列:合成的
多肽
268
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyhisglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
269
116
prt
人工序列
描述人工序列:合成的
多肽
269
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargtrpglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
270
116
prt
人工序列
描述人工序列:合成的
多肽
270
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysgluprophemettyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
271
116
prt
人工序列
描述人工序列:合成的
多肽
271
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheprotyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
272
116
prt
人工序列
描述人工序列:合成的
多肽
272
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyglythrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
273
116
prt
人工序列
描述人工序列:合成的
多肽
273
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysgluproleutyrtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
274
116
prt
人工序列
描述人工序列:合成的
多肽
274
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupromettyrtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
275
116
prt
人工序列
描述人工序列:合成的
多肽
275
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglypheserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
276
116
prt
人工序列
描述人工序列:合成的
多肽
276
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargthrglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
277
116
prt
人工序列
描述人工序列:合成的
多肽
277
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserarggluglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
278
116
prt
人工序列
描述人工序列:合成的
多肽
278
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphepropheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargglnglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
279
116
prt
人工序列
描述人工序列:合成的
多肽
279
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargglyglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
280
116
prt
人工序列
描述人工序列:合成的
多肽
280
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargthrglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
281
116
prt
人工序列
描述人工序列:合成的
多肽
281
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglyargserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
282
116
prt
人工序列
描述人工序列:合成的
多肽
282
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
283
116
prt
人工序列
描述人工序列:合成的
多肽
283
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserarglysglyserserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
284
116
prt
人工序列
描述人工序列:合成的
多肽
284
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargglyglytrpserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
285
116
prt
人工序列
描述人工序列:合成的
多肽
285
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargserglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
286
116
prt
人工序列
描述人工序列:合成的
多肽
286
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglymetserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
287
116
prt
人工序列
描述人工序列:合成的
多肽
287
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
288
116
prt
人工序列
描述人工序列:合成的
多肽
288
gluvalglnleuleugluserglygluglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrgluhis
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargprogluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
289
116
prt
人工序列
描述人工序列:合成的
多肽
289
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphethrglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpile
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrphecys
859095
alalysgluproleuargpheasptyrargglyglnglythrleuval
100105110
thrvalserser
115
290
116
prt
人工序列
描述人工序列:合成的
多肽
290
gluvalglnleuleugluproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalarglysalaproglylysglymetglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnmetleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheglytyrtrpglyglnglythrleuval
100105110
thrvalserser
115
291
116
prt
人工序列
描述人工序列:合成的
多肽
291
gluvalglnleuleuaspserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
292
116
prt
人工序列
描述人工序列:合成的
多肽
292
gluvalglnleuleuglyserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalargglnalaproglylysserleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargtyraspasptrpglyglnglythrleuval
100105110
thrvalserser
115
293
116
prt
人工序列
描述人工序列:合成的
多肽
293
gluvalglnproleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysseralaserglyphethrpheasnglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
294
116
prt
人工序列
描述人工序列:合成的
多肽
294
gluvalglnleuleugluserglygluglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
295
116
prt
人工序列
描述人工序列:合成的
多肽
295
gluvalglnleuleuaspproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrgluser
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
296
116
prt
人工序列
描述人工序列:合成的
多肽
296
gluvalglnleuleugluproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalarglysalaproglylysglymetglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargprogluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
297
116
prt
人工序列
描述人工序列:合成的
多肽
297
gluvalglnleuleugluserglyvalglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalarglysalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheaspasntrpglyglnglythrleuval
100105110
thrvalserser
115
298
116
prt
人工序列
描述人工序列:合成的
多肽
298
gluvalglnleuleugluserargglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrgluhis
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargpheservalserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
299
116
prt
人工序列
描述人工序列:合成的
多肽
299
gluvalglnproleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
300
116
prt
人工序列
描述人工序列:合成的
多肽
300
gluvalglnleuleugluseralaglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheasptyrtrpglyglnglyalaleuval
100105110
thrvalserser
115
301
116
prt
人工序列
描述人工序列:合成的
多肽
301
gluvalglnleuleugluproglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphethrglutyr
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serserileserglyasnglyalaasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproleuargpheaspasntrpglyglnglythrleuval
100105110
thrvalserser
115
302
123
prt
人工序列
描述人工序列:合成的
多肽
302
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspleuargtyralaargpheasptyr
100105110
serglyglnglythrleuvalthrvalserser
115120
303
123
prt
人工序列
描述人工序列:合成的
多肽
303
glugluglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyralathrargtyralaargpheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
304
123
prt
人工序列
描述人工序列:合成的
多肽
304
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnphelysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
glyglyglnglythrleuvalthrvalserser
115120
305
123
prt
人工序列
描述人工序列:合成的
多肽
305
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheaspasn
100105110
trpglyglnglythrleuvalthrvalserasn
115120
306
123
prt
人工序列
描述人工序列:合成的
多肽
306
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnthrtyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileglyargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspleuargtyralaargpheasptyr
100105110
serglyglnglythrleuvalthrvalserser
115120
307
123
prt
人工序列
描述人工序列:合成的
多肽
307
gluvalglnleumetgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglypheserpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglytyrthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
trpglyargglythrleuvalthrvalserser
115120
308
123
prt
人工序列
描述人工序列:合成的
多肽
308
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphealapheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserarghisglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrvalserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargserasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
309
123
prt
人工序列
描述人工序列:合成的
多肽
309
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrphecys
859095
alalysgluproilethrtyraspmetargtyralaargserasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
310
123
prt
人工序列
描述人工序列:合成的
多肽
310
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyrsermetargtyralaargpheasptyr
100105110
serglyleuglythrmetvalthrvalserser
115120
311
123
prt
人工序列
描述人工序列:合成的
多肽
311
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
serglyglnglythrleuvalthrvalserser
115120
312
123
prt
人工序列
描述人工序列:合成的
多肽
312
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalarglysalaproglylysglyleuglutrpval
354045
serglyileserarghisglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
313
123
prt
人工序列
描述人工序列:合成的
多肽
313
gluvalglnleuphegluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
trpglyargglythrleuvalthrvalserser
115120
314
123
prt
人工序列
描述人工序列:合成的
多肽
314
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
trpglyargglythrleuvalthrvalserser
115120
315
123
prt
人工序列
描述人工序列:合成的
多肽
315
gluvalglnleuleugluserglyglyglyservalglnproglygly
151015
serleuargleusercysthralaserglypheserpheasnmettyr
202530
glumetsertrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
trpglyglnglythrleuvalthrvalsergly
115120
316
123
prt
人工序列
描述人工序列:合成的
多肽
316
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysthralaserglyphethrpheasnmettyr
202530
glumetsertrpvalarglysalaproglylysglyleuglutrpval
354045
serglyileserargargglyphethrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluproilethrtyraspmetargtyralaargpheasptyr
100105110
trpglyglnglythrleuvalthrvalserser
115120
317
116
prt
人工序列
描述人工序列:合成的
多肽
317
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
318
116
prt
人工序列
描述人工序列:合成的
多肽
318
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
319
116
prt
人工序列
描述人工序列:合成的
多肽
319
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
thrlysleupropheilepheglutyrtrpglyglnglythrleuval
100105110
thrvalserser
115
320
116
prt
人工序列
描述人工序列:合成的
多肽
320
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
321
116
prt
人工序列
描述人工序列:合成的
多肽
321
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
322
116
prt
人工序列
描述人工序列:合成的
多肽
322
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserpheargasptyr
202530
glumettrptrptyrargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleupropheilepheaspasnargglyglnglythrleuval
100105110
thrvalserser
115
323
116
prt
人工序列
描述人工序列:合成的
多肽
323
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthrservaltyrhiscys
859095
alalyspropropheilepheglyasptrpglyproglythrleuval
100105110
thrvalserser
115
324
116
prt
人工序列
描述人工序列:合成的
多肽
324
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serargargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
325
116
prt
人工序列
描述人工序列:合成的
多肽
325
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
326
116
prt
人工序列
描述人工序列:合成的
多肽
326
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysvalleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnmetleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
327
116
prt
人工序列
描述人工序列:合成的
多肽
327
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
328
116
prt
人工序列
描述人工序列:合成的
多肽
328
gluvalglnleuleugluserglyglyglyleuileglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
leulysleupropheilepheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
329
116
prt
人工序列
描述人工序列:合成的
多肽
329
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalaaspaspthralavaltyrhiscys
859095
thrlysleupropheilepheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
330
116
prt
人工序列
描述人工序列:合成的
多肽
330
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglymetvalleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephepheaspserargglyglnglythrleuval
100105110
thrvalserser
115
331
116
prt
人工序列
描述人工序列:合成的
多肽
331
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargargalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
332
116
prt
人工序列
描述人工序列:合成的
多肽
332
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
333
116
prt
人工序列
描述人工序列:合成的
多肽
333
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserpheargasptyr
202530
glumettrptrptyrargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
334
116
prt
人工序列
描述人工序列:合成的
多肽
334
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysvalleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnmetleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
335
116
prt
人工序列
描述人工序列:合成的
多肽
335
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
336
116
prt
人工序列
描述人工序列:合成的
多肽
336
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
thrlysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
337
116
prt
人工序列
描述人工序列:合成的
多肽
337
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
leulysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
338
116
prt
人工序列
描述人工序列:合成的
多肽
338
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalaaspaspthralavaltyrhiscys
859095
thrlysleupropheilepheglutyrtrpglyglnglythrleuval
100105110
thrvalserser
115
339
116
prt
人工序列
描述人工序列:合成的
多肽
339
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheaspsertrpglyglnglythrleuval
100105110
thrvalserser
115
340
116
prt
人工序列
描述人工序列:合成的
多肽
340
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysgluprotyrsertyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
341
116
prt
人工序列
描述人工序列:合成的
多肽
341
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargargalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
342
116
prt
人工序列
描述人工序列:合成的
多肽
342
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargargalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
343
116
prt
人工序列
描述人工序列:合成的
多肽
343
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
344
116
prt
人工序列
描述人工序列:合成的
多肽
344
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
gluleutrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
345
116
prt
人工序列
描述人工序列:合成的
多肽
345
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
gluleutrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
346
116
prt
人工序列
描述人工序列:合成的
多肽
346
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrppheargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
347
116
prt
人工序列
描述人工序列:合成的
多肽
347
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrppheargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
348
116
prt
人工序列
描述人工序列:合成的
多肽
348
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
349
116
prt
人工序列
描述人工序列:合成的
多肽
349
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
metglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
350
116
prt
人工序列
描述人工序列:合成的
多肽
350
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprothrtyrpheseraspargglyglnglythrleuval
100105110
thrvalserser
115
351
116
prt
人工序列
描述人工序列:合成的
多肽
351
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephephegluglutrpglyglnglythrleuval
100105110
thrvalserser
115
352
116
prt
人工序列
描述人工序列:合成的
多肽
352
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprothrtyrphelysasptrpglyglnglythrleuval
100105110
thrvalserser
115
353
116
prt
人工序列
描述人工序列:合成的
多肽
353
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheserglutrpglyglnglythrleuval
100105110
thrvalserser
115
354
116
prt
人工序列
描述人工序列:合成的
多肽
354
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprometphephegluasptrpglyglnglythrleuval
100105110
thrvalserasn
115
355
116
prt
人工序列
描述人工序列:合成的
多肽
355
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophepropheserglutrpglyglnglythrleuval
100105110
thrvalserser
115
356
116
prt
人工序列
描述人工序列:合成的
多肽
356
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetaspserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheserglutrpglyglnglythrleuval
100105110
thrvalserser
115
357
116
prt
人工序列
描述人工序列:合成的
多肽
357
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyasnleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
358
116
prt
人工序列
描述人工序列:合成的
多肽
358
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproproglythrleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluaspargglyglnglythrleuval
100105110
thrvalserser
115
359
116
prt
人工序列
描述人工序列:合成的
多肽
359
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
360
116
prt
人工序列
描述人工序列:合成的
多肽
360
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprometglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
361
116
prt
人工序列
描述人工序列:合成的
多肽
361
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
362
116
prt
人工序列
描述人工序列:合成的
多肽
362
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproserglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspaspargglyglnglythrleuval
100105110
thrvalserser
115
363
116
prt
人工序列
描述人工序列:合成的
多肽
363
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprohisglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
364
116
prt
人工序列
描述人工序列:合成的
多肽
364
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproalaglyargleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
365
116
prt
人工序列
描述人工序列:合成的
多肽
365
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
366
116
prt
人工序列
描述人工序列:合成的
多肽
366
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheproasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
367
116
prt
人工序列
描述人工序列:合成的
多肽
367
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaaspserglyphethrpheproproval
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
368
116
prt
人工序列
描述人工序列:合成的
多肽
368
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
369
116
prt
人工序列
描述人工序列:合成的
多肽
369
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyasnhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
370
116
prt
人工序列
描述人工序列:合成的
多肽
370
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprohisglyglytyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
371
116
prt
人工序列
描述人工序列:合成的
多肽
371
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglyargglyleugluargval
354045
seralaileasnproproglymetleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
372
116
prt
人工序列
描述人工序列:合成的
多肽
372
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglnleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
373
116
prt
人工序列
描述人工序列:合成的
多肽
373
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglytyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
374
116
prt
人工序列
描述人工序列:合成的
多肽
374
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproserglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
375
116
prt
人工序列
描述人工序列:合成的
多肽
375
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproserglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
376
116
prt
人工序列
描述人工序列:合成的
多肽
376
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproserglythrleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
377
116
prt
人工序列
描述人工序列:合成的
多肽
377
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
378
116
prt
人工序列
描述人工序列:合成的
多肽
378
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglytyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
379
116
prt
人工序列
描述人工序列:合成的
多肽
379
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
380
116
prt
人工序列
描述人工序列:合成的
多肽
380
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserhisthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
381
116
prt
人工序列
描述人工序列:合成的
多肽
381
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglythrleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserargasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
382
116
prt
人工序列
描述人工序列:合成的
多肽
382
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproasnglyargleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphealaasptrpglyglnglythrleuval
100105110
thrvalserser
115
383
116
prt
人工序列
描述人工序列:合成的
多肽
383
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglnleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
384
116
prt
人工序列
描述人工序列:合成的
多肽
384
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprohisglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
385
116
prt
人工序列
描述人工序列:合成的
多肽
385
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproalaglymetleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
386
116
prt
人工序列
描述人工序列:合成的
多肽
386
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprohisglythrleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
387
116
prt
人工序列
描述人工序列:合成的
多肽
387
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
388
116
prt
人工序列
描述人工序列:合成的
多肽
388
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
389
116
prt
人工序列
描述人工序列:合成的
多肽
389
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproalaglypheleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
390
116
prt
人工序列
描述人工序列:合成的
多肽
390
gluvalglnleuleugluserglyglyglyleuvalargproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
391
116
prt
人工序列
描述人工序列:合成的
多肽
391
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
392
116
prt
人工序列
描述人工序列:合成的
多肽
392
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
393
116
prt
人工序列
描述人工序列:合成的
多肽
393
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetaspserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
394
116
prt
人工序列
描述人工序列:合成的
多肽
394
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglythrleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
395
116
prt
人工序列
描述人工序列:合成的
多肽
395
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglytyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyargglythrleuval
100105110
thrvalserser
115
396
116
prt
人工序列
描述人工序列:合成的
多肽
396
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotyrglyasnleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
397
116
prt
人工序列
描述人工序列:合成的
多肽
397
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprohisglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
398
116
prt
人工序列
描述人工序列:合成的
多肽
398
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproalaglyphetyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
399
116
prt
人工序列
描述人工序列:合成的
多肽
399
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproalaglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrpheaspasptrpglyglnglythrleuval
100105110
thrvalserser
115
400
116
prt
人工序列
描述人工序列:合成的
多肽
400
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphealapheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprohisglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
401
116
prt
人工序列
描述人工序列:合成的
多肽
401
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproalaglyglytyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprophethrphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
402
116
prt
人工序列
描述人工序列:合成的
多肽
402
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetrpphethrglutrpglyglnglythrleuval
100105110
thrvalserser
115
403
116
prt
人工序列
描述人工序列:合成的
多肽
403
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophemetpheseraspargglyglnglythrleuval
100105110
thrvalserser
115
404
116
prt
人工序列
描述人工序列:合成的
多肽
404
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleupropheleupheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
405
116
prt
人工序列
描述人工序列:合成的
多肽
405
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprothrargphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
406
116
prt
人工序列
描述人工序列:合成的
多肽
406
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
407
116
prt
人工序列
描述人工序列:合成的
多肽
407
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
408
116
prt
人工序列
描述人工序列:合成的
多肽
408
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprothrphephelysasptrpglyglnglythrleuval
100105110
thrvalserser
115
409
116
prt
人工序列
描述人工序列:合成的
多肽
409
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephepheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
410
116
prt
人工序列
描述人工序列:合成的
多肽
410
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuproglnleuphehisaspargglyglnglythrleuval
100105110
thrvalserser
115
411
116
prt
人工序列
描述人工序列:合成的
多肽
411
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuproglnleuphegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
412
116
prt
人工序列
描述人工序列:合成的
多肽
412
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleupropheglypheserglutrpglyglnglythrleuval
100105110
thrvalserser
115
413
116
prt
人工序列
描述人工序列:合成的
多肽
413
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuproglnleupheglnasptrpglyglnglythrleuval
100105110
thrvalserser
115
414
116
prt
人工序列
描述人工序列:合成的
多肽
414
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephephehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
415
116
prt
人工序列
描述人工序列:合成的
多肽
415
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprohistyrphelysasptrpglyglnglythrleuval
100105110
thrvalserser
115
416
116
prt
人工序列
描述人工序列:合成的
多肽
416
gluvalglnleuleugluserglyglyglyleuvalglnserglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphegluglutrpglyglnglythrleuval
100105110
thrvalserser
115
417
116
prt
人工序列
描述人工序列:合成的
多肽
417
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleupropheargpheseraspargglyglnglythrleuval
100105110
thrvalserser
115
418
116
prt
人工序列
描述人工序列:合成的
多肽
418
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprothrleupheglnasptrpglyglnglythrleuval
100105110
thrvalserser
115
419
116
prt
人工序列
描述人工序列:合成的
多肽
419
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheserglutrpglyglnglythrleuval
100105110
thrvalserasn
115
420
116
prt
人工序列
描述人工序列:合成的
多肽
420
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetrppheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
421
116
prt
人工序列
描述人工序列:合成的
多肽
421
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
422
116
prt
人工序列
描述人工序列:合成的
多肽
422
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprometphephegluasptrpglyglnglythrleuval
100105110
thrvalserasn
115
423
116
prt
人工序列
描述人工序列:合成的
多肽
423
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
424
116
prt
人工序列
描述人工序列:合成的
多肽
424
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephepheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
425
116
prt
人工序列
描述人工序列:合成的
多肽
425
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyserleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephephehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
426
116
prt
人工序列
描述人工序列:合成的
多肽
426
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
427
116
prt
人工序列
描述人工序列:合成的
多肽
427
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprometphephegluasptrpglyglnglythrleuval
100105110
thrvalserasn
115
428
116
prt
人工序列
描述人工序列:合成的
多肽
428
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
429
116
prt
人工序列
描述人工序列:合成的
多肽
429
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephepheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
430
116
prt
人工序列
描述人工序列:合成的
多肽
430
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyphethrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephephehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
431
116
prt
人工序列
描述人工序列:合成的
多肽
431
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
432
116
prt
人工序列
描述人工序列:合成的
多肽
432
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprometphephegluasptrpglyglnglythrleuval
100105110
thrvalserasn
115
433
116
prt
人工序列
描述人工序列:合成的
多肽
433
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
434
116
prt
人工序列
描述人工序列:合成的
多肽
434
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephepheglnglutrpglyglnglythrleuval
100105110
thrvalserser
115
435
116
prt
人工序列
描述人工序列:合成的
多肽
435
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnprotrpglyglyleuthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophephephehisglutrpglyglnglythrleuval
100105110
thrvalserser
115
436
116
prt
人工序列
描述人工序列:合成的
多肽
436
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysleuprometphephegluasptrpglyglnglythrleuval
100105110
thrvalserser
115
437
119
prt
人工序列
描述人工序列:合成的
多肽
437
gluvalglnleuleugluthrglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrtyr
202530
hismetglntrpvalargargalaproglylysglyleuglutrpval
354045
sermetileaspalaaspglyleuglythrtyrtyralaaspproval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalalysaspthralavaltyrtyrcys
859095
alaargproglyproglnpheglyglnpheasptyrleuglyglngly
100105110
thrleuvalthrvalserser
115
438
119
prt
人工序列
描述人工序列:合成的
多肽
438
gluvalglnleuphegluserglyglyglyleuvalglnthrglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrtyr
202530
hismetglntrpvalargglnalaproglylysglyleuglutrpval
354045
sermetileaspalaaspglyleuglylystyrtyralaaspproval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
vallysproglyproglnpheglyglntyrasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
439
121
prt
人工序列
描述人工序列:合成的
多肽
439
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysseralaserglyphethrpheserglytyr
202530
aspmetglntrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileseralaserglyvaltyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalystyrproasnargphealaleuasnserpheasptyrarggly
100105110
argglythrleuvalthrvalserser
115120
440
121
prt
人工序列
描述人工序列:合成的
多肽
440
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserglytyr
202530
aspmetglntrpvalargglnalaproglyargglyleuglutrpval
354045
serthrileseralaserglyvaltyrthrtyrtyrthraspserval
505560
lysglyargphethrthrserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
thrlystyrproasnargphealaargasnasnpheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
441
108
prt
人工序列
描述人工序列:合成的
多肽
441
aspileleumetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglyglualaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheserglnglythrlysvalgluilelysarg
100105
442
108
prt
人工序列
描述人工序列:合成的
多肽
442
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaaspserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
443
108
prt
人工序列
描述人工序列:合成的
多肽
443
aspileglnmetthrvalserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaaspserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
444
108
prt
人工序列
描述人工序列:合成的
多肽
444
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheaspglnglythrlysvalgluilelysarg
100105
445
108
prt
人工序列
描述人工序列:合成的
多肽
445
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserthrglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
446
108
prt
人工序列
描述人工序列:合成的
多肽
446
aspileglnmetthrvalserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
447
108
prt
人工序列
描述人工序列:合成的
多肽
447
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaaspserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheaspglnglythrlysvalgluilelysarg
100105
448
108
prt
人工序列
描述人工序列:合成的
多肽
448
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprogluleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
449
108
prt
人工序列
描述人工序列:合成的
多肽
449
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluasnlysarg
100105
450
108
prt
人工序列
描述人工序列:合成的
多肽
450
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
451
108
prt
人工序列
描述人工序列:合成的
多肽
451
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyileproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
452
108
prt
人工序列
描述人工序列:合成的
多肽
452
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
453
108
prt
人工序列
描述人工序列:合成的
多肽
453
aspileleuleuthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
454
108
prt
人工序列
描述人工序列:合成的
多肽
454
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
serglythrglythraspphethrleuthrileserglyleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheaspglnglythrlysvalgluilelysarg
100105
455
108
prt
人工序列
描述人工序列:合成的
多肽
455
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrileprocysargalaasnserserileleutrpala
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
gluserserserglyleuglnserglyvalproserargphesergly
505560
seralaserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysvalglnasnalavaltrpprogly
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
456
108
prt
人工序列
描述人工序列:合成的
多肽
456
aspileglnmetalaglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyralaserproproleu
859095
thrleuglyglnglythrlysvalgluilelysarg
100105
457
108
prt
人工序列
描述人工序列:合成的
多肽
457
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspservalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglyglualaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyralaserproproleu
859095
thrpheglyglnglythrasnvalgluilelysarg
100105
458
108
prt
人工序列
描述人工序列:合成的
多肽
458
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealaalatyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
459
108
prt
人工序列
描述人工序列:合成的
多肽
459
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
460
108
prt
人工序列
描述人工序列:合成的
多肽
460
aspileglnmetthrglnserproserserleuseralaservalgly
151015
gluargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspseralathrtyrtyrcyshisglntyralaserproproleu
859095
thrleuglyglnglythrlysvalgluilelysarg
100105
461
108
prt
人工序列
描述人工序列:合成的
多肽
461
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyralaserproproleu
859095
thrleuglyglnglythrlysvalgluilelysarg
100105
462
108
prt
人工序列
描述人工序列:合成的
多肽
462
aspileglnilethrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysaspprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
463
108
prt
人工序列
描述人工序列:合成的
多肽
463
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglyglualaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelystrp
100105
464
108
prt
人工序列
描述人工序列:合成的
多肽
464
aspileglnleuthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
465
108
prt
人工序列
描述人工序列:合成的
多肽
465
aspileglnmetserglnserproserthrleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
metpheglyglnglythrlysvalgluilelysarg
100105
466
108
prt
人工序列
描述人工序列:合成的
多肽
466
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysaspprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
467
108
prt
人工序列
描述人工序列:合成的
多肽
467
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
468
108
prt
人工序列
描述人工序列:合成的
多肽
468
aspileglnmetthrglnserproserserleuphealaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
469
108
prt
人工序列
描述人工序列:合成的
多肽
469
aspileglnmetthrglntyrproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnserilegluargarg
202530
leuasntrptyrglnglnlysproglyglualaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
470
108
prt
人工序列
描述人工序列:合成的
多肽
470
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisprotyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
471
108
prt
人工序列
描述人工序列:合成的
多肽
471
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnalailegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyralaserproproleu
859095
thrleuglyglnglythrlysvalgluilelysarg
100105
472
108
prt
人工序列
描述人工序列:合成的
多肽
472
asnileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnalailegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
473
108
prt
人工序列
描述人工序列:合成的
多肽
473
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglyseraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
474
108
prt
人工序列
描述人工序列:合成的
多肽
474
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
475
108
prt
人工序列
描述人工序列:合成的
多肽
475
aspileglnmetthrglnthrproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglyglualaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvallysilelysarg
100105
476
108
prt
人工序列
描述人工序列:合成的
多肽
476
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspservalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
477
108
prt
人工序列
描述人工序列:合成的
多肽
477
hisileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
478
108
prt
人工序列
描述人工序列:合成的
多肽
478
aspvalglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglyglualaprolysleuleuile
354045
tyrleuthrserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyralaserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
479
108
prt
人工序列
描述人工序列:合成的
多肽
479
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalvalilelysarg
100105
480
108
prt
人工序列
描述人工序列:合成的
多肽
480
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
481
108
prt
人工序列
描述人工序列:合成的
多肽
481
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnproilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
482
108
prt
人工序列
描述人工序列:合成的
多肽
482
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
483
108
prt
人工序列
描述人工序列:合成的
多肽
483
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnserilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluileilearg
100105
484
108
prt
人工序列
描述人工序列:合成的
多肽
484
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
485
108
prt
人工序列
描述人工序列:合成的
多肽
485
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnserilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrleualaserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
486
108
prt
人工序列
描述人工序列:合成的
多肽
486
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglnphegluhisproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
487
108
prt
人工序列
描述人工序列:合成的
多肽
487
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserpheproileaspargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
488
108
prt
人工序列
描述人工序列:合成的
多肽
488
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserserthrileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
489
108
prt
人工序列
描述人工序列:合成的
多肽
489
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserserglnileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
490
108
prt
人工序列
描述人工序列:合成的
多肽
490
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalasergluargileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
491
108
prt
人工序列
描述人工序列:合成的
多肽
491
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnglnileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
492
108
prt
人工序列
描述人工序列:合成的
多肽
492
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnproilealaargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
493
108
prt
人工序列
描述人工序列:合成的
多肽
493
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglyasnileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
494
108
prt
人工序列
描述人工序列:合成的
多肽
494
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargasnileaspargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
495
108
prt
人工序列
描述人工序列:合成的
多肽
495
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnserileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
496
108
prt
人工序列
描述人工序列:合成的
多肽
496
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnasnileglythrarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
497
108
prt
人工序列
描述人工序列:合成的
多肽
497
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalasergluvalileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
498
108
prt
人工序列
描述人工序列:合成的
多肽
498
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglualaileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
499
108
prt
人工序列
描述人工序列:合成的
多肽
499
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserthrserilealaargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
500
108
prt
人工序列
描述人工序列:合成的
多肽
500
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserleuasnileglyargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleualathrargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
501
108
prt
人工序列
描述人工序列:合成的
多肽
501
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnthrilegluargarg
202530
leuasntrptyrglnglnlysproglylysalaproargleuleuile
354045
tyrleuserserlysleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcyshisglntyrgluserproproleu
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
502
116
prt
人工序列
描述人工序列:合成的
多肽
502
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrilealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
503
116
prt
人工序列
描述人工序列:合成的
多肽
503
gluvalglnproleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargile
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
504
116
prt
人工序列
描述人工序列:合成的
多肽
504
gluvalglnleuleugluserglyglyglyservalglnproglygly
151015
serleuargleusercysalaalathrglyserthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrsertyrasptyrtrpglyglnglythrleuval
100105110
servalserser
115
505
116
prt
人工序列
描述人工序列:合成的
多肽
505
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyleuthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
506
116
prt
人工序列
描述人工序列:合成的
多肽
506
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysgluprotyrsertyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
507
116
prt
人工序列
描述人工序列:合成的
多肽
507
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargprogluaspthralavaltyrtyrcys
859095
vallysaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
508
116
prt
人工序列
描述人工序列:合成的
多肽
508
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrilealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrproval
100105110
thrvalserser
115
509
116
prt
人工序列
描述人工序列:合成的
多肽
509
gluvalglnleumetgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphealaglytyr
202530
glumettrptrptyrargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyargserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
510
116
prt
人工序列
描述人工序列:合成的
多肽
510
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
511
116
prt
人工序列
描述人工序列:合成的
多肽
511
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrilealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
512
116
prt
人工序列
描述人工序列:合成的
多肽
512
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
servalserser
115
513
116
prt
人工序列
描述人工序列:合成的
多肽
513
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrilealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
514
116
prt
人工序列
描述人工序列:合成的
多肽
514
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrilethrargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
515
116
prt
人工序列
描述人工序列:合成的
多肽
515
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrppheargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspthrlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrtrpargglnglythrleuval
100105110
thrvalserser
115
516
116
prt
人工序列
描述人工序列:合成的
多肽
516
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphealaglytyr
202530
gluvaltrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
517
116
prt
人工序列
描述人工序列:合成的
多肽
517
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargile
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leulysmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
518
116
prt
人工序列
描述人工序列:合成的
多肽
518
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
519
116
prt
人工序列
描述人工序列:合成的
多肽
519
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyleuthrphealaglytyr
202530
glumettrptrpvalargargalaproglylysglyleugluargval
354045
alaalaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
520
116
prt
人工序列
描述人工序列:合成的
多肽
520
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
gluleutrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrargglyglnglythrleuval
100105110
thrvalserser
115
521
116
prt
人工序列
描述人工序列:合成的
多肽
521
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaproglyphethrleualaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
522
116
prt
人工序列
描述人工序列:合成的
多肽
522
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyleuthrphealaglytyr
202530
glumettrptrpvalargargalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrthrserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyargglythrleuval
100105110
thrvalserser
115
523
116
prt
人工序列
描述人工序列:合成的
多肽
523
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrsertyrasptyrtrpglyhisglythrleuval
100105110
thrvalserser
115
524
116
prt
人工序列
描述人工序列:合成的
多肽
524
gluvalglnproleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthrglyvaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
525
116
prt
人工序列
描述人工序列:合成的
多肽
525
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheaspsertrpglyglnglythrleuval
100105110
thrvalserser
115
526
116
prt
人工序列
描述人工序列:合成的
多肽
526
glualaglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyleuthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
527
116
prt
人工序列
描述人工序列:合成的
多肽
527
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargpheserileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheasphistrpglyglnglythrleuval
100105110
thrvalserser
115
528
116
prt
人工序列
描述人工序列:合成的
多肽
528
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserthrphealaglytyr
202530
glumettrptrpvalargargalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
529
116
prt
人工序列
描述人工序列:合成的
多肽
529
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrppheargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheaspasntrpglyglnglythrleuval
100105110
thrvalserser
115
530
116
prt
人工序列
描述人工序列:合成的
多肽
530
gluvalglnleuleugluserglyglyglyleuvalgluproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheasphisargglyglnglythrleuval
100105110
thrvalserser
115
531
116
prt
人工序列
描述人工序列:合成的
多肽
531
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrthrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrserpheasphisargglyglnglythrleuval
100105110
thrvalserser
115
532
116
prt
人工序列
描述人工序列:合成的
多肽
532
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysgluprotyrsertyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
533
116
prt
人工序列
描述人工序列:合成的
多肽
533
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrppheargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheaspasntrpglyglnglythrleuval
100105110
thrvalserser
115
534
116
prt
人工序列
描述人工序列:合成的
多肽
534
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprotyrsertyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
535
116
prt
人工序列
描述人工序列:合成的
多肽
535
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheaspasntrpglyglnglythrleuval
100105110
thrvalserser
115
536
116
prt
人工序列
描述人工序列:合成的
多肽
536
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrhiscys
859095
alalysgluprotyrsertyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
537
116
prt
人工序列
描述人工序列:合成的
多肽
537
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
glumettrptrppheargglnalaproglylysglyleuglutrpval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheaspasntrpglyglnglythrleuval
100105110
thrvalserser
115
538
116
prt
人工序列
描述人工序列:合成的
多肽
538
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
gluleutrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysaspprotyrserpheasptyrargglyglnglythrleuval
100105110
thrvalserser
115
539
116
prt
人工序列
描述人工序列:合成的
多肽
539
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglytyr
202530
gluleutrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileserglyserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspprotyrserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
540
120
prt
人工序列
描述人工序列:合成的
多肽
540
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalarglysalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
541
120
prt
人工序列
描述人工序列:合成的
多肽
541
gluvalglnleuleuvalserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalargglnalaproglylysglyproglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
542
120
prt
人工序列
描述人工序列:合成的
多肽
542
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetvaltrpvalarglysalaproglymetglyleuglutrpval
354045
serserileseralaserglyglytyrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnmetleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glyalaleuvalthrvalthrser
115120
543
120
prt
人工序列
描述人工序列:合成的
多肽
543
gluvalglnleuleuvalserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetvaltrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargpheserileserargaspaspserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglyhis
100105110
glyalaleuvalthrvalserser
115120
544
120
prt
人工序列
描述人工序列:合成的
多肽
544
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
545
120
prt
人工序列
描述人工序列:合成的
多肽
545
glualaglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetvaltrpvalargglnalaproglylysglyleuglutrpile
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnleuasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglyarg
100105110
glythrleuvalthrvalserser
115120
546
120
prt
人工序列
描述人工序列:合成的
多肽
546
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysserthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglypro
100105110
glyalaleuvalthrvalserser
115120
547
120
prt
人工序列
描述人工序列:合成的
多肽
547
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalarglysalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleuphe
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
548
120
prt
人工序列
描述人工序列:合成的
多肽
548
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglypro
100105110
glyalaleuvalthrvalserser
115120
549
120
prt
人工序列
描述人工序列:合成的
多肽
549
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalargglnalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysgluprovaltyrtyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
550
120
prt
人工序列
描述人工序列:合成的
多肽
550
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheprothrala
202530
glumetleutrpvalarglysalaproglylysglyleuglutrpval
354045
serserileseralaserglyglyserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspalaalavaltyrtyrcys
859095
alalysgluprovalsertyrvalalathrpheasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
551
108
prt
人工序列
描述人工序列:合成的
多肽
551
asnileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leuthrtrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
552
108
prt
人工序列
描述人工序列:合成的
多肽
552
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproarglysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuhispro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
553
108
prt
人工序列
描述人工序列:合成的
多肽
553
aspileglnmetthrglnserproserserleuthralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuval
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluasnilearg
100105
554
108
prt
人工序列
描述人工序列:合成的
多肽
554
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheilealathrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
555
108
prt
人工序列
描述人工序列:合成的
多肽
555
aspileglnmetthrglnserproserpheleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheilealathrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
556
108
prt
人工序列
描述人工序列:合成的
多肽
556
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalathrlysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
557
108
prt
人工序列
描述人工序列:合成的
多肽
557
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
558
108
prt
人工序列
描述人工序列:合成的
多肽
558
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
559
108
prt
人工序列
描述人工序列:合成的
多肽
559
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglysermetleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
560
108
prt
人工序列
描述人工序列:合成的
多肽
560
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
561
108
prt
人工序列
描述人工序列:合成的
多肽
561
aspileglnmetthrglnserproserserleuthralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
562
108
prt
人工序列
描述人工序列:合成的
多肽
562
asnileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
563
108
prt
人工序列
描述人工序列:合成的
多肽
563
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrileasncysargalaserhispheileglythrleu
202530
leusertrptyrglnhislysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
564
108
prt
人工序列
描述人工序列:合成的
多肽
564
aspileglnleuthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalathrlysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
565
108
prt
人工序列
描述人工序列:合成的
多肽
565
aspileglnmetthrglnserproserserleutyralaservalgly
151015
aspargvalthrilethrcysargvalserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuserileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysgln
100105
566
108
prt
人工序列
描述人工序列:合成的
多肽
566
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproarglysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
567
108
prt
人工序列
描述人工序列:合成的
多肽
567
aspileglnileileglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
568
108
prt
人工序列
描述人工序列:合成的
多肽
568
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnleulysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
569
108
prt
人工序列
描述人工序列:合成的
多肽
569
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnleulysproglylysalaprolysleuleuile
354045
thrtyrglysertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluasnlysarg
100105
570
108
prt
人工序列
描述人工序列:合成的
多肽
570
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnleulysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnargglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
571
108
prt
人工序列
描述人工序列:合成的
多肽
571
aspileglnmetthrglnalaproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnleulysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluasnlysarg
100105
572
108
prt
人工序列
描述人工序列:合成的
多肽
572
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphealaleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
573
108
prt
人工序列
描述人工序列:合成的
多肽
573
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
574
108
prt
人工序列
描述人工序列:合成的
多肽
574
aspileleumetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
575
108
prt
人工序列
描述人工序列:合成的
多肽
575
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
valsertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrtyrglyglnglythrlysvalgluilelysarg
100105
576
108
prt
人工序列
描述人工序列:合成的
多肽
576
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
valsertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluasnlysarg
100105
577
108
prt
人工序列
描述人工序列:合成的
多肽
577
aspilelysmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
valsertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglysermetleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
578
108
prt
人工序列
描述人工序列:合成的
多肽
578
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnalaserhispheileglythrleu
202530
valsertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
579
108
prt
人工序列
描述人工序列:合成的
多肽
579
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglysertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
580
108
prt
人工序列
描述人工序列:合成的
多肽
580
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnleulysproglylysalaprolysleuleuile
354045
thrtyrglysertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
581
108
prt
人工序列
描述人工序列:合成的
多肽
581
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglypheglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglngluvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
582
108
prt
人工序列
描述人工序列:合成的
多肽
582
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalserilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglypheglythraspphethrleuthrileserserleuglnpro
65707580
gluaspleualathrtyrtyrcysglyglngluvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
583
108
prt
人工序列
描述人工序列:合成的
多肽
583
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysglnalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglypheglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglngluvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
584
108
prt
人工序列
描述人工序列:合成的
多肽
584
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglypheglythrgluphethrleuthrileglyserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
585
108
prt
人工序列
描述人工序列:合成的
多肽
585
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglythrleu
202530
leusertrptyrglnglnlysproglylysalathrlysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrppropro
859095
thrpheglyglnglythrlysvalgluilelysarg
100105
586
108
prt
人工序列
描述人工序列:合成的
多肽
586
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheilealaserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
587
108
prt
人工序列
描述人工序列:合成的
多肽
587
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheilealaglnleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
588
108
prt
人工序列
描述人工序列:合成的
多肽
588
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheilealaglnleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluileargarg
100105
589
108
prt
人工序列
描述人工序列:合成的
多肽
589
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhistyrilealaserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyalaproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
590
108
prt
人工序列
描述人工序列:合成的
多肽
590
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpalasertyrleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
591
108
prt
人工序列
描述人工序列:合成的
多肽
591
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpthrsertyrleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
592
108
prt
人工序列
描述人工序列:合成的
多肽
592
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpsersertyrleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
593
108
prt
人工序列
描述人工序列:合成的
多肽
593
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpglysertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
594
108
prt
人工序列
描述人工序列:合成的
多肽
594
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpalasertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
595
108
prt
人工序列
描述人工序列:合成的
多肽
595
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpsersertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
596
108
prt
人工序列
描述人工序列:合成的
多肽
596
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhistrpilealaglnleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
597
108
prt
人工序列
描述人工序列:合成的
多肽
597
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leuargtrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
598
108
prt
人工序列
描述人工序列:合成的
多肽
598
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhisargilealaglnleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
599
108
prt
人工序列
描述人工序列:合成的
多肽
599
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhistyrilealaserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
600
108
prt
人工序列
描述人工序列:合成的
多肽
600
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
argpheglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
601
108
prt
人工序列
描述人工序列:合成的
多肽
601
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrlyssertyrleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
602
108
prt
人工序列
描述人工序列:合成的
多肽
602
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtrpglysertyrleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
603
108
prt
人工序列
描述人工序列:合成的
多肽
603
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheiletrpglypro
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspseralathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
604
108
prt
人工序列
描述人工序列:合成的
多肽
604
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhistrpilealathrleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
605
108
prt
人工序列
描述人工序列:合成的
多肽
605
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheiletrpglypro
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
606
108
prt
人工序列
描述人工序列:合成的
多肽
606
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leuasntrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglyserleuleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
607
108
prt
人工序列
描述人工序列:合成的
多肽
607
glyileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserhispheileglyserleu
202530
leusertrptyrglnvallysproglylysalaprolysleuleuile
354045
thrtyrglysertrpleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglyglnglyvalleutrpproala
859095
thrpheglyglnglythrthrvalgluilelysarg
100105
608
348
dna
人工序列
描述人工序列:合成的
多核苷酸
608
gaggtgcagctgttggagtccgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
609
348
dna
人工序列
描述人工序列:合成的
多核苷酸
609
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
610
348
dna
人工序列
描述人工序列:合成的
多核苷酸
610
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcagggaaccctggtcaccgtctcgagc348
611
348
dna
人工序列
描述人工序列:合成的
多核苷酸
611
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
612
348
dna
人工序列
描述人工序列:合成的
多核苷酸
612
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc348
613
369
dna
人工序列
描述人工序列:合成的
多核苷酸
613
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgctatgaggtatgcgcgttttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
614
348
dna
人工序列
描述人工序列:合成的
多核苷酸
614
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttatttttgactactggggtcagggaaccctggtcaccgtctcgagc348
615
357
dna
人工序列
描述人工序列:合成的
多核苷酸
615
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgacttatcatatgcagtgggtccgccaggct120
ccagggaagggtctggagtgggtctcaatgattgatgcggatggtcttgggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaccgggt300
ccgcagtttggtcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
616
363
dna
人工序列
描述人工序列:合成的
多核苷酸
616
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcttccggattcaccttttcggggtatgatatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattagtgcgtcgggtgtttttacatactac180
gcagactccgtgaagggccggttcaccacctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatcct300
aatcgttttgcgcttaataattttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
617
324
dna
人工序列
描述人工序列:合成的
多核苷酸
617
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcgggttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
618
324
dna
人工序列
描述人工序列:合成的
多核苷酸
618
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgcgagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
619
348
dna
人工序列
描述人工序列:合成的
多核苷酸
619
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
620
360
dna
人工序列
描述人工序列:合成的
多核苷酸
620
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatggtgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
621
324
dna
人工序列
描述人工序列:合成的
多核苷酸
621
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
622
357
dna
人工序列
描述人工序列:合成的
多核苷酸
622
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgaagaatgagatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattgagtcggatggtcaggctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgctgaggacaccgcggtatattactgtgcgaaaaatcgg300
attcctgatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
623
357
dna
人工序列
描述人工序列:合成的
多核苷酸
623
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgctggggctatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattgataaggagggtctgtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaggtagg300
attcctgggctggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
624
357
dna
人工序列
描述人工序列:合成的
多核苷酸
624
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtgatgcggcgatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattcagcctatgggtgatggtacatactac180
gcagactccgtgaagggccggttcaccgtctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
attcctactcttcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
625
357
dna
人工序列
描述人工序列:合成的
多核苷酸
625
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggattcgcctatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattacttcgaatggttatgagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
attcctactcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
626
357
dna
人工序列
描述人工序列:合成的
多核苷酸
626
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgagcatgatatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattggtccggatggttttcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
attcctactcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
627
357
dna
人工序列
描述人工序列:合成的
多核苷酸
627
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtgagtatcatatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattactcctcttggtacgcttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
attccttcgcttacgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
628
357
dna
人工序列
描述人工序列:合成的
多核苷酸
628
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtacgaatgcgatgagttgggtccgccaggct120
ccagggaagggtctggagtgggtctcaaggatttcgccgggtggtgattatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtgtattactgtgcgaaagggcgt300
gttccggatctgctttttgactactggggtcagggaaccctggtcaccgtctcgagc357
629
357
dna
人工序列
描述人工序列:合成的
多核苷酸
629
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgtctgaggagatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggatttcggctgatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcgaaagggcgt300
gttccggatctgctttttgactactggggtcagggaaccctggtcaccgtctcgagc357
630
357
dna
人工序列
描述人工序列:合成的
多核苷酸
630
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgaggatgatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgcggttgatggtgatcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtaag300
gttccgtctcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
631
357
dna
人工序列
描述人工序列:合成的
多核苷酸
631
gaggtgcagctgttggagtctgggggaggcttggtacagcctgggggatccctgcgtctc60
tcctgtgcagcctccggattcacctttaggacgatggatatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattacgggtgatggtatgaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccggggacaccgcggtatattactgtgcgaaaggggtg300
actccggatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
632
357
dna
人工序列
描述人工序列:合成的
多核苷酸
632
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagcgtgatgatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatgctgggggtgtgcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaggggtg300
actccggatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
633
357
dna
人工序列
描述人工序列:合成的
多核苷酸
633
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgatgattctatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggatttcgagtgatggtgcgagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggtg300
actccggatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
634
357
dna
人工序列
描述人工序列:合成的
多核苷酸
634
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgaggaggatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatagtgttggtgaggggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggtg300
actccggatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
635
357
dna
人工序列
描述人工序列:合成的
多核苷酸
635
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgattcggcgatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggattgataatcctggtcagcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaggtact300
gttcctacgctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
636
357
dna
人工序列
描述人工序列:合成的
多核苷酸
636
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggcagcatagtatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatggtgggggttataatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggag300
gttcctcgtcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
637
357
dna
人工序列
描述人工序列:合成的
多核苷酸
637
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtcaggagcctatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggattgcgtataatggtggtgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
actcctaatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
638
357
dna
人工序列
描述人工序列:合成的
多核苷酸
638
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagaattatccgatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatgctacgggttctattacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggtt300
attcctcatttgatgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
639
357
dna
人工序列
描述人工序列:合成的
多核苷酸
639
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgtgattatgatatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattactggtactggtaatagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgcaaggggtg300
gtgccgtatcttgcttttgactactggggtcagggaaccctggtcaccgtctcgagc357
640
357
dna
人工序列
描述人工序列:合成的
多核苷酸
640
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggctgatgcgatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattaatgtggatggtgatcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtact300
gttcctacgctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
641
357
dna
人工序列
描述人工序列:合成的
多核苷酸
641
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatcgggcggatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggatttcgggggagggtaagtgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatg300
gttcctaatttggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
642
357
dna
人工序列
描述人工序列:合成的
多核苷酸
642
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcattgggagccgatgtcttgggtccgccaggct120
ccggggaagggtctagagtgggtctcacgtattaattcttctggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatg300
gttcctaatttggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
643
357
dna
人工序列
描述人工序列:合成的
多核苷酸
643
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgatgagccgatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattcctcctgagggtgctccgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
actcctaatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
644
357
dna
人工序列
描述人工序列:合成的
多核苷酸
644
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcataatcatgatatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattagtcggggtggtcttcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
gtgccggatctgcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
645
357
dna
人工序列
描述人工序列:合成的
多核苷酸
645
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatgagtatcctatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatggggatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
attccggctatgcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
646
357
dna
人工序列
描述人工序列:合成的
多核苷酸
646
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggatgtgcctatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattgatccttatggttctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtatt300
atgcctagtcttacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
647
357
dna
人工序列
描述人工序列:合成的
多核苷酸
647
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcggattatgatatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtatttcggcgcttggtgctactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtcag300
cttccggcgttggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
648
357
dna
人工序列
描述人工序列:合成的
多核苷酸
648
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaagcgttattatatgacttgggtccgccaggct120
ccagggaaggatctagagtgggtctcaggtattgttccttctggtaataggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtagg300
attccggatctgcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
649
366
dna
人工序列
描述人工序列:合成的
多核苷酸
649
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgattatgatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggatttctccgacgggtgggcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtgtt300
attccgtatttgtctttttctccgtttgactactggggtcagggaaccctggtcaccgtc360
tcgagc366
650
366
dna
人工序列
描述人工序列:合成的
多核苷酸
650
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctaagtattggatgggttgggcccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgattcgcatggtgctggtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgtcgaggacaccgcggtatattactgtgcgaaaggtgct300
cctaagtttatgactacgtatacgtttgactactggggtcagggaaccctggtcaccgtc360
tcgagc366
651
351
dna
人工序列
描述人工序列:合成的
多核苷酸
651
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttttgtcttatccgatgcattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgattcgaggggttcggttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtcat300
agttggacgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
652
357
dna
人工序列
描述人工序列:合成的
多核苷酸
652
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgaatagtaatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatccggatggtgggtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaagggcgt300
attcctactcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
653
357
dna
人工序列
描述人工序列:合成的
多核苷酸
653
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggccgaggaggatgggttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgatgatattggtcgtaggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaaggggcg300
cagggtgtgttgttgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
654
351
dna
人工序列
描述人工序列:合成的
多核苷酸
654
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggattataggatggtttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgatttctacttctggtgagctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaaacggcg300
ggtcagttttttgactactggggtcagggaaccctggtcaccgtctcgagc351
655
348
dna
人工序列
描述人工序列:合成的
多核苷酸
655
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccggagtatgagatggtttgggtccgccaggct120
ccagggaagggtctggagtgggtctcagcgatttcgcgtgagggtcgggctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacaacctgcgtgccgaggataccgcggtatattactgtgcgaaagagcct300
gttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
656
348
dna
人工序列
描述人工序列:合成的
多核苷酸
656
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgacttatgagatgctttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcttcttctggtaattatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
ctgatgtttgactactggggtcagggaaccctggtcaccgtctcgagc348
657
348
dna
人工序列
描述人工序列:合成的
多核苷酸
657
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatactgaggagatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattagtcctaatggtgcttttacattctac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagcct300
attctgtttgactactggggtcagggaaccctggtcaccgtctcgagc348
658
351
dna
人工序列
描述人工序列:合成的
多核苷酸
658
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtcattatgatatggtttgggtccgccaggct120
ccagggaggggtctagagtgggtctcaactattaatggtgctggtctgaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgcaaagtgct300
agtcgtatttttgactactggggtcagggaaccctggtcaccgtctcgagc351
659
351
dna
人工序列
描述人工序列:合成的
多核苷酸
659
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaggagttatgagatggcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattagtactctgggtacgaagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgcaatcttct300
actcatatttttgactactggggtcagggaaccctggtcaccgtctcgagc351
660
351
dna
人工序列
描述人工序列:合成的
多核苷酸
660
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttattaggtatgagatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtatttcgtcgtctggttggacgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaagtgat300
gctcatatttttgactactggggtcagggaaccctggtcaccgtctcgagc351
661
351
dna
人工序列
描述人工序列:合成的
多核苷酸
661
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttatgcttatgagatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggatgatggtacgcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatctg300
gggcaggggtttgactactggggtcagggaaccctggtcaccgtctcgagc351
662
357
dna
人工序列
描述人工序列:合成的
多核苷酸
662
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgatcatgggatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagggattggtccgtctggtgaggcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatcgt300
attcctaatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
663
348
dna
人工序列
描述人工序列:合成的
多核苷酸
663
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtctcaggatatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatagg300
tctgattttgactactggggtcagggaaccctggtcaccgtctcgagc348
664
351
dna
人工序列
描述人工序列:合成的
多核苷酸
664
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggattatgatatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattcgtcatccgggtggtgttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagctgtt300
cctaagggttttgactactggggtcagggaaccctggtcaccgtctcgagc351
665
357
dna
人工序列
描述人工序列:合成的
多核苷酸
665
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggtttattggatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattgatccgcagggtgggatgacatactac180
gcagactccgtgaagggccggttcaccatctctcgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagcgcgt300
attcctaatttggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
666
357
dna
人工序列
描述人工序列:合成的
多核苷酸
666
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggagtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgcttatgatatgacgtgggtccgccaggct120
ccagggaagggtcttgagtgggtctcacgtattaatccgacgggttcttatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagctaag300
attccgaatttggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
667
363
dna
人工序列
描述人工序列:合成的
多核苷酸
667
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcggatagtgagatgatgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattgcgcataatggtgggcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagctggt300
catcctcagcagactgaggcttttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
668
348
dna
人工序列
描述人工序列:合成的
多核苷酸
668
gagatgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctacttatgatatgtattgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaagatttctccgaatggttggagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatcag300
acgcattttgactactggggtcagggaaccctggtcaccgtctcgagc348
669
348
dna
人工序列
描述人工序列:合成的
多核苷酸
669
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgtttatgatatgaggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgatttcttcttcgggtacgtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatcct300
aagaattttgactactggggtcagggaaccctggtcaccgtctcgagc348
670
351
dna
人工序列
描述人工序列:合成的
多核苷酸
670
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctcatgaggatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgtact300
aggagtaagtttgactactggggtcagggaaccctggtcaccgtctcgagc351
671
360
dna
人工序列
描述人工序列:合成的
多核苷酸
671
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagaagtatattatgggttgggcccgccaggct120
ccagggaagggtctagagtgggtctcaacgattgattattggggtcagcatacatactac180
gcagactccgtgaagggccggttcactatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgtagt300
catcttattcctctgcagtttgactactggggtcagggaaccctggtcaccgtctcgagc360
672
369
dna
人工序列
描述人工序列:合成的
多核苷酸
672
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgattatgcgatggggtgggtccgccaggct120
ccagggaagggtctggagtgggtctcaacgatttcgtatgtgggttattatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaaaggct300
ctgcggggggaggcgtttacggagcgttttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
673
369
dna
人工序列
描述人工序列:合成的
多核苷酸
673
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtccgtatatgatgcattgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattgaggttaatggtaataggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatgggtt300
ggttcgaagacgtcgtcggataagagttttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
674
360
dna
人工序列
描述人工序列:合成的
多核苷酸
674
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtacgacggagatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattggtagtgctggtgcttggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaattggt300
gggcatcctcagggtcagtttgactactggggtcagggaaccctggtcaccgtctcgagc360
675
357
dna
人工序列
描述人工序列:合成的
多核苷酸
675
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgcctc60
tcctgtgcagcctccggattcacctttcctagggagtggatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattcagcctatgggtcagactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaatattct300
cggaataaggggttttttgactactggggtcagggaaccctggtcaccgtctcgagc357
676
357
dna
人工序列
描述人工序列:合成的
多核苷酸
676
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttacgagtgagtatatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattcagaggtatggtagtacgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacatgag300
tctaattgggagacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
677
369
dna
人工序列
描述人工序列:合成的
多核苷酸
677
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcggtgtatagtatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattactcctaatggtactcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaactctt300
ggtcggggttcttatcctggtgttgattttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
678
357
dna
人工序列
描述人工序列:合成的
多核苷酸
678
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgagttatgctatgacgtgggtccgccaggct120
ccagggaagggtctggagtgggtctcacgtattacggcggatggtactgttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggttct300
attccgatgcttacgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
679
360
dna
人工序列
描述人工序列:合成的
多核苷酸
679
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgacttatgatatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctatttctcctaatggtactggtatatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaaatcag300
agtgttcatcatgctgtttttgactactggggtcagggaaccctggtcaccgtctcgagc360
680
357
dna
人工序列
描述人工序列:合成的
多核苷酸
680
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagaattatgagatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgcgccgcatggtcggcttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaggtcag300
attccgatgcttgattttgactactggggtcagggaaccctggtcaccgtctcgagc357
681
363
dna
人工序列
描述人工序列:合成的
多核苷酸
681
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgcattatatgatgatgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgatttctcattttggtgatattacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaaatgat300
atggtgatgaagaatggggggtttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
682
357
dna
人工序列
描述人工序列:合成的
多核苷酸
682
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagaggtatgatatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgattcgcggggttggtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggttg300
gtgccgcatctgaggtttgactactggggtcagggaaccctggtcaccgtctcgagc357
683
351
dna
人工序列
描述人工序列:合成的
多核苷酸
683
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgaatgcgcagatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattgatgctatgggtgatgctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtaag300
gttccgagtattgactactggggtcagggaaccctggtcaccgtctcgagc351
684
351
dna
人工序列
描述人工序列:合成的
多核苷酸
684
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgaatgcgcagatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattgatgctatgggtgatgctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaggtgtt300
attccggcgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
685
354
dna
人工序列
描述人工序列:合成的
多核苷酸
685
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcagaatgatcggatgcattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgatttctgctactggtggtgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacagacg300
ggtacgaatcgttttgactactggggtcagggaaccctggtcaccgtctcgagc354
686
357
dna
人工序列
描述人工序列:合成的
多核苷酸
686
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatcagccttatatgtcgtgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctattgatgcttcgggtggtactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcgaaagatcgt300
attcctaatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
687
357
dna
人工序列
描述人工序列:合成的
多核苷酸
687
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgataatgagaatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatggtgggggttataatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcag300
gttcctgagctgctgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
688
357
dna
人工序列
描述人工序列:合成的
多核苷酸
688
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgtttcgtcgaatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactat180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtcgg300
attcctacgttggtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
689
357
dna
人工序列
描述人工序列:合成的
多核苷酸
689
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgtttcgtcgaatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactat180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatcgt300
attcctaatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
690
357
dna
人工序列
描述人工序列:合成的
多核苷酸
690
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgatgattcgatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatgatgctggtagttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtact300
attcctcttctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
691
357
dna
人工序列
描述人工序列:合成的
多核苷酸
691
gagatgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgtttcggatactatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatgggactggtggtgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccggggacaccgcggtatattactgtgcgaaagggctt300
attcctgatcttcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
692
357
dna
人工序列
描述人工序列:合成的
多核苷酸
692
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgaggaggagatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattattggtggtggtcatgagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtact300
attcctcttctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
693
357
dna
人工序列
描述人工序列:合成的
多核苷酸
693
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgataatgagaatatgacttgggtccgccaggct120
ccagggaaggatctagagtgggtctcacggattactgagaggggtgatgtgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtact300
gttcctacgctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
694
357
dna
人工序列
描述人工序列:合成的
多核苷酸
694
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgaggaggagatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattattggtggtggtcatgagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtact300
gttcctacgctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
695
357
dna
人工序列
描述人工序列:合成的
多核苷酸
695
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcatgagacggagatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattaatcggctgggtcaggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtagg300
attcctgggctggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
696
357
dna
人工序列
描述人工序列:合成的
多核苷酸
696
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgatgattcgatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatgatgctggtagttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtact300
gttcctacgctggagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
697
357
dna
人工序列
描述人工序列:合成的
多核苷酸
697
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgataatgagaatatgacttgggtccgccaggct120
ccagggaaggatctagagtgggtctcacggattactgagaggggtgatgtgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtcgg300
attcctacgttggtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
698
357
dna
人工序列
描述人工序列:合成的
多核苷酸
698
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgatgattcgatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattaatgatgctggtagttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
actcctaatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
699
357
dna
人工序列
描述人工序列:合成的
多核苷酸
699
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgatgagccgatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattcctcctgagggtgctccgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggctt300
attcctgatcttcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
700
357
dna
人工序列
描述人工序列:合成的
多核苷酸
700
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcaggatagtgatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattgctgcgcctggtggtagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatcgt300
attcctaatcttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc357
701
357
dna
人工序列
描述人工序列:合成的
多核苷酸
701
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgtttcggatactatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatgggactggtggtgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcag300
gttcctgagctgctgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
702
357
dna
人工序列
描述人工序列:合成的
多核苷酸
702
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcaggatagtgatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattgctgcgcctggtggtagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcgt300
attcctaatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
703
357
dna
人工序列
描述人工序列:合成的
多核苷酸
703
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagccgccggattcacctttgatctggcggagatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatgaggatggtgcttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcggaaggtgtt300
attccgtctctgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
704
357
dna
人工序列
描述人工序列:合成的
多核苷酸
704
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgataagcatatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggatttcgcctgatggtacgtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcggaaggtgtt300
attccgtctctgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
705
357
dna
人工序列
描述人工序列:合成的
多核苷酸
705
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgaggatgatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgcggttgatggtgatcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtaccgaggacaccgcggtatattactgtgcgaaagggaag300
acgccgcatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
706
357
dna
人工序列
描述人工序列:合成的
多核苷酸
706
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagccgccggattcacctttgatctggcggagatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattgatgaggatggtgcttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtcag300
gttcctgctttggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
707
357
dna
人工序列
描述人工序列:合成的
多核苷酸
707
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggattcgatgatgtcgtgggtccgccaggcg120
ccagggaagggtctagagtgggtctcacggattgatcctgggggtgctcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggtg300
actccggatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
708
357
dna
人工序列
描述人工序列:合成的
多核苷酸
708
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagcatgcggatatgagttgggtccgccaggct120
tcagggaagggtctagagtgggtctcacgtattgataatagtggtcagtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggtg300
actccggatttgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
709
357
dna
人工序列
描述人工序列:合成的
多核苷酸
709
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgaggcggagatgaattgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattacgacggatggtgattctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
attcctactcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
710
357
dna
人工序列
描述人工序列:合成的
多核苷酸
710
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctcaggattcacctttgatgatagtgatatgacttgggtccgccaggct120
ccagggaagagtctagagtgggtctcatatattcggggtgatgatgatgagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaaatcgg300
attcctgatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
711
363
dna
人工序列
描述人工序列:合成的
多核苷酸
711
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatgtggcggatatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacatgct300
tctacggaggggccgactgcttttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
712
348
dna
人工序列
描述人工序列:合成的
多核苷酸
712
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggccgtatgatatggggtgggtccgccaggct120
ccagggaagggtctggagtgggtctcatggatttctgctcatggttcgtttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaatggcct300
tataagtttgactactggggtcagggaaccctggtcaccgtctcgagc348
713
357
dna
人工序列
描述人工序列:合成的
多核苷酸
713
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggagtgggtctatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggattggtagtaatggtgcggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatg300
gttcctaatttggtttttgactactggggtcagggaaccctggtcaccgtctcgagc357
714
357
dna
人工序列
描述人工序列:合成的
多核苷酸
714
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatcgttttgatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatcgt300
attcctaatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
715
357
dna
人工序列
描述人工序列:合成的
多核苷酸
715
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggagagtgatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatctcct300
tcttctcgtcttaagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
716
357
dna
人工序列
描述人工序列:合成的
多核苷酸
716
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatagtagtgagatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgagaatcagggtggtgcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcgt300
attcctaatcttgtgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
717
348
dna
人工序列
描述人工序列:合成的
多核苷酸
717
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacccttgatgcgtatcctatgtattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatggattgcttcgggtggtggtgcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgtacg300
aagaattttgactactggggtcagggaaccctggtcaccgtctcgagc348
718
360
dna
人工序列
描述人工序列:合成的
多核苷酸
718
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttatgagttattctatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagggattacttctaatggtaatcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaatcgact300
ggggctaatagtaggaattttgactactggggtcagggaaccctggtcaccgtctcgagc360
719
363
dna
人工序列
描述人工序列:合成的
多核苷酸
719
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggggtatctgatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattgcggctaatggtatgcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaaagccg300
aggggtatttgggatggggattttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
720
357
dna
人工序列
描述人工序列:合成的
多核苷酸
720
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcatgagtctacgatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaactattcggcatccgggtgagtttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccggggacaccgcggtatattactgtgcgaaagggctt300
attcctgatcttcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
721
363
dna
人工序列
描述人工序列:合成的
多核苷酸
721
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgatgtatagtatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgcgccgccgggtggtaggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacagtcg300
ctgacggggtatagtaggtcttttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
722
360
dna
人工序列
描述人工序列:合成的
多核苷酸
722
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgcagaatccgatgtcgtgggtccgccacgct120
ccagggaagggtctagagtgggtctcaacgattcctgcgaatggtcgtcctacatcctac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaatatagt300
cagcagccgggtcgtcggtttgactactggggtcagggaaccctggtcaccgtctcgagc360
723
357
dna
人工序列
描述人工序列:合成的
多核苷酸
723
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctaattatcatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattcctgatagtggtaagcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctacaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggtagg300
attccgtctcttctttttgactactggggtcagggaaccctggtcaccgtctcgagc357
724
360
dna
人工序列
描述人工序列:合成的
多核苷酸
724
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgcagtatcatatgcgttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattaatgatattggtagtaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagttggg300
gggcgggggagtttttcttttgactactggggtcagggaaccctggtcaccgtctcgagc360
725
360
dna
人工序列
描述人工序列:合成的
多核苷酸
725
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcttcgtatgatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattagtgcgtctggtgtgtttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgggag300
catgcgggtcagccgccttttgactactggggtcagggaaccctggtcaccgtctcgagc360
726
360
dna
人工序列
描述人工序列:合成的
多核苷酸
726
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatggttatgctatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaactattaatgctaatggtaagtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaaagttg300
actcttgcttctaattattttgactactggggtcagggaaccctggtcaccgtctcgagc360
727
363
dna
人工序列
描述人工序列:合成的
多核苷酸
727
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttatggattatgatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattactgcgcttggtaagaagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatagt300
gttaagtatcctcttaatctttttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
728
360
dna
人工序列
描述人工序列:合成的
多核苷酸
728
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgcattatacgatggcgtgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctattcagtcgcctggttggcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaatatggg300
gatggtcttcctttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc360
729
357
dna
人工序列
描述人工序列:合成的
多核苷酸
729
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtggtacgccgatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacgtattggggatgagggtcaggagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaggggtg300
actccggatttgacttttgactactggggtcagggaaccctggtcaccgtctcgagc357
730
357
dna
人工序列
描述人工序列:合成的
多核苷酸
730
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtagtagttcgatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattgggtctgatggtccgagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
attcctactcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
731
357
dna
人工序列
描述人工序列:合成的
多核苷酸
731
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatcctggtgagatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattgatgggtctggttcttcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgatgacaccgcggtatattactgtgcgaaagggcgt300
attcctactcttcattttgactactggggtcagggaaccctggtcaccgtctcgagc357
732
357
dna
人工序列
描述人工序列:合成的
多核苷酸
732
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcctgagtctatgatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgggtatcctggtgctactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaggtggt300
agtcgggatgataattttgactactggggtcagggaaccctggtcaccgtctcgagc357
733
372
dna
人工序列
描述人工序列:合成的
多核苷酸
733
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgcctc60
tcctgtgcagcctccggattcacctttggtcagcatagtatgcattgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtgttccgggtccgaagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaagtctt300
agggatttgcgtccgggtgatagtaagagttttgactactggggtcagggaaccctggtc360
accgtctcgagc372
734
348
dna
人工序列
描述人工序列:合成的
多核苷酸
734
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggttctgctgctatggattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattaatgatatgggttctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacagggt300
ggtcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
735
354
dna
人工序列
描述人工序列:合成的
多核苷酸
735
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggttatgataggatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgatggtcctggtggggctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaagggagg300
agggttcctgattttgactactggggtcagggaaccctggtcaccgtctcgagc354
736
357
dna
人工序列
描述人工序列:合成的
多核苷酸
736
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtgagtatgagatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggattgatccgtttggttctgagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaaggtgtg300
gttcctgatttgaattttgactactggggtcagggaaccctggtcaccgtctcgagc357
737
360
dna
人工序列
描述人工序列:合成的
多核苷酸
737
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgataagtatgttatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaactattggtagttatggtggggctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaaggctt300
actcttagtgcgactaagtttgactactggggtcagggaaccctggtcaccgtctcgagc360
738
360
dna
人工序列
描述人工序列:合成的
多核苷酸
738
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggattatgtgatgggttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaactattgcgcatcggggtgatattacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgtagg300
cgtcttagtgattatcggtttgactactggggtcagggaaccctggtcaccgtctcgagc360
739
357
dna
人工序列
描述人工序列:合成的
多核苷酸
739
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggcagtttgatatgtattgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattagtccggctggtactggtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagcgggg300
gatcggtctagtctttttgactacaggggtcagggaaccctggtcaccgtctcgagc357
740
354
dna
人工序列
描述人工序列:合成的
多核苷酸
740
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaaggatacgggtatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtatttctagttatggtcgtgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcgaaattgaat300
gcggcgctgggttttgactactggggtcagggaaccctggtcaccgtctcgagc354
741
354
dna
人工序列
描述人工序列:合成的
多核苷酸
741
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtccgtatccgatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattaatgcgccgggtacgaggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgcaacagatg300
tctagtggggtttttgactactggggtcagggaaccctggtcaccgtctcgagc354
742
354
dna
人工序列
描述人工序列:合成的
多核苷酸
742
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgaatcaggatatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattgatagttctggtcagcttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagttaag300
tctcttgcgcggtttgactactggggtcagggaaccctggtcaccgtctcgagc354
743
351
dna
人工序列
描述人工序列:合成的
多核苷酸
743
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttcctgagtctgatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaccggct300
caggttctgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
744
360
dna
人工序列
描述人工序列:合成的
多核苷酸
744
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagcagtatgtgatgggttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattggtacgtcgggtaagtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgcaacgtagg300
tctctgactcgggttcattttgactactggggtcagggaaccctggtcaccgtctcgagc360
745
357
dna
人工序列
描述人工序列:合成的
多核苷酸
745
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtgtggagcatatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattacgggtgatggtgatcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaacggtt300
tcgtggaatggtcgttttgactactggggtcagggaaccctggtcaccgtctcgagc357
746
351
dna
人工序列
描述人工序列:合成的
多核苷酸
746
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgtggtataatatgggttgggtccgccaggct120
ccagggaagggtctggagtgggtctcaaggattgctccgtctggtattattacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggttg300
cgtggtaagtttgactactggggtcagggaaccctggtcaccgtctcgagc351
747
348
dna
人工序列
描述人工序列:合成的
多核苷酸
747
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgaattatgagatgaggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcttcggctggtactgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacagtcg300
cttaattttgactactggggtcagggaaccctggtcaccgtctcgagc348
748
348
dna
人工序列
描述人工序列:合成的
多核苷酸
748
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgtagcctccggattcacctttgatgaggagccgatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaattattgatccgggtggtggggcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatctaat300
agtatgtttgactactggggtcagggaaccctggtcaccgtctcgagc348
749
363
dna
人工序列
描述人工序列:合成的
多核苷酸
749
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgcgtatcctatgcattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattgcttcttcgggtattacgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatttact300
cggctgcattttcctgcgcagtttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
750
357
dna
人工序列
描述人工序列:合成的
多核苷酸
750
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgattatgcgatgggttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaggatttctcctgagggttctaggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaattgcgg300
ccgtatgcgtcgaagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
751
348
dna
人工序列
描述人工序列:合成的
多核苷酸
751
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaggccgtatgatatgggttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgatttctcatcagggtaatcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagtgtct300
catcattttgactactggggtcagggaaccctggtcaccgtctcgagc348
752
354
dna
人工序列
描述人工序列:合成的
多核苷酸
752
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctgcgtataatatgtggtgggcccgccaggct120
ccagggaagggtttagagtgggtctcatggattaattcgactggttctcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaaattgg300
catcgggggaggtttgactactggggtcagggaaccctggtcaccgtctcgagc354
753
351
dna
人工序列
描述人工序列:合成的
多核苷酸
753
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgataggtatcggatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattaatcggctgggtcagagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagtgaag300
aagcataagtttgactactggggtcagggaaccctggtcaccgtctcgagc351
754
351
dna
人工序列
描述人工序列:合成的
多核苷酸
754
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgcattataatatgcggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattacgaagactggttttcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagcgggg300
cagtttgattttgactactggggtcagggaaccctggtcaccgtctcgagc351
755
354
dna
人工序列
描述人工序列:合成的
多核苷酸
755
gaggtgcagctgttggagtctgggggaggcttagtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttatccttatagtatgcattgggtccgccaggct120
ccagggaagggtctggagtgggtctcaactattgatggtagtggtatgtttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaagattct300
ctgaaggcttcttttgactactggggtcagggaaccctggtcaccgtctcgagc354
756
351
dna
人工序列
描述人工序列:合成的
多核苷酸
756
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgctttatgggatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatatattgggccttatggtcatactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaaagcgg300
aagaagaagtttgactactggggtcagggaaccctggtcaccgtctcgagc351
757
351
dna
人工序列
描述人工序列:合成的
多核苷酸
757
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcctaggtatcggatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattactccgtatggtgctcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatggt300
aagtggtattttgactactggggtcagggaaccctggtcaccgtctcgagc351
758
351
dna
人工序列
描述人工序列:合成的
多核苷酸
758
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatgagtatgcgatgaggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattgatcgtctgggtcttcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaagtggg300
ccttttacgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
759
351
dna
人工序列
描述人工序列:合成的
多核苷酸
759
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagcggtataatatgcgttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattgatcggctgggtcttgctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagcgggt300
tcgtggtcttttgactactggggtcagggaaccctggtcaccgtctcgagc351
760
354
dna
人工序列
描述人工序列:合成的
多核苷酸
760
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtatttatgatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgatttcgtcgtcgggtactcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatcct300
cagccttatccttttgactactggggtcagggaaccctggtcaccgtctcgagc354
761
354
dna
人工序列
描述人工序列:合成的
多核苷酸
761
gaggtgcagctattggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttgggtgtatgatatgcgttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgatttctgcgactggtgtgcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatccg300
cctgctggtcggtttgactactggggtcagggaaccctggtcaccgtctcgagc354
762
357
dna
人工序列
描述人工序列:合成的
多核苷酸
762
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgacttatgatatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctatttctcctaatggtactggtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacctccg300
caggtgaatactgagtttgactaccggggtcagggaaccctggtcaccgtctcgagc357
763
348
dna
人工序列
描述人工序列:合成的
多核苷酸
763
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagaaggaggatatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcacatatttcgccgaatggttatgcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaagttgg300
tctagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
764
354
dna
人工序列
描述人工序列:合成的
多核苷酸
764
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgctactccgatggagtgggcccgccaggct120
ccagggaagggtctagagtgggtctcaactatttctgagagtggttatagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatggaat300
tcgactactggttttgactactggggtcagggaaccctggtcaccgtctcgagc354
765
351
dna
人工序列
描述人工序列:合成的
多核苷酸
765
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatacggtggatatggagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaagctccg300
catcgggcgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
766
357
dna
人工序列
描述人工序列:合成的
多核苷酸
766
gaggtgcagctgttggagtctggggggggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggataaggagatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggattgatgctttgggtgattctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaagggatg300
gttcctcgtctgaagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
767
342
dna
人工序列
描述人工序列:合成的
多核苷酸
767
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgatcattcgatgatgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagatattgagccgcatggtgttcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaatcctact300
tttgactactggggtcagggaaccctggtcaccgtctcgagc342
768
366
dna
人工序列
描述人工序列:合成的
多核苷酸
768
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgccgcatactatgcattgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattggtccggatggtactactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgttcg300
tatagttgggatcgtgggtggacgtttgactactggggtcagggaaccctggtcaccgtc360
tcgagc366
769
357
dna
人工序列
描述人工序列:合成的
多核苷酸
769
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttatgcttcggatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtccgaatggttgggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagctgat300
tatacttatcattcttttgactactggggtcaggggaccctggtcaccgtctcgagc357
770
351
dna
人工序列
描述人工序列:合成的
多核苷酸
770
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcgcattataatatgcggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattacgaagactggttttcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagcgggg300
cagtttgattttgactactggggtcagggaaccctggtcaccgtctcgagc351
771
354
dna
人工序列
描述人工序列:合成的
多核苷酸
771
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgcattatcatatgggttgggcccgccaggct120
ccagggaagggtctagagtgggtctcagttattgggccgaggggtatttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatcgcct300
tcgcgtcataggtttgactactggggtcagggaaccctggtcaccgtctcgagc354
772
351
dna
人工序列
描述人工序列:合成的
多核苷酸
772
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatgagtatgcgatgaggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattgatcgtctgggtcttcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaagtggg300
ccttttacgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
773
369
dna
人工序列
描述人工序列:合成的
多核苷酸
773
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtaattatagtatgaagtgggcccgccaggct120
ccagggaagggtctagagtgggtctcaactattactcctgatggttggtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagtgggg300
gatgctgtttgggggtggattggtgggtttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
774
348
dna
人工序列
描述人工序列:合成的
多核苷酸
774
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggattatggtatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattacgtctaatggtgattttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatctttg300
tataagtttgactactggggtcagggaaccctggtcaccgtctcgagc348
775
369
dna
人工序列
描述人工序列:合成的
多核苷酸
775
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcaggctccggattcacctttcctacttataagatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatttattgattattggggttggcggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaagtccg300
tattcttggactcatgatagtcctcattttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
776
348
dna
人工序列
描述人工序列:合成的
多核苷酸
776
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaggccttatacgatgtgttgggcccgccaggct120
ccagggaagggtctagagtgggtctcatgtattagtgatgctggttcttttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaaggatg300
tcttcttttgactactggggtcagggaaccctggtcaccgtctcgagc348
777
366
dna
人工序列
描述人工序列:合成的
多核苷酸
777
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcagaattatcagatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaactattagtgggactggtaagaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaactcct300
cagaattattttagtgtgcgtcggtttgactactggggtcagggaaccctggtcaccgtc360
tcgagc366
778
354
dna
人工序列
描述人工序列:合成的
多核苷酸
778
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggcgtatactatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaaagatttcgacgtctggtgggcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacctttg300
aattggtgggcgtttgactactggggtcagggaaccctggtcaccgtctcgagc354
779
351
dna
人工序列
描述人工序列:合成的
多核苷酸
779
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaatgcgtatcctatgacttgggtccgccaggct120
ccagggaagggtctagagtgggtctcacggattgatggttatggtcggcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
attcctaattttgactactggggtcagggaaccctggtcaccgtctcgagc351
780
357
dna
人工序列
描述人工序列:合成的
多核苷酸
780
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggcggttgatatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgatttcgcctagtggttctgctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggcgt300
gtgccggatcttggttttgactactggggtcagggaaccctggtcaccgtctcgagc357
781
351
dna
人工序列
描述人工序列:合成的
多核苷酸
781
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatagttatgcgatggggtgggcccgccaggct120
ccagggaagggtctagagtgggtctcagctattggggctaagggtttgtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagcggct300
aggggtaagtttgactactggggtcagggaaccctggtcaccgtctcgagc351
782
348
dna
人工序列
描述人工序列:合成的
多核苷酸
782
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactcggtatcagatgggttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagttattaatgtttggggttcgagtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaatgtct300
gggaagtttgcctactggggtcagggaaccctggtcaccgtctcgagc348
783
351
dna
人工序列
描述人工序列:合成的
多核苷酸
783
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctt60
tcctgtgcagcctccggattcacctttgggaattatagtatgatgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattattcctgctggtacgtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaccgtcg300
attaggttgtttgactactggggtcagggaaccctggtcaccgtctcgagc351
784
348
dna
人工序列
描述人工序列:合成的
多核苷酸
784
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtgcgtatgatatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatggatttctccgaatggttatgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggggt300
gtgaagtttgactactggggtcagggaaccctggtcaccgtctcgagc348
785
369
dna
人工序列
描述人工序列:合成的
多核苷酸
785
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgtttggtatgagatggcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattcaggctgatggtgagcagacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagcttcg300
tatgctcttgtgtatcctcctgaggagtttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
786
366
dna
人工序列
描述人工序列:合成的
多核苷酸
786
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttacgaattataggatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattgatgatctgggtgtgtcgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatggagg300
cttaagaatagtcagccgacggattttgactactggggtcagggaaccctggtcaccgtc360
tcgagc366
787
357
dna
人工序列
描述人工序列:合成的
多核苷酸
787
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatcaggctcatatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatttattaatccttcgggttattatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaccttcg300
cttagtccgtcttcttttgactactggggtcagggaaccctggtcaccgtctcgagc357
788
354
dna
人工序列
描述人工序列:合成的
多核苷酸
788
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagactggtcagatgggttgggcccgccaggct120
ccagggaagggtctagagtgggtctcaaatattgatgggtctggtacgtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaagtacg300
cagaattatcggtttgactactggggtcagggaaccctggtcaccgtctcgagc354
789
357
dna
人工序列
描述人工序列:合成的
多核苷酸
789
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtgcttatccgatgtattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattcataaggatggtaggattacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacagggt300
acgccggttgatgggtttgactactggggtcagggaaccctggtcaccgtctcgagc357
790
363
dna
人工序列
描述人工序列:合成的
多核苷酸
790
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcctgatgagggtatgacgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattgagactggtggtacggtgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaatggat300
gggtctggtacatggcagacgtttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
791
348
dna
人工序列
描述人工序列:合成的
多核苷酸
791
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatagtctgggtatgggttgggcccgccaggct120
ccagggaagggtctagagtgggtctcatatattcgggctgagggtgcttatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaatatctt300
gcggattctgactactggggtcagggaaccctggtcaccgtctcgagc348
792
360
dna
人工序列
描述人工序列:合成的
多核苷酸
792
gaggtgcagctgttggaatctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgagtcgtatatggagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattgatcatattggtggtgggacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagatgat300
ggtcgtggtgggtctatgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
793
348
dna
人工序列
描述人工序列:合成的
多核苷酸
793
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttctggtgggtatatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattggggctagtggtgcgtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaaacgggg300
ggtaggttagactactggggtcagggaaccctggtcaccgtctcgagc348
794
357
dna
人工序列
描述人工序列:合成的
多核苷酸
794
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgaggggcatatggggtgggtccgccaggct120
ccagggaaggatctagagtgggtctcatatattgggagtctgggtttgcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacgggag300
tttagtaatggggggtttgactactggggtcagggaaccctggtcaccgtctcgagc357
795
363
dna
人工序列
描述人工序列:合成的
多核苷酸
795
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttaagactagtcctatgtattgggtccgccaggct120
ccagggaagggtctagagtgggtctcatcgattgatcggactggtgggcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacaggct300
ctgcttactgatgcgaagcgttttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
796
360
dna
人工序列
描述人工序列:合成的
多核苷酸
796
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatggtcgggatatggtttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtccgagtggtctggatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcggaacgtcct300
cagatgctggttactaattttgactactggggtcagggaaccctggtcaccgtctcgagc360
797
357
dna
人工序列
描述人工序列:合成的
多核苷酸
797
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggtaatgatccgatgagttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagggattggtcgggagggtgattctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagattct300
atgcggcatcagccgtttgactactggggtcagggaaccctggtcaccgtctcgagc357
798
357
dna
人工序列
描述人工序列:合成的
多核苷酸
798
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgagacttatatgaagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgattggggcgtcgggtgctgatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatttacg300
catctgaatggtcggtttgactactggggtcagggaaccctggtcaccgtctcgagc357
799
357
dna
人工序列
描述人工序列:合成的
多核苷酸
799
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttggggggtggcctatggggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattgatattgatggtgctccgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagaggag300
gcgggttcttggtcttttgactactggggtcagggaaccctggtcaccgtctcgagc357
800
348
dna
人工序列
描述人工序列:合成的
多核苷酸
800
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgatcaggcgatgtggtgggcccgccaggct120
ccagggaagggtctagagtgggtctcatttattcagggtgatggtggttttacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacctagt300
aagccgtttgactactggggtcagggaaccctggtcaccgtctcgagc348
801
354
dna
人工序列
描述人工序列:合成的
多核苷酸
801
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagactggtcagatgggttgggcccgccaggct120
ccagggaagggtctagagtgggtctcaaatattgatgggtctggtacgtatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagcggtg300
cggaattttgcttttgactactggggtcagggaaccctggtcaccgtctcgagc354
802
372
dna
人工序列
描述人工序列:合成的
多核苷酸
802
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttagtgggcatgatatgtcttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcctcatggtacgcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagggatt300
aggggttggattggtcatgatacgcagccttttgactactggggtcagggaaccctggtc360
accgtctcgagc372
803
357
dna
人工序列
描述人工序列:合成的
多核苷酸
803
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagagtaaggatatgctttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcgtcggatggtactcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgcaagagctg300
ggtgggtcttggcagtttgactactggggtcagggaaccctggtcaccgtctcgagc357
804
366
dna
人工序列
描述人工序列:合成的
多核苷酸
804
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgcggatcgtgatatggtttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattggggcgtcgggtacgtctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcgaaaggtggg300
acgggtcctactgatttgtgggattttgactactggggtcagggaaccctggtcaccgtc360
tcgagc366
805
357
dna
人工序列
描述人工序列:合成的
多核苷酸
805
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgatgatgagaagatgctttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagtattagtgtgagtggtctgcatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagaggag300
gcgggttcttggtcttttgactactggggtcagggaaccctggtcaccgtctcgagc357
806
357
dna
人工序列
描述人工序列:合成的
多核苷酸
806
gaggtgcagctgttggagtccgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggcaggagaggatgatttgggtccgccaggct120
cctgggaagggtctagagtgggtctcagatatttcggcttcgggtgggactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagaggag300
gcgggttcttggtcttttgactactggggtcagggaaccctggtcaccgtctcgagc357
807
348
dna
人工序列
描述人工序列:合成的
多核苷酸
807
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtctctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccatgaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactacaggggtcggggaaccctggtcaccgtctcgagc348
808
348
dna
人工序列
描述人工序列:合成的
多核苷酸
808
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
809
348
dna
人工序列
描述人工序列:合成的
多核苷酸
809
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactaccgggttcagggaaccctggtcaccgtctcgagc348
810
348
dna
人工序列
描述人工序列:合成的
多核苷酸
810
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
811
348
dna
人工序列
描述人工序列:合成的
多核苷酸
811
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccaggct120
ccagggaagggtctagagtggatctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactacagggttcagggaaccctggtcaccgtctcgagc348
812
348
dna
人工序列
描述人工序列:合成的
多核苷酸
812
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccgagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
813
348
dna
人工序列
描述人工序列:合成的
多核苷酸
813
gaggtgcagctgttggagactgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatggacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtcacgagc348
814
348
dna
人工序列
描述人工序列:合成的
多核苷酸
814
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcacgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttcactactggggtcggggaaccctggtcaccgtctcgagc348
815
348
dna
人工序列
描述人工序列:合成的
多核苷酸
815
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgtagcctccggattcacctttgagtggtatgagatgcagtgggtccgccaggct120
ccagggaatggtctagagtggatctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
816
348
dna
人工序列
描述人工序列:合成的
多核苷酸
816
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctctggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggtctagagtgggtctcagcgatatctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgctaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtatttcgactactggggtcggggaaccctcgtcaccgtctcgagc348
817
348
dna
人工序列
描述人工序列:合成的
多核苷酸
817
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactacaggggtcggggaaccctggtcaccgtctcgagc348
818
348
dna
人工序列
描述人工序列:合成的
多核苷酸
818
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccatgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggtctagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactacaggggtcggggaaccctggtcaccgtctcgagc348
819
348
dna
人工序列
描述人工序列:合成的
多核苷酸
819
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggattagagtgggtctcaatgatttccggggatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
820
348
dna
人工序列
描述人工序列:合成的
多核苷酸
820
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgacggttggcgcacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctt300
gggtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
821
348
dna
人工序列
描述人工序列:合成的
多核苷酸
821
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctg300
ctctactttgactactggggtcggggaaccctggtcaccgtctcgagc348
822
348
dna
人工序列
描述人工序列:合成的
多核苷酸
822
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctg300
gggttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
823
348
dna
人工序列
描述人工序列:合成的
多核苷酸
823
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagttg300
gagtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
824
348
dna
人工序列
描述人工序列:合成的
多核苷酸
824
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagggttg300
gagtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
825
348
dna
人工序列
描述人工序列:合成的
多核苷酸
825
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctg300
gccttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
826
348
dna
人工序列
描述人工序列:合成的
多核苷酸
826
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctc300
ttgtactttgactactggggtcggggaaccctggtcaccgtctcgagc348
827
348
dna
人工序列
描述人工序列:合成的
多核苷酸
827
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagttg300
gagttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
828
348
dna
人工序列
描述人工序列:合成的
多核苷酸
828
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagctg300
cagttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
829
348
dna
人工序列
描述人工序列:合成的
多核苷酸
829
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagctg300
ctcttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
830
348
dna
人工序列
描述人工序列:合成的
多核苷酸
830
gaggtgcagctgttggagtctgggggaggcttggtacggcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagttg300
gagttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
831
348
dna
人工序列
描述人工序列:合成的
多核苷酸
831
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagttg300
ctcttctttgactaccggggtcggggaaccctggtcaccgtctcgagc348
832
348
dna
人工序列
描述人工序列:合成的
多核苷酸
832
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcatctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaaaacttg300
gagtattttgactactggggtcggggaaccctggtcaccgtctcgagc348
833
348
dna
人工序列
描述人工序列:合成的
多核苷酸
833
gaggtgcggctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgagtggtatgagatgcagtgggtccgccgggct120
ccagggaagggactagagtgggtctcagcgatttctggtgatggttatcgtacatactac180
gcagactccgtgaaaggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagttg300
cagttctttgactactggggtcggggaaccctggtcaccgtctcgagc348
834
348
dna
人工序列
描述人工序列:合成的
多核苷酸
834
gaggtgcagctgttggggtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgttcgaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
835
348
dna
人工序列
描述人工序列:合成的
多核苷酸
835
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
836
348
dna
人工序列
描述人工序列:合成的
多核苷酸
836
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtggatctcagctattagtggaagtggtggtagcacatactac180
gcagactccgtgaagggccggtttaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
837
348
dna
人工序列
描述人工序列:合成的
多核苷酸
837
gaggtgcagctgttggatcctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggaaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaggaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
838
348
dna
人工序列
描述人工序列:合成的
多核苷酸
838
gaggtgcagctgttggggtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
839
348
dna
人工序列
描述人工序列:合成的
多核苷酸
839
gaggtgcagctgttggagcctgggggaggcttggtacagcctgggggctccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgctaatgaacagcctgcgtgccgaggataccgcggtatattactgttcgaaagagccg300
tttcgttttgactactggggtcagggagccctggtcaccgtctcgagc348
840
348
dna
人工序列
描述人工序列:合成的
多核苷酸
840
gaggtgcagctgttggatcctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggaaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattagtggtagtggtggtagcacatactac180
gcagactccgttaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
ttacgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
841
348
dna
人工序列
描述人工序列:合成的
多核苷酸
841
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatctgggtccgccaggct120
cctgggaagggtctagagtggatctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatccaccgcgacaattctaagaacactctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgttcgaaagagccg300
tttcgttttgactacaggggtctgggaaccttggtcaccgtctcgagc348
842
348
dna
人工序列
描述人工序列:合成的
多核苷酸
842
gaggtgcagctgttggatcctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgggaaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaggaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
ttacgttttgactactggggtcaggggaccctggtcaccgtctcgagc348
843
348
dna
人工序列
描述人工序列:合成的
多核苷酸
843
gaggtgcagctgttggattctgggggaggctttgtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtggatctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtgtattactgtgcgaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
844
348
dna
人工序列
描述人工序列:合成的
多核苷酸
844
gaggtgcagctgttggatcctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtggatctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaataacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggagagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
845
348
dna
人工序列
描述人工序列:合成的
多核苷酸
845
gaggtgcggctgttggagtctggggaaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcacgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
846
348
dna
人工序列
描述人工序列:合成的
多核苷酸
846
gaggtgcagcagttggagtctgggggaggcctggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttttgactactggggtcagggaaccctggtcaccgtctcgagc348
847
348
dna
人工序列
描述人工序列:合成的
多核苷酸
847
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
ttctactacgactactggggtcagggaaccctggtcaccgtctcgagc348
848
348
dna
人工序列
描述人工序列:合成的
多核苷酸
848
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
ttctacttcgactactggggtcagggaaccctggtcaccgtctcgagc348
849
348
dna
人工序列
描述人工序列:合成的
多核苷酸
849
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggagaaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
ttcttctacgactactggggtcagggaaccctggtcaccgtctcgagc348
850
348
dna
人工序列
描述人工序列:合成的
多核苷酸
850
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttccccaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
851
348
dna
人工序列
描述人工序列:合成的
多核苷酸
851
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttttcgccgccgagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
852
348
dna
人工序列
描述人工序列:合成的
多核苷酸
852
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggcccggtacgagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
853
348
dna
人工序列
描述人工序列:合成的
多核苷酸
853
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggatgggtttcagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
854
348
dna
人工序列
描述人工序列:合成的
多核苷酸
854
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggtggggtcacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
855
348
dna
人工序列
描述人工序列:合成的
多核苷酸
855
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcgcctcggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
856
348
dna
人工序列
描述人工序列:合成的
多核苷酸
856
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtcgctggggtgccagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
857
348
dna
人工序列
描述人工序列:合成的
多核苷酸
857
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtaggcagggtgggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
858
348
dna
人工序列
描述人工序列:合成的
多核苷酸
858
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtgtgtccggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
859
348
dna
人工序列
描述人工序列:合成的
多核苷酸
859
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggtggggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
860
348
dna
人工序列
描述人工序列:合成的
多核苷酸
860
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggaacggtctgagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
861
348
dna
人工序列
描述人工序列:合成的
多核苷酸
861
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtgggctgggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
862
348
dna
人工序列
描述人工序列:合成的
多核苷酸
862
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtgcgttgggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
863
348
dna
人工序列
描述人工序列:合成的
多核苷酸
863
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcgcaggggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
864
348
dna
人工序列
描述人工序列:合成的
多核苷酸
864
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtaggcacggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
865
348
dna
人工序列
描述人工序列:合成的
多核苷酸
865
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcaagcattagcaggagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
866
348
dna
人工序列
描述人工序列:合成的
多核苷酸
866
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggatcggtaacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
867
348
dna
人工序列
描述人工序列:合成的
多核苷酸
867
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtgggcacggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
868
348
dna
人工序列
描述人工序列:合成的
多核苷酸
868
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctatttcgaggtggggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
869
348
dna
人工序列
描述人工序列:合成的
多核苷酸
869
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
ttcatgtatgactactggggtcagggaaccctggtcaccgtctcgagc348
870
348
dna
人工序列
描述人工序列:合成的
多核苷酸
870
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
ttcccgtacgactactggggtcagggaaccctggtcaccgtctcgagc348
871
348
dna
人工序列
描述人工序列:合成的
多核苷酸
871
gaggtgcagctgttggcgtctgggggaggcttggtgcagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtggcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
872
348
dna
人工序列
描述人工序列:合成的
多核苷酸
872
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
ttgtactatgactactggggtcagggaaccctggtcaccgtctcgagc348
873
348
dna
人工序列
描述人工序列:合成的
多核苷酸
873
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgtcaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccc300
atgtactatgactactggggtcagggaaccctggtcaccgtctcgagc348
874
348
dna
人工序列
描述人工序列:合成的
多核苷酸
874
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggtttcagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
875
348
dna
人工序列
描述人工序列:合成的
多核苷酸
875
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcgcacgggtgggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
876
348
dna
人工序列
描述人工序列:合成的
多核苷酸
876
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcgggagggtgggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
877
348
dna
人工序列
描述人工序列:合成的
多核苷酸
877
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccgggttcccctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggcagggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
878
348
dna
人工序列
描述人工序列:合成的
多核苷酸
878
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggggcggtgggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
879
348
dna
人工序列
描述人工序列:合成的
多核苷酸
879
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcgcacgggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
880
348
dna
人工序列
描述人工序列:合成的
多核苷酸
880
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggtaggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
881
348
dna
人工序列
描述人工序列:合成的
多核苷酸
881
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
882
348
dna
人工序列
描述人工序列:合成的
多核苷酸
882
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaagggtagcagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
883
348
dna
人工序列
描述人工序列:合成的
多核苷酸
883
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcggggcggttggagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
884
348
dna
人工序列
描述人工序列:合成的
多核苷酸
884
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtcgctcgggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
885
348
dna
人工序列
描述人工序列:合成的
多核苷酸
885
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggtatgagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
886
348
dna
人工序列
描述人工序列:合成的
多核苷酸
886
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
887
348
dna
人工序列
描述人工序列:合成的
多核苷酸
887
gaggtgcagctgttggagtctggggaaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagcatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtcccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggccagggaaccctggtcaccgtctcgagc348
888
348
dna
人工序列
描述人工序列:合成的
多核苷酸
888
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccacctttactgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtggatctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatatttctgtgcgaaagagccg300
cttaggtttgactacaggggtcagggaaccctggtcaccgtctcgagc348
889
348
dna
人工序列
描述人工序列:合成的
多核苷酸
889
gaggtgcagctgttggagcctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgcaaggct120
ccagggaagggtatggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacatgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttggctactggggtcagggtaccctggtcaccgtctcgagc348
890
348
dna
人工序列
描述人工序列:合成的
多核苷酸
890
gaggtgcagctgttggattctgggggaggcttggtacagcctggggggtcactgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctacaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcggggaaccctggtcaccgtctcgagc348
891
348
dna
人工序列
描述人工序列:合成的
多核苷酸
891
gaggtgcagctgttggggtcagggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgccaggct120
ccagggaagagtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtatgacgactggggtcagggaaccctggtcaccgtctcgagc348
892
348
dna
人工序列
描述人工序列:合成的
多核苷酸
892
gaggtgcagccgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgttcagcctccggattcacctttaatgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc348
893
348
dna
人工序列
描述人工序列:合成的
多核苷酸
893
gaggtgcagctgttggagtctggggaaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgagtatgagatgatttgggtccgccaggct120
ccagggaaaggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc348
894
348
dna
人工序列
描述人工序列:合成的
多核苷酸
894
gaggtgcagctgttggaccctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtctgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggaaatggtgctaatacatactac180
gcggactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc348
895
348
dna
人工序列
描述人工序列:合成的
多核苷酸
895
gaggtgcagctgttggagcctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgcaaggct120
ccagggaagggtatggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtcccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgacgactggggtcagggaaccctggtcaccgtctcgagc348
896
348
dna
人工序列
描述人工序列:合成的
多核苷酸
896
gaggtgcagctgttggagtctggggtaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgcaaggcc120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagaaccg300
cttaggtttgacaactggggtcagggaaccctggtcaccgtctcgagc348
897
348
dna
人工序列
描述人工序列:合成的
多核苷酸
897
gaggtgcagttgttggagtctcggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttactgagcatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttctccgtctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc348
898
348
dna
人工序列
描述人工序列:合成的
多核苷酸
898
gaggtgcagccgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgctgcctccggattcacctttactgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggaaccctggtcaccgtctcgagc348
899
348
dna
人工序列
描述人工序列:合成的
多核苷酸
899
gaggtgcagctgttggagtctgcgggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatcaatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgactactggggtcagggagccctggtcaccgtctcgagc348
900
348
dna
人工序列
描述人工序列:合成的
多核苷酸
900
gaggtgcagctgttggagcctgggggaggcttggtacagcctggggggtcgctgcgtctc60
tcctgtgcagcctccggattcacctttactgagtatgagatgatttgggtccgccaggct120
ccagggaagggtctggagtgggtctcatctatttcgggtaatggtgctaatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
cttaggtttgacaactggggtcagggaaccctggtcaccgtctcgagc348
901
369
dna
人工序列
描述人工序列:合成的
多核苷酸
901
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtctctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtagacgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatttgaggtatgcgcgttttgactactcgggtcagggaaccctggtcacc360
gtctcgagc369
902
369
dna
人工序列
描述人工序列:合成的
多核苷酸
902
gaggagcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtagacgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgctacgaggtatgcgcgttttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
903
369
dna
人工序列
描述人工序列:合成的
多核苷酸
903
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaatttcaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactacgggggtcagggaaccctggtcacc360
gtctcgagc369
904
369
dna
人工序列
描述人工序列:合成的
多核苷酸
904
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgacaactggggtcagggaaccctggtcacc360
gtctcgaac369
905
369
dna
人工序列
描述人工序列:合成的
多核苷酸
905
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatacgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattggtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatttgaggtatgcgcgttttgactactcgggtcagggaaccctggtcacc360
gtctcgagc369
906
369
dna
人工序列
描述人工序列:合成的
多核苷酸
906
gaggtgcagctgatggagtcagggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattctcctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaaaggtctagagtgggtctcaggtattagtaggcgtggttatactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactactggggtcggggaaccctggtcacc360
gtctcgagc369
907
369
dna
人工序列
描述人工序列:合成的
多核苷酸
907
gaggtgcagctgttggagtctgggggaggcttggtgcagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcgcctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggactagagtgggtctcaggtattagtaggcatggttttactacgtactac180
gcagactccgtgaagggccggttcaccgtctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgcggtatgcgcgttctgactactggggtcagggaaccctggtcacc360
gtctcgagc369
908
369
dna
人工序列
描述人工序列:合成的
多核苷酸
908
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatttctgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttctgactactggggtcagggaaccctggtcacc360
gtctcgagc369
909
369
dna
人工序列
描述人工序列:合成的
多核苷酸
909
gaggtgcagctgttggagtctggggggggcttggttcagcctggggggtccctgcgtctc60
tcctgtacagcctccgggttcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtattctatgaggtatgcgcgttttgactactcgggtctgggaaccatggtcacc360
gtctcgagc369
910
369
dna
人工序列
描述人工序列:合成的
多核苷酸
910
gaggtgcagctgctggagtctgggggaggcttggtacagcctggggggtcccttcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactacagtggtcagggaaccctggtcacc360
gtctcgagc369
911
369
dna
人工序列
描述人工序列:合成的
多核苷酸
911
gaggtgcagctgttggagtctggaggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcatggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
912
369
dna
人工序列
描述人工序列:合成的
多核苷酸
912
gaggtgcagctgttcgagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaggagccg300
attacgtatgatatgaggtatgcgcgttttgactactggggtcggggaaccctggtcacc360
gtctcgagc369
913
369
dna
人工序列
描述人工序列:合成的
多核苷酸
913
gaggtgcagctgttggagtctgggggaggcttggtacagcctgggggatccctgcgtctc60
tcctgtacagcctccggtttcacctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactactggggtcggggaaccctggtcacc360
gtctcgagc369
914
369
dna
人工序列
描述人工序列:合成的
多核苷酸
914
gaggtgcagctgttggagtctgggggaggctcggtacagcctggggggtccctgcgtctc60
tcctgtacagcctccggattctcctttaatatgtatgagatgtcgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactactggggtcagggaaccctggtcacc360
gtctcgggc369
915
369
dna
人工序列
描述人工序列:合成的
多核苷酸
915
gaggtgcagctgttggagtctgggggaggcttggtacaacctggggggtccctgcgtctc60
tcctgtacagcctccggattcacctttaatatgtatgagatgtcgtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcaggtattagtaggcgtggttttactacatactac180
gcagactccgtgaagggccggttcaccatctcccgtgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagccg300
attacgtatgatatgaggtatgcgcgttttgactactggggtcagggaaccctggtcacc360
gtctcgagc369
916
348
dna
人工序列
描述人工序列:合成的
多核苷酸
916
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
917
348
dna
人工序列
描述人工序列:合成的
多核苷酸
917
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
918
348
dna
人工序列
描述人工序列:合成的
多核苷酸
918
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgcagaggataccgcggtatattactgtacgaaacttccg300
tttatttttgaatactggggtcagggaaccctggtcaccgtctcgagc348
919
348
dna
人工序列
描述人工序列:合成的
多核苷酸
919
gaggtgcagctgttggagtccgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
920
348
dna
人工序列
描述人工序列:合成的
多核苷酸
920
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
921
348
dna
人工序列
描述人工序列:合成的
多核苷酸
921
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattctcctttcgggattatgagatgtggtggtaccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatattac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttatttttgacaaccggggtcagggaaccctggtcaccgtctcgagc348
922
348
dna
人工序列
描述人工序列:合成的
多核苷酸
922
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatacctcggtatatcactgtgcgaaacctccg300
tttatttttggcgactggggtccgggaaccctggtcaccgtctcgagc348
923
348
dna
人工序列
描述人工序列:合成的
多核苷酸
923
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtcccggcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccggggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcacgatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
924
348
dna
人工序列
描述人工序列:合成的
多核苷酸
924
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtcta60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
925
348
dna
人工序列
描述人工序列:合成的
多核苷酸
925
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaaggttctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacatgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
926
348
dna
人工序列
描述人工序列:合成的
多核苷酸
926
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgagccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
927
348
dna
人工序列
描述人工序列:合成的
多核苷酸
927
gaggtgcagctgttggagtctgggggaggcttgatacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtttgaaacttccg300
tttattttcgactactggggtcagggaaccctggtcaccgtctcgagc348
928
348
dna
人工序列
描述人工序列:合成的
多核苷酸
928
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtcta60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaacccgcagggtacgcgtacatactat180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgatgataccgcggtatatcactgtacgaaacttccg300
tttatttttgactactggggtcagggaaccctggtcaccgtctcgagc348
929
348
dna
人工序列
描述人工序列:合成的
多核苷酸
929
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggatggttctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctatat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttttttttgactccaggggtcagggaaccctggtcaccgtctcgagc348
930
348
dna
人工序列
描述人工序列:合成的
多核苷酸
930
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccgggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactctgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
931
348
dna
人工序列
描述人工序列:合成的
多核苷酸
931
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
932
348
dna
人工序列
描述人工序列:合成的
多核苷酸
932
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattctcctttcgggattatgagatgtggtggtaccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatattac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
933
348
dna
人工序列
描述人工序列:合成的
多核苷酸
933
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaaggttctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacatgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
934
348
dna
人工序列
描述人工序列:合成的
多核苷酸
934
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
935
348
dna
人工序列
描述人工序列:合成的
多核苷酸
935
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtacgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
936
348
dna
人工序列
描述人工序列:合成的
多核苷酸
936
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtttgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
937
348
dna
人工序列
描述人工序列:合成的
多核苷酸
937
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtcta60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaacccgcagggtacgcgtacatactat180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgatgataccgcggtatatcactgtacgaaacttccg300
tttatttttgaatactggggtcagggaaccctggtcaccgtctcgagc348
938
348
dna
人工序列
描述人工序列:合成的
多核苷酸
938
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagaacct300
tatagttttgactcctggggtcagggaaccctggtcaccgtctcgagc348
939
348
dna
人工序列
描述人工序列:合成的
多核苷酸
939
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaagaacct300
tatagttatgactactggggtcagggaaccctggtcaccgtctcgagc348
940
348
dna
人工序列
描述人工序列:合成的
多核苷酸
940
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccgggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
941
348
dna
人工序列
描述人工序列:合成的
多核苷酸
941
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtcta60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccgggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
942
348
dna
人工序列
描述人工序列:合成的
多核苷酸
942
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtcta60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgactggggtcagggaaccctggtcaccgtctcgagc348
943
348
dna
人工序列
描述人工序列:合成的
多核苷酸
943
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagttgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
944
348
dna
人工序列
描述人工序列:合成的
多核苷酸
944
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagttgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
945
348
dna
人工序列
描述人工序列:合成的
多核苷酸
945
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtggttccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
946
348
dna
人工序列
描述人工序列:合成的
多核苷酸
946
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtggttccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
947
348
dna
人工序列
描述人工序列:合成的
多核苷酸
947
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
948
348
dna
人工序列
描述人工序列:合成的
多核苷酸
948
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtcta60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgatgggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggatactgcggtatattactgtgcgaaacttccg300
tttatgtttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
949
348
dna
人工序列
描述人工序列:合成的
多核苷酸
949
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
acctacttttccgaccggggtcagggaaccctggtcaccgtctcgagc348
950
348
dna
人工序列
描述人工序列:合成的
多核苷酸
950
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttttctttgaggagtggggtcagggaaccctggtcaccgtctcgagc348
951
348
dna
人工序列
描述人工序列:合成的
多核苷酸
951
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
acgtactttaaggactggggtcagggaaccctggtcaccgtctcgagc348
952
348
dna
人工序列
描述人工序列:合成的
多核苷酸
952
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttacttttccgagtggggtcagggaaccctggtcaccgtctcgagc348
953
348
dna
人工序列
描述人工序列:合成的
多核苷酸
953
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatatcactgtgcgaaacttccg300
atgttctttgaggactggggtcagggaaccctggtcaccgtctcgaac348
954
348
dna
人工序列
描述人工序列:合成的
多核苷酸
954
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttccgttttcggagtggggtcagggaaccctggtcaccgtctcgagc348
955
348
dna
人工序列
描述人工序列:合成的
多核苷酸
955
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatggacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttacttttccgagtggggtcagggaaccctggtcaccgtctcgagc348
956
348
dna
人工序列
描述人工序列:合成的
多核苷酸
956
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtacggtaacctcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
957
348
dna
人工序列
描述人工序列:合成的
多核苷酸
957
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcccggtaccttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggaccggggtcagggaaccctggtcaccgtctcgagc348
958
348
dna
人工序列
描述人工序列:合成的
多核苷酸
958
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtggcttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
959
348
dna
人工序列
描述人工序列:合成的
多核苷酸
959
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgatgggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
960
348
dna
人工序列
描述人工序列:合成的
多核苷酸
960
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgcacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
961
348
dna
人工序列
描述人工序列:合成的
多核苷酸
961
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtccggtgggctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgaccggggtcagggaaccctggtcaccgtctcgagc348
962
348
dna
人工序列
描述人工序列:合成的
多核苷酸
962
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcacggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
963
348
dna
人工序列
描述人工序列:合成的
多核苷酸
963
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccggccggtcggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
964
348
dna
人工序列
描述人工序列:合成的
多核苷酸
964
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtagcttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
965
348
dna
人工序列
描述人工序列:合成的
多核苷酸
965
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcccgactacgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
966
348
dna
人工序列
描述人工序列:合成的
多核苷酸
966
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagactccggattcacctttccgcccgtggagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
967
348
dna
人工序列
描述人工序列:合成的
多核苷酸
967
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtacggtgggctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
968
348
dna
人工序列
描述人工序列:合成的
多核苷酸
968
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtaaccacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
969
348
dna
人工序列
描述人工序列:合成的
多核苷酸
969
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcacggtggctacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
970
348
dna
人工序列
描述人工序列:合成的
多核苷酸
970
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaggggtctagagcgggtctcagctattaatccgcccggtatgctcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
971
348
dna
人工序列
描述人工序列:合成的
多核苷酸
971
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtcagttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
972
348
dna
人工序列
描述人工序列:合成的
多核苷酸
972
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtggctacacatactac180
gcagactccgtgaagggccgattcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
973
348
dna
人工序列
描述人工序列:合成的
多核苷酸
973
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtcgggtgggctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
974
348
dna
人工序列
描述人工序列:合成的
多核苷酸
974
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtcgggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
975
348
dna
人工序列
描述人工序列:合成的
多核苷酸
975
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtcgggtacgctcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
976
348
dna
人工序列
描述人工序列:合成的
多核苷酸
976
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtacggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
977
348
dna
人工序列
描述人工序列:合成的
多核苷酸
977
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtggctacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
978
348
dna
人工序列
描述人工序列:合成的
多核苷酸
978
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtgggctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
979
348
dna
人工序列
描述人工序列:合成的
多核苷酸
979
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcccacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
980
348
dna
人工序列
描述人工序列:合成的
多核苷酸
980
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtaccttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaggaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
981
348
dna
人工序列
描述人工序列:合成的
多核苷酸
981
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgaacggtcggctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgcggactggggtcagggaaccctggtcaccgtctcgagc348
982
348
dna
人工序列
描述人工序列:合成的
多核苷酸
982
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtcagctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
983
348
dna
人工序列
描述人工序列:合成的
多核苷酸
983
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcacggtggcctcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
984
348
dna
人工序列
描述人工序列:合成的
多核苷酸
984
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctggagcgggtctcagctattaatccggcgggtatgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
985
348
dna
人工序列
描述人工序列:合成的
多核苷酸
985
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcacggtaccttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
986
348
dna
人工序列
描述人工序列:合成的
多核苷酸
986
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
987
348
dna
人工序列
描述人工序列:合成的
多核苷酸
987
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtacggtggcctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
988
348
dna
人工序列
描述人工序列:合成的
多核苷酸
988
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattacgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccggccggtttcttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
989
348
dna
人工序列
描述人工序列:合成的
多核苷酸
989
gaggtgcagctgttggagtctgggggaggcttggtacggcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctggagcgggtctcagctattaatccgtacggtggcctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
990
348
dna
人工序列
描述人工序列:合成的
多核苷酸
990
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
991
348
dna
人工序列
描述人工序列:合成的
多核苷酸
991
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
992
348
dna
人工序列
描述人工序列:合成的
多核苷酸
992
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtacggtgggctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatggacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
993
348
dna
人工序列
描述人工序列:合成的
多核苷酸
993
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtacgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
994
348
dna
人工序列
描述人工序列:合成的
多核苷酸
994
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtggctacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcggggaaccctggtcaccgtctcgagc348
995
348
dna
人工序列
描述人工序列:合成的
多核苷酸
995
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtacggtaacctgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
996
348
dna
人工序列
描述人工序列:合成的
多核苷酸
996
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcacggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
997
348
dna
人工序列
描述人工序列:合成的
多核苷酸
997
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccggccggtttctacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
998
348
dna
人工序列
描述人工序列:合成的
多核苷酸
998
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccggcgggtggcctcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgacgactggggtcagggaaccctggtcaccgtctcgagc348
999
348
dna
人工序列
描述人工序列:合成的
多核苷酸
999
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcgcctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcacggttccctcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
1000
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1000
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgtgattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccggccggtgggtacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
tttacttttgaggactggggtcagggaaccctggtcaccgtctcgagc348
1001
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1001
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttggtttacggagtggggtcagggaaccctggtcaccgtctcgagc348
1002
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1002
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
ttcatgttttccgaccggggtcagggaaccctggtcaccgtctcgagc348
1003
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1003
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttttgtttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1004
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1004
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
acgcggtttgaggactggggtcagggaaccctggtcaccgtctcgagc348
1005
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1005
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1006
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1006
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagc348
1007
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1007
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
acgttctttaaggactggggtcagggaaccctggtcaccgtctcgagc348
1008
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1008
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacacgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttttctttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1009
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1009
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
cagttgtttcacgaccggggtcagggaaccctggtcaccgtctcgagc348
1010
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1010
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
cagctctttgaggactggggtcagggaaccctggtcaccgtctcgagc348
1011
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1011
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
tttgggttttccgagtggggtcagggaaccctggtcaccgtctcgagc348
1012
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1012
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
cagttgtttcaggactggggtcagggaaccctggtcaccgtctcgagc348
1013
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1013
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttttctttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1014
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1014
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
cactactttaaggactggggtcagggaaccctggtcaccgtctcgagc348
1015
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1015
gaggtgcagctgttggagtctgggggaggcttggtacagtctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
ttttactttgaggagtggggtcagggaaccctggtcaccgtctcgagc348
1016
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1016
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttaggttttccgaccggggtcagggaaccctggtcaccgtctcgagc348
1017
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1017
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
acgctgtttcaggactggggtcagggaaccctggtcaccgtctcgagc348
1018
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1018
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttacttttccgagtggggtcagggaaccctggtcaccgtctcgaac348
1019
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1019
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttggtttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1020
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1020
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1021
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1021
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
atgttctttgaggactggggtcagggaaccctggtcaccgtctcgaac348
1022
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1022
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1023
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1023
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttttctttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1024
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1024
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggttcgttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttttctttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1025
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1025
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
ttttactttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1026
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1026
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
atgttctttgaggactggggtcagggaaccctggtcaccgtctcgaac348
1027
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1027
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1028
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1028
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
tttttctttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1029
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1029
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttttctttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1030
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1030
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
ttttactttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1031
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1031
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaacttccg300
atgttctttgaggactggggtcagggaaccctggtcaccgtctcgaac348
1032
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1032
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1033
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1033
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttttctttcaggagtggggtcagggaaccctggtcaccgtctcgagc348
1034
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1034
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgtggggtgggttgacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaacttccg300
tttttctttcacgagtggggtcagggaaccctggtcaccgtctcgagc348
1035
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1035
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatatcactgtgcgaaacttccg300
atgttctttgaggactggggtcagggaaccctggtcaccgtctccagc348
1036
357
dna
人工序列
描述人工序列:合成的
多核苷酸
1036
gaggtgcagctgttggagactgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgacttatcatatgcagtgggtccgccgggct120
ccagggaagggcctggagtgggtctcaatgattgatgcggatggtcttgggacatactac180
gcagaccccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccaaggacaccgcggtatattactgtgcgagaccgggt300
ccgcagtttggtcagtttgactacttgggtcagggaaccctggtcaccgtctcgagc357
1037
357
dna
人工序列
描述人工序列:合成的
多核苷酸
1037
gaggtgcagctgtttgagtctgggggaggcttggtacagactggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccttttcgacttatcatatgcagtgggtccgccaggct120
ccagggaagggtctggagtgggtctcaatgattgatgcggatggtcttgggaaatactac180
gcagaccccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgtgaaaccgggt300
ccgcagtttggtcagtatgactactggggtcagggaaccctggtcaccgtctcgagc357
1038
363
dna
人工序列
描述人工序列:合成的
多核苷酸
1038
gaggtgcagctgttggagtcagggggaggcttggtacagcctggggggtccctgcggctc60
tcctgttcagcttccggattcaccttttcggggtatgatatgcagtgggtccgccaggct120
ccagggaagggtctagagtgggtctcaacgattagtgcgtcgggtgtttatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaatatcct300
aatcgttttgcgcttaatagttttgactacaggggtcggggaaccctggtcaccgtctcg360
agc363
1039
363
dna
人工序列
描述人工序列:合成的
多核苷酸
1039
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcttccggattcaccttttcggggtatgatatgcagtgggtccgccaggct120
ccagggaggggtctagagtgggtctcaacgattagtgcgtcgggtgtttatacatactac180
acagactccgtgaagggccggttcaccacctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtacgaaatatcca300
aatcgttttgcgcgtaataattttgactactggggtcagggaaccctggtcaccgtctcg360
agc363
1040
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1040
gacatcctgatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
ggggaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcagccaa300
gggaccaaggtggaaatcaaacgg324
1041
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1041
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcagacagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcatccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1042
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1042
gacatccagatgaccgtgtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcagatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggattgcaaagcggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1043
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1043
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcgaccaa300
gggaccaaggtggaaatcaaacgg324
1044
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1044
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttctaccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1045
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1045
gacatccagatgaccgtgtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggattgcaaagcggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1046
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1046
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcagatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcgaccaa300
gggaccaaggtggaaatcaaacgg324
1047
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1047
gacatccagatgacccagtctccatcctcactgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctgagctcctgatcgagagttcttccggtctgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1048
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1048
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcgaatagttctatattgtgggcgttggcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaaacaaacgg324
1049
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1049
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattctgtgggcgttagcttggtaccagcagaaacct120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaaccc240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1050
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1050
gacatccagatgacccagtctccatcctccctgtctgcttctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtgggatcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1051
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1051
gacatccagatgacccagtctccatcctccctgtctgcatctgttggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggattgcaaagcggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1052
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1052
gacatcctgttgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1053
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1053
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggaagtggaactgggacagatttcactctcaccatcagcggtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcgaccaa300
gggaccaaggtggaaatcaaacgg324
1054
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1054
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcccttgccgggcaaatagttctattttgtgggcgttagcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcgagagttcttccggtttgcaaagtggggtcccatca180
cgtttcagtggcagtgcatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgttcagaatgcggtttggcctggtacgttcggccaa300
gggaccaaggtggagatcaaacgg324
1055
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1055
gacatccagatggcccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgcgagtccacctttgacgttaggccaa300
gggaccaaagtggaaatcaaacgg324
1056
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1056
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
ggggaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgccatcagtatgcgagtccacctttgacgttcggccaa300
gggaccaatgtggaaatcaaacgg324
1057
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1057
gacatccagatgacccagtctccatcctccctatctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctgcgtactactgtcatcagtacgagagtccacctttgacgtttggccaa300
gggaccaaagtggaaatcaaacgg324
1058
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1058
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcggacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcgcgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1059
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1059
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaacgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattctgctacgtactactgtcatcagtatgcgagtccacctttgacgttaggccaa300
gggaccaaagtggaaatcaaacgg324
1060
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1060
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagccagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaggcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgcgagtccacctttgacgttaggccaa300
gggaccaaagtggaaatcaaacgg324
1061
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1061
gacatccagataacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagaccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtcctcctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1062
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1062
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
ggggaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaatgg324
1063
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1063
gacatccagttgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagaattcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1064
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1064
gacatccagatgtcccagtctccatccaccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgcttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgatgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1065
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1065
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
attacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagaccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacca240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1066
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1066
gacatccagatgacccagtctccatcctccctgtctgcatccgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaactggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1067
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1067
gacatccagatgacccagtctccatcctccctgtttgcatctgtaggggaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1068
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1068
gacatccagatgacccagtatccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagtcgattgagcgtcgtttaaattggtatcagcagaaacca120
ggggaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggactaaagtggaaatcaaacgg324
1069
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1069
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcggacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcgcgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatccgtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1070
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1070
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcaggcgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatct180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcagcca240
gaagattttgctacgtactactgtcatcagtatgcgagtccacctttgacgctcggccaa300
gggaccaaagtggaaatcaaacgg324
1071
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1071
aacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcaggcgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttctcgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1072
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1072
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgggcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggtcagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1073
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1073
gacatccagatgacccagtctccatcctccctttctgcatctgtaggagaccgtgtcacc60
atcacttgccgagcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagaatttactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1074
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1074
gacatccagatgacccagactccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
ggggaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgccacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtgaaaatcaaacgg324
1075
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1075
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaaccc240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1076
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1076
cacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgccatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1077
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1077
gacgtccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
ggggaagcccctaagctcctgatctatcttacttcccgtttgcaaagcggggtcccatca180
cgtttcagtggtagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgccatcagtatgcgagtccacctttgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1078
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1078
gacatccagatgacccagtcgccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcaccagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggtaatcaaacgg324
1079
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1079
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1080
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1080
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagccgattgagcgtcgtttaaattggtatcagcagaagcca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacatactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1081
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1081
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagacgattgggcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1082
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1082
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagtcgattgagcgccgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtcctcctttgacgttcggccaa300
gggaccaaagtggaaatcatacgg324
1083
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1083
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacct120
gggaaagcccctaagctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1084
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1084
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagtcgattgagcgccgtttaaattggtatcagcagaaacca120
gggaaagcccctaagctcctgatctatcttgcttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtcctcctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1085
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1085
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtatcagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagttcgagcacccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1086
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1086
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtttccccattgaccgtcgtttaaattggtatcagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1087
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1087
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagttccaccattggccgtcgtttaaattggtatcagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1088
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1088
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagttacc60
atcacttgccgggcaagttcccagattgggcgtcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1089
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1089
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtgagcggattgggcgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1090
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1090
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagcagattggccgccgtttaaattggtatcagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1091
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1091
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagccgattgcccggcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1092
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1092
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtgggaacattggccgtcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaagcgg324
1093
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1093
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcggaacattgaccgtcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1094
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1094
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagagcattgggcgtcgtttaaattggtaccagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1095
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1095
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagaacattgggacgcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1096
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1096
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtgaggtcattgggcgtcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1097
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1097
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtgaggcgattggccgtcgtttaaattggtatcagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1098
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1098
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtaccagcattgcgcgtcgtttaaattggtatcagcagaaacct120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1099
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1099
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtttgaacattgggcgtcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatcttgctacccgtttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1100
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1100
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcagacgattgagcgtcgtttaaattggtaccagcagaaacca120
gggaaagcccctaggctcctgatctatctttcgtcgaagttgcaaagtggggtcccatca180
cgcttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtcatcagtatgagagtccacctttgacgttcggccaa300
gggaccaaagtggaaatcaaacgg324
1101
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1101
gaggtgcagctgttggagtctgggggaggcttggttcagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccaccattgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgtgtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgagacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1102
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1102
gaggtgcagccgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcggatctcagctattagcggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1103
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1103
gaggtgcagctgttggagtctgggggaggctcggtacagcctggggggtccctgcgtctc60
tcctgtgcagccaccggatccacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tacagttatgactactggggtcagggaaccctggtctccgtctcgagc348
1104
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1104
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggactcacctttgctgggtatgagatgtggtgggtccgccaggca120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcagtatatcactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1105
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1105
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactctgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaagaacct300
tatagttatgactactggggtcagggaaccctggtcaccgtctcgagc348
1106
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1106
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtcccgaggataccgcggtatattactgtgtgaaagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1107
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1107
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccaccattgccgggtatgagatgtggtgggtccgccaggct120
ccggggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccccggtcaccgtctcgagc348
1108
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1108
gaggtgcagctgatggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccacctttgctgggtatgagatgtggtggtaccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggaagtggtagaagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1109
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1109
gaggtgcagctgctggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacgtactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcagtatattactgtgcgaaagaacct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1110
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1110
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccaccattgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcca300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1111
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1111
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagaccct300
tatagttttgactactggggtcagggaaccctggtctccgtctcgagc348
1112
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1112
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcaccattgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctccgctattagtggtagtggtggtagcacatactac180
gcggactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtttcgagc348
1113
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1113
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgtgtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatcacccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagagcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1114
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1114
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtggttccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgataccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgactactggcgtcagggaaccctggtcaccgtctcgagc348
1115
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1115
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccacctttgctgggtatgaggtgtggtgggtccgccaggct120
ccagggaagggtctggagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1116
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1116
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcggatctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgaaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1117
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1117
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1118
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1118
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggactcacctttgctgggtatgagatgtggtgggtccgccgggct120
ccagggaagggtctagagcgggtcgcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1119
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1119
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagttgtggtgggtccgccaggcc120
ccagggaagggtctagagcgggtctcagctattagtggaagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactaccggggtcagggaaccctggtcaccgtctcgagc348
1120
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1120
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcccccggattcaccttagctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1121
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1121
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggactcacctttgctgggtatgagatgtggtgggtccgtcgggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccacctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcggggaaccctggtcaccgtctcgagc348
1122
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1122
gaggtgcagctgttggagtctgggggaggcttggtacagcccggggggtccctgcgtctc60
tcctgtgccgcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagcggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttatgactactggggtcatggaaccctggttactgtctcgagc348
1123
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1123
gaggtgcagccgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtaacacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccggggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggtaccctggtcaccgtctcgagc348
1124
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1124
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttttgactcctggggtcagggaaccctggtcaccgtctcgagc348
1125
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1125
gaggcgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattaaccttcgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgcgtctcagctattagtggtagtggcggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1126
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1126
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatccacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttctccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttttgaccactggggtcagggaaccctggtcaccgtctcgagc348
1127
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1127
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctcgggatccacctttgctgggtatgagatgtggtgggtccgcagggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1128
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1128
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtggttccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgacaactggggtcagggaaccctggtcaccgtctcgagc348
1129
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1129
gaggtgcagctgttggagtctgggggaggcttggtagagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttttgaccaccggggtcagggaaccctggtcaccgtctcgagc348
1130
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1130
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggatacacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttttgaccaccggggtcagggaaccctggtcaccgtctcgagc348
1131
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1131
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactctgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaagaacct300
tatagttatgactactggggtcagggaaccctggtcaccgtctcgagc348
1132
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1132
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtggttccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgacaactggggtcagggaaccctggtcaccgtctcgagc348
1133
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1133
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactctgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagaacct300
tatagttatgactactggggtcagggaaccctggtcaccgtctcgagc348
1134
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1134
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
cccgggaagggtctagagcgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgacaactggggtcagggaaccctggtcaccgtctcgagc348
1135
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1135
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactctgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatatcactgtgcgaaagaacct300
tatagttatgactactggggtcagggaaccctggtcaccgtctcgagc348
1136
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1136
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagatgtggtggttccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtggtagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgacaactggggtcagggaaccctggtcaccgtctcgagc348
1137
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1137
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagttgtggtgggtccgccaggcc120
ccagggaagggtctagagcgggtctcagctattagtggaagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgaaagatcct300
tatagttttgactaccggggtcagggaaccctggtcaccgtctcgagc348
1138
348
dna
人工序列
描述人工序列:合成的
多核苷酸
1138
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttgctgggtatgagttgtggtgggtccgccaggcc120
ccagggaagggtctagagcgggtctcagctattagtggaagtggtggtagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgcgagagatcct300
tatagttttgactactggggtcagggaaccctggtcaccgtctcgagc348
1139
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1139
gaggtgcagctgttggagtctggggggggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatgctgtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
1140
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1140
gaggtgcagctgttggtgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatgttgtgggtccgccaggct120
ccagggaagggtccagagtgggtctcatcaatttcggctagtggtggttctacatactat180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
1141
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1141
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcgtgtgcagcctccggattcacctttccgactgccgagatggtgtgggtccgcaaggct120
ccagggatgggtctagagtgggtctcatctatttcggctagtggtggttatacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacatgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcagggagccctggtcaccgtcacgagc360
1142
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1142
gaggtgcagctgttggtgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatggtgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttctccatctcccgcgacgattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcatggagccctggtcaccgtctcgagc360
1143
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1143
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacatttccgactgctgagatgttgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgagccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcaacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
1144
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1144
gaggcgcagctgttggagtctgggggtggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatggtgtgggtccgccaggct120
ccagggaagggtctagagtggatctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaattgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcggggaaccctggtcaccgtctcgagc360
1145
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1145
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacatttccgactgctgagatgttgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagagcacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtccaggagccctggtcaccgtctcgagc360
1146
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1146
gaggtgcagctgttggagtccgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatgctgtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgttt240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgccaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
1147
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1147
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacatttccgactgctgagatgttgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtccaggagccctggtcaccgtctcgagc360
1148
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1148
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatgctgtgggtccgccaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ttgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaagagccg300
gtgtattatgtggcgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
1149
360
dna
人工序列
描述人工序列:合成的
多核苷酸
1149
gaggtgcagctgttggagtccgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttccgactgctgagatgctgtgggtccgcaaggct120
ccagggaagggtctagagtgggtctcatctatttcggctagtggtggttctacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacgccgcggtatattactgtgcgaaagagccg300
gtgagttatgtggcgacgtttgactactggggtcagggaaccctggtcaccgtctcgagc360
1150
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1150
aacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttaacttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1151
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1151
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
cggaaagcccctaaactcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcatcct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggtcaa300
gggaccaaggtggaaatcaaacgg324
1152
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1152
gacatccagatgacccagtctccgtcctccctgactgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctggtcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctcctacgttcggccaa300
gggaccaaggtggaaaacatacgg324
1153
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1153
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattgctactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1154
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1154
gacatccagatgacccagtctccatccttcctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattgctactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1155
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1155
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagccactaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagactttgctacgtactactgtggtcagggggtgctgtggcccccgacgttcggccag300
gggaccaaggtggaaatcaaacgt324
1156
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1156
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggttctctgttatcttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1157
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1157
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1158
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1158
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccatgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgcaacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1159
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1159
gacatccagatgactcagtctccatcctccctgtctgcatctgtaggagaccgagtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcctggtaccagcataaacca120
gggaaagcccctaagctcctgatcacctatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagaattcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggagtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1160
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1160
gacatccagatgacccagtctccatcctccctgactgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagaattcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1161
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1161
aacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1162
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1162
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcaattgccgggcaagtcattttattggtactctgttatcttggtaccagcataaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1163
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1163
gacatccagttgacccagtcaccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagccactaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1164
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1164
gacatccagatgacacagtctccatcctccctgtatgcatctgtaggagaccgtgtcacc60
atcacttgccgggtaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcagcatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcccccgacgttcggacaa300
gggaccaaggtggaaatcaaacag324
1165
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1165
gacattcagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
aggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1166
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1166
gacatccagattatccagtctccatcctccctttctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1167
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1167
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagctgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1168
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1168
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagctgaaacca120
gggaaagccccaaagctcctgatcacttatggttcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtagaaaacaaacgg324
1169
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1169
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcttaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaacgtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1170
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1170
gacatccagatgacccaggctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagctgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcagagtggggtcccatca180
cgtttcagtggtagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggttgaaaacaaacgg324
1171
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1171
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggttctctgttatcttggtaccagcagaaacca120
gggaaagccccaaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcgctctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1172
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1172
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1173
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1173
gacatcctgatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1174
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1174
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctggtatcttggtaccagcagaaaccg120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgtacggccaa300
gggaccaaggtggaaatcaaacgg324
1175
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1175
gacatccagatgacccagtctccatcctctctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctggtatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgactttcggccaa300
gggaccaaggtggaaaacaaacgg324
1176
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1176
gacatcaagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcgagtcattttattggtactctggtatcttggtaccagcagaaacca120
gggaaagccccaaagctcctgatcacttatggttccatgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1177
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1177
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccaggcaagtcattttattggtactctggtatcctggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcccgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1178
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1178
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1179
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1179
gacatccagatgacccagtctccatcctccctgtctgcatctgttggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagctgaaacca120
gggaaagcccctaagctcctgatcacttatggttcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1180
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1180
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaaccg120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatttgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcaggaggtgctgtggcctgcgacgttcggccaa300
gggactaaggtggaaatcaaacgg324
1181
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1181
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtctcc60
atcacttgccgagcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatttgggacagatttcactctcaccatcagcagtctgcaacct240
gaagatcttgctacgtactactgtggtcaggaggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1182
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1182
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccaggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatttgggacagatttcactctcaccatcagcagtctgcaaccc240
gaagattttgctacgtactactgtggtcaggaggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1183
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1183
gacatccagatgacccagtctccatcctccctgtctgcatcagtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacct120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatttgggacagaattcactctcaccatcggcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1184
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1184
gacatccagatgacccagtcaccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtactctgttatcttggtaccagcagaaacca120
gggaaagccactaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctccgacgttcggccaa300
gggaccaaggtggaaatcaaacgg324
1185
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1185
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcacttcattgccagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1186
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1186
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcatttcattgcccagctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1187
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1187
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcatttcattgcccagctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcagacgg324
1188
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1188
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattacattgcctccctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcagagtggggccccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1189
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1189
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttgggcctcctacttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1190
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1190
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttggacgtcctacttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1191
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1191
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttggtcgtcctacttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1192
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1192
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttgggggtcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1193
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1193
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttgggcgtcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1194
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1194
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttggagctcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1195
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1195
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattggattgcccagctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1196
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1196
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggttcgctcttacgctggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1197
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1197
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcatcggattgcccagctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1198
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1198
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattacattgcctccctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1199
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1199
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatccggttcggctccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1200
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1200
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttacaagtcctacttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1201
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1201
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttggggctcctacttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1202
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1202
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttatttgggggcccttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattctgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1203
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1203
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattggattgccaccctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1204
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1204
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttatttgggggcccttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1205
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1205
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagcctcttaaactggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttatggttccttgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1206
324
dna
人工序列
描述人工序列:合成的
多核苷酸
1206
ggcatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcattttattggtagtctgttatcttggtaccaggtgaaacca120
gggaaagcccctaagctcctgatcacttacgggtcctggttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtggtcagggggtgctgtggcctgcgacgttcggccaa300
gggacaacggtggaaatcaaacgg324
1207
5
prt
人工序列
描述人工序列:合成的
肽
1207
glyglyglyglyser
15
1208
15
prt
人工序列
描述人工序列:合成的
肽
1208
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
1209
25
prt
人工序列
描述人工序列:合成的
肽
1209
glyglyglyglyserglyglyglyglyserglyglyglyglysergly
151015
glyglyglyserglyglyglyglyser
2025
1210
227
prt
人工序列
描述人工序列:合成的
多肽
1210
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheglnglutrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrthrleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleutrpasnserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhisprothrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1211
227
prt
人工序列
描述人工序列:合成的
多肽
1211
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrpheglnglutrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrmetleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleualapheserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhishisthrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1212
227
prt
人工序列
描述人工序列:合成的
多肽
1212
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrthrleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleutrpasnserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhisprothrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1213
227
prt
人工序列
描述人工序列:合成的
多肽
1213
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrmetleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleualapheserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhishisthrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1214
230
prt
人工序列
描述人工序列:合成的
多肽
1214
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrthr
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leutrpasnserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrpheglnglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1215
230
prt
人工序列
描述人工序列:合成的
多肽
1215
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhishisthr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrpheglnglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1216
230
prt
人工序列
描述人工序列:合成的
多肽
1216
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrthr
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leutrpasnserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrphehisglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1217
230
prt
人工序列
描述人工序列:合成的
多肽
1217
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhishisthr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrphehisglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1218
230
prt
人工序列
描述人工序列:合成的
多肽
1218
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrpheglnglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1219
230
prt
人工序列
描述人工序列:合成的
多肽
1219
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspvalalathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrpheglnglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1220
230
prt
人工序列
描述人工序列:合成的
多肽
1220
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglyvalhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrpheglnglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1221
230
prt
人工序列
描述人工序列:合成的
多肽
1221
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrthr
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leutrpasnserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrpheglu
130135140
glugluglumetiletrpvalargglnalaproglylysglyleuglu
145150155160
trpvalseralaileserargasnglytyrserthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysglylysglupropheargtyrasptyrtrpglyglnglythr
210215220
leuvalthrvalserser
225230
1222
227
prt
人工序列
描述人工序列:合成的
多肽
1222
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrthrleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleutrpasnserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhisprothrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1223
230
prt
人工序列
描述人工序列:合成的
多肽
1223
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglntrpileglysergln
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
mettrpargserserleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnglyleuarghisprolys
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrpheglu
130135140
glugluglumetiletrpvalargglnalaproglylysglyleuglu
145150155160
trpvalseralaileserargasnglytyrserthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysglylysglupropheargtyrasptyrtrpglyglnglythr
210215220
leuvalthrvalserser
225230
1224
227
prt
人工序列
描述人工序列:合成的
多肽
1224
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serglntrpileglyserglnleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuilemettrpargserserleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnglyleuarghisprolysthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1225
227
prt
人工序列
描述人工序列:合成的
多肽
1225
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrthrleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleutrpasnserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserserleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhisprothrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1226
227
prt
人工序列
描述人工序列:合成的
多肽
1226
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
seralaileserargasnglytyrserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysglupropheargtyrasptyrtrpglyglnglythrleuval
100105110
thrvalserseralaserthraspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrmetleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleualapheserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserasnleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhisprothrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1227
230
prt
人工序列
描述人工序列:合成的
多肽
1227
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrthr
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leutrpasnserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleualaserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrpheglu
130135140
glugluglumetiletrpvalargglnalaproglylysglyleuglu
145150155160
trpvalseralaileserargasnglytyrserthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysglylysglupropheargtyrasptyrtrpglyglnglythr
210215220
leuvalthrvalserser
225230
1228
230
prt
人工序列
描述人工序列:合成的
多肽
1228
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleualaserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrpheglu
130135140
glugluglumetiletrpvalargglnalaproglylysglyleuglu
145150155160
trpvalseralaileserargasnglytyrserthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysglylysglupropheargtyrasptyrtrpglyglnglythr
210215220
leuvalthrvalserser
225230
1229
227
prt
人工序列
描述人工序列:合成的
多肽
1229
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaglu
100105110
valglnleuleugluserglyglyglyleuvalglnproglyglyser
115120125
leuargleusercysalaalaserglyphethrpheargasptyrglu
130135140
mettrptrpvalargglnalaproglylysglyleugluargvalser
145150155160
alaileasnproglnglythrargthrtyrtyralaaspservallys
165170175
glyargphethrileserargaspasnserlysasnthrleutyrleu
180185190
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
195200205
lysleuprophetyrphehisglutrpglyglnglythrleuvalthr
210215220
valserser
225
1230
231
prt
人工序列
描述人工序列:合成的
多肽
1230
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargalaserthrser
100105110
glyprosergluvalglnleuleugluserglyglyglyleuvalgln
115120125
proglyglyserleuargleusercysalaalaserglyphethrphe
130135140
argasptyrglumettrptrpvalargglnalaproglylysglyleu
145150155160
gluargvalseralaileasnproglnglythrargthrtyrtyrala
165170175
aspservallysglyargphethrileserargaspasnserlysasn
180185190
thrleutyrleuglnmetasnserleuargalagluaspthralaval
195200205
tyrtyrcysalalysleuprophetyrphehisglutrpglyglngly
210215220
thrleuvalthrvalserser
225230
1231
229
prt
人工序列
描述人工序列:合成的
多肽
1231
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargglyglyglygly
100105110
sergluvalglnleuleugluserglyglyglyleuvalglnprogly
115120125
glyserleuargleusercysalaalaserglyphethrpheargasp
130135140
tyrglumettrptrpvalargglnalaproglylysglyleugluarg
145150155160
valseralaileasnproglnglythrargthrtyrtyralaaspser
165170175
vallysglyargphethrileserargaspasnserlysasnthrleu
180185190
tyrleuglnmetasnserleuargalagluaspthralavaltyrtyr
195200205
cysalalysleuprophetyrphehisglutrpglyglnglythrleu
210215220
valthrvalserser
225
1232
239
prt
人工序列
描述人工序列:合成的
多肽
1232
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargglyglyglygly
100105110
serglyglyglyglyserglyglyglyglysergluvalglnleuleu
115120125
gluserglyglyglyleuvalglnproglyglyserleuargleuser
130135140
cysalaalaserglyphethrpheargasptyrglumettrptrpval
145150155160
argglnalaproglylysglyleugluargvalseralaileasnpro
165170175
glnglythrargthrtyrtyralaaspservallysglyargphethr
180185190
ileserargaspasnserlysasnthrleutyrleuglnmetasnser
195200205
leuargalagluaspthralavaltyrtyrcysalalysleuprophe
210215220
tyrphehisglutrpglyglnglythrleuvalthrvalserser
225230235
1233
249
prt
人工序列
描述人工序列:合成的
多肽
1233
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargglyglyglygly
100105110
serglyglyglyglyserglyglyglyglyserglyglyglyglyser
115120125
glyglyglyglysergluvalglnleuleugluserglyglyglyleu
130135140
valglnproglyglyserleuargleusercysalaalaserglyphe
145150155160
thrpheargasptyrglumettrptrpvalargglnalaproglylys
165170175
glyleugluargvalseralaileasnproglnglythrargthrtyr
180185190
tyralaaspservallysglyargphethrileserargaspasnser
195200205
lysasnthrleutyrleuglnmetasnserleuargalagluaspthr
210215220
alavaltyrtyrcysalalysleuprophetyrphehisglutrpgly
225230235240
glnglythrleuvalthrvalserser
245
1234
227
prt
人工序列
描述人工序列:合成的
多肽
1234
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserserthrvalalaaspileglnmetthrglnserproser
115120125
serleuseralaservalglyaspargvalthrilethrcysargala
130135140
serargproileglythrmetleusertrptyrglnglnlysprogly
145150155160
lysalaprolysleuleuileleualapheserargleuglnsergly
165170175
valproserargpheserglyserglyserglythraspphethrleu
180185190
thrileserasnleuglnprogluaspphealathrtyrtyrcysala
195200205
glnalaglythrhisprothrthrpheglyglnglythrlysvalglu
210215220
ilelysarg
225
1235
231
prt
人工序列
描述人工序列:合成的
多肽
1235
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserseralaserthrserglyproseraspileglnmetthr
115120125
glnserproserserleuseralaservalglyaspargvalthrile
130135140
thrcysargalaserargproileglythrmetleusertrptyrgln
145150155160
glnlysproglylysalaprolysleuleuileleualapheserarg
165170175
leuglnserglyvalproserargpheserglyserglyserglythr
180185190
aspphethrleuthrileserasnleuglnprogluaspphealathr
195200205
tyrtyrcysalaglnalaglythrhisprothrthrpheglyglngly
210215220
thrlysvalgluilelysarg
225230
1236
229
prt
人工序列
描述人工序列:合成的
多肽
1236
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserserglyglyglyglyseraspileglnmetthrglnser
115120125
proserserleuseralaservalglyaspargvalthrilethrcys
130135140
argalaserargproileglythrmetleusertrptyrglnglnlys
145150155160
proglylysalaprolysleuleuileleualapheserargleugln
165170175
serglyvalproserargpheserglyserglyserglythraspphe
180185190
thrleuthrileserasnleuglnprogluaspphealathrtyrtyr
195200205
cysalaglnalaglythrhisprothrthrpheglyglnglythrlys
210215220
valgluilelysarg
225
1237
239
prt
人工序列
描述人工序列:合成的
多肽
1237
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserserglyglyglyglyserglyglyglyglyserglygly
115120125
glyglyseraspileglnmetthrglnserproserserleuserala
130135140
servalglyaspargvalthrilethrcysargalaserargproile
145150155160
glythrmetleusertrptyrglnglnlysproglylysalaprolys
165170175
leuleuileleualapheserargleuglnserglyvalproserarg
180185190
pheserglyserglyserglythraspphethrleuthrileserasn
195200205
leuglnprogluaspphealathrtyrtyrcysalaglnalaglythr
210215220
hisprothrthrpheglyglnglythrlysvalgluilelysarg
225230235
1238
249
prt
人工序列
描述人工序列:合成的
多肽
1238
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleuprophetyrphehisglutrpglyglnglythrleuval
100105110
thrvalserserglyglyglyglyserglyglyglyglyserglygly
115120125
glyglyserglyglyglyglyserglyglyglyglyseraspilegln
130135140
metthrglnserproserserleuseralaservalglyaspargval
145150155160
thrilethrcysargalaserargproileglythrmetleusertrp
165170175
tyrglnglnlysproglylysalaprolysleuleuileleualaphe
180185190
serargleuglnserglyvalproserargpheserglyserglyser
195200205
glythraspphethrleuthrileserasnleuglnprogluaspphe
210215220
alathrtyrtyrcysalaglnalaglythrhisprothrthrphegly
225230235240
glnglythrlysvalgluilelysarg
245
1239
230
prt
人工序列
描述人工序列:合成的
多肽
1239
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserargproileglythrmet
202530
leusertrptyrglnglnlysproglylysalaprolysleuleuile
354045
leualapheserargleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserasnleuglnpro
65707580
gluaspphealathrtyrtyrcysalaglnalaglythrhisprothr
859095
thrpheglyglnglythrlysvalgluilelysargthrvalalaala
100105110
prosergluvalglnleuleugluserglyglyglyleuvalglnpro
115120125
glyglyserleuargleusercysalaalaserglyphethrphearg
130135140
asptyrglumettrptrpvalargglnalaproglylysglyleuglu
145150155160
argvalseralaileasnproglnglythrargthrtyrtyralaasp
165170175
servallysglyargphethrileserargaspasnserlysasnthr
180185190
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
195200205
tyrcysalalysleuprophetyrphehisglutrpglyglnglythr
210215220
leuvalthrvalserser
225230
1240
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1240
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcaggagtggggtcagggaaccctggtcaccgtctcgagcgctagcaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1241
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1241
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcaggagtggggtcagggaaccctggtcaccgtctcgagcgctagcaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgcgcaggctgggacgcatcatacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1242
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1242
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagcgctagcaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1243
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1243
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagcgctagcaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgcgcaggctgggacgcatcatacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1244
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1244
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcaggagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1245
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1245
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctgggacgcatcatacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcaggagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1246
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1246
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcacgagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1247
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1247
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctgggacgcatcatacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcacgagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1248
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1248
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tccgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcaggagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1249
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1249
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagatgttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcaggagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1250
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1250
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctggggtgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcaggagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1251
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1251
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgcgcagcctccgga420
ttcacctttgaggaggaggagatgatttgggtccgccaggctccagggaagggtctagag480
tgggtctcagctattagtaggaacggttacagcacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggataccgcggtatattactgtgggaaagagccgtttcgttatgactactgg660
ggtcagggaaccctggtcaccgtctccagc690
1252
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1252
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagcgctagcaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1253
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1253
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcagtggattgggtctcagttatcttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcatgtggcgttcctcgttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgctcagggtttgaggcatcctaagacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggctgcaccatctgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgcgcagcctccgga420
ttcacctttgaggaggaggagatgatttgggtccgccaggctccagggaagggtctagag480
tgggtctcagctattagtaggaacggttacagcacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggataccgcggtatattactgtgggaaagagccgtttcgttatgactactgg660
ggtcagggaaccctggtcaccgtctccagc690
1254
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1254
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagcgctagcaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcagtggattgggtctcagttatcttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatcatgtggcgttcctcgttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgctcagggtttgaggcatcctaagacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1255
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1255
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggct120
ccagggaagggtctagagtgggtctcagctattagtaggaacggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagcgcttcaaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaa600
gattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1256
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1256
gaggtgcagctgttggcgtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgcgcagcctccggattcacctttgaggaggaggagatgatttgggtccgccaggcc120
ccagggaagggtctagagtgggtctcagctattagtaggaacggttacagcacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggataccgcggtatattactgtgggaaagagccg300
tttcgttatgactactggggtcagggaaccctggtcaccgtctcgagcgcttcaaccgac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacctgaa600
gattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1257
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1257
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgacgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatcctttggaattcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacct240
gaagattttgctacgtactactgtgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacggaccgtggcggcgccgagtgaggtgcagctgttggcg360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgcgcagcctccgga420
ttcacctttgaggaggaggagatgatttgggtccgccaggctccagggaagggtctagag480
tgggtctcagctattagtaggaacggttacagcacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggataccgcggtatattactgtgggaaagagccgtttcgttatgactactgg660
ggtcagggaaccctggtcaccgtctccagc690
1258
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1258
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacggaccgtggcggcgccgagtgaggtgcaactgttggcg360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgcgcagcctccgga420
ttcacctttgaggaggaggagatgatttgggtccgccaggctccagggaagggtctagag480
tgggtctcagctattagtaggaacggttacagcacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggataccgcggtatattactgtgggaaagagccgtttcgttatgactactgg660
ggtcagggaaccctggtcaccgtctccagc690
1259
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1259
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgtacggtggcggaggtgcagctgttggagtctggggga360
ggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggattcaccttt420
cgggattatgagatgtggtgggtccgccaggctccagggaagggtctagagcgggtctca480
gctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggccggttcacc540
atctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgtgccgag600
gacaccgcggtatattactgtgcgaaacttccgttttactttcacgagtggggtcaggga660
accctggtcaccgtctccagc681
1260
693
dna
人工序列
描述人工序列:合成的
多核苷酸
1260
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacgggctagcacctcaggtccatcggaggtgcagctgttg360
gagtctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctcc420
ggattcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtcta480
gagcgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaag540
ggccggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagc600
ctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcacgag660
tggggtcagggaaccctggtcaccgtctccagc693
1261
687
dna
人工序列
描述人工序列:合成的
多核苷酸
1261
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacggggtggaggtggctctgaggtgcagctgttggagtct360
gggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggattc420
acctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagagcgg480
gtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggccgg540
ttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgt600
gccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcacgagtggggt660
cagggaaccctggtcaccgtctccagc687
1262
717
dna
人工序列
描述人工序列:合成的
多核苷酸
1262
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacggggtggaggtggctctggaggtggcggtagcggcgga360
ggcggttcagaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtcc420
ctgcgtctctcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtc480
cgccaggctccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgt540
acatactacgcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaac600
acgctgtatctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcg660
aaacttccgttttactttcacgagtggggtcagggaaccctggtcaccgtctccagc717
1263
747
dna
人工序列
描述人工序列:合成的
多核苷酸
1263
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacggggtggaggtggctctggaggtggcggtagcggcggt360
ggcggttcaggtggcggaggttctggaggcggtggatctgaggtgcagctgttggagtct420
gggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccggattc480
acctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagagcgg540
gtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggccgg600
ttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctgcgt660
gccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcacgagtggggt720
cagggaaccctggtcaccgtctccagc747
1264
681
dna
人工序列
描述人工序列:合成的
多核苷酸
1264
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtttcgagcacggtggcggac360
atccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcaccatc420
acttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaaccaggg480
aaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatcacgt540
ttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacctgaa600
gattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaaggg660
accaaggtggaaatcaaacgg681
1265
693
dna
人工序列
描述人工序列:合成的
多核苷酸
1265
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagcgctagcacctca360
ggtccatcggacatccagatgacccagtctccatcctccctgtctgcatctgtaggagac420
cgtgtcaccatcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccag480
cagaaaccagggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggg540
gtcccatcacgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaat600
ctgcaacctgaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacg660
ttcggccaagggaccaaggtggaaatcaaacgg693
1266
687
dna
人工序列
描述人工序列:合成的
多核苷酸
1266
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagcggtggaggcggc360
tctgacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtc420
accatcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaa480
ccagggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtccca540
tcacgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaa600
cctgaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggc660
caagggaccaaggtggaaatcaaacgg687
1267
717
dna
人工序列
描述人工序列:合成的
多核苷酸
1267
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagcggtggaggtggc360
tctggaggtggcggtagcggcggtggcggttcagacatccagatgacccagtctccatcc420
tccctgtctgcatctgtaggagaccgtgtcaccatcacttgccgggcaagtcgtccgatt480
gggacgatgttaagttggtaccagcagaaaccagggaaagcccctaagctcctgatcctt540
gctttttcccgtttgcaaagtggggtcccatcacgtttcagtggcagtggatctgggaca600
gatttcactctcaccatcagcaatctgcaacctgaagattttgctacgtactactgcgcg660
caggctgggacgcatcctacgacgttcggccaagggaccaaggtggaaatcaaacgg717
1268
747
dna
人工序列
描述人工序列:合成的
多核苷酸
1268
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgcgtctc60
tcctgtgcagcctccggattcacctttcgggattatgagatgtggtgggtccgccaggct120
ccagggaagggtctagagcgggtctcagctattaatccgcagggtacgcgtacatactac180
gcagactccgtgaagggccggttcaccatctcccgcgacaattccaagaacacgctgtat240
ctgcaaatgaacagcctgcgtgccgaggacaccgcggtatattactgtgcgaaacttccg300
ttttactttcacgagtggggtcagggaaccctggtcaccgtctcgagcggtggaggtggc360
tctggaggtggcggtagcggcggtggcggttcaggtggcggaggttctggaggcggtgga420
tctgacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtc480
accatcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaa540
ccagggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtccca600
tcacgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaa660
cctgaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggc720
caagggaccaaggtggaaatcaaacgg747
1269
690
dna
人工序列
描述人工序列:合成的
多核苷酸
1269
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagaccgtgtcacc60
atcacttgccgggcaagtcgtccgattgggacgatgttaagttggtaccagcagaaacca120
gggaaagcccctaagctcctgatccttgctttttcccgtttgcaaagtggggtcccatca180
cgtttcagtggcagtggatctgggacagatttcactctcaccatcagcaatctgcaacct240
gaagattttgctacgtactactgcgcgcaggctgggacgcatcctacgacgttcggccaa300
gggaccaaggtggaaatcaaacggaccgtagcggcgccgagtgaggtgcagctgttggag360
tctgggggaggcttggtacagcctggggggtccctgcgtctctcctgtgcagcctccgga420
ttcacctttcgggattatgagatgtggtgggtccgccaggctccagggaagggtctagag480
cgggtctcagctattaatccgcagggtacgcgtacatactacgcagactccgtgaagggc540
cggttcaccatctcccgcgacaattccaagaacacgctgtatctgcaaatgaacagcctg600
cgtgccgaggacaccgcggtatattactgtgcgaaacttccgttttactttcacgagtgg660
ggtcagggaaccctggtcaccgtctccagc690
1270
44
prt
人工序列
描述人工序列:合成的
多肽
1270
cysserproglypheglyvallysglnilealathrglyvalserasp
151015
thrilecysgluprocysprovalglyphepheserasnvalserser
202530
alapheglulyscyshisprotrpthrsercysglu
3540
1271
44
prt
人工序列
描述人工序列:合成的
多肽
1271
cysserproglytyrargvallysglualacysglygluleuthrgly
151015
thrvalcysgluprocysproproglythrtyrilealahisleuasn
202530
glyleuserlyscysleuglncysglnmetcysasp
3540
1272
44
prt
人工序列
描述人工序列:合成的
多肽
1272
cysglnproglyglnlysleuvalseraspcysthrgluphethrglu
151015
thrglucysleuprocysglygluserglupheleuaspthrtrpasn
202530
arggluthrhiscyshisglnhislystyrcysasp
3540
1273
19
prt
人工序列
描述人工序列:合成的
肽
1273
aspproglyglyglyglyglyargleuvalproargglypheglythr
151015
glyasppro
1274
5
prt
人工序列
描述人工序列:合成的
肽
mod_res
(1)..(1)
asporgly
mod_res
(4)..(4)
metorleu
1274
xaatyrgluxaatrp
15
1275
17
prt
人工序列
描述人工序列:合成的
肽
mod_res
(5)..(5)
gln,tyr,pro,trporala
mod_res
(7)..(7)
thr,ser,asn,gly,metorgln
mod_res
(8)..(8)
arg,leu,tyr,hisorphe
mod_res
(16)..(16)
lysormet
1275
alaileasnproxaaglyxaaxaathrtyrtyralaaspservalxaa
151015
gly
1276
7
prt
人工序列
描述人工序列:合成的
肽
mod_res
(1)..(1)
leuorpro
mod_res
(3)..(3)
phe,gln,thrormet
mod_res
(4)..(4)
tyr,pro,leu,thr,ile,pheormet
mod_res
(6)..(6)
gln,his,asp,ser,lys,gluorgly
mod_res
(7)..(7)
glu,asportyr
1276
xaaproxaaxaaphexaaxaa
15
1277
30
prt
人工序列
描述人工序列:合成的
多肽
mod_res
(18)..(18)
leuorarg
mod_res
(30)..(30)
argorala
1277
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serxaaargleusercysalaalaserglyphethrphexaa
202530
1278
14
prt
人工序列
描述人工序列:合成的
肽
mod_res
(4)..(4)
glnorarg
mod_res
(8)..(8)
lysorarg
mod_res
(9)..(9)
glyorval
1278
trpvalargxaaalaproglyxaaxaaleugluargvalser
1510
1279
32
prt
人工序列
描述人工序列:合成的
多肽
mod_res
(12)..(12)
thrormet
mod_res
(23)..(23)
gluorasp
mod_res
(26)..(26)
alaorser
mod_res
(29)..(29)
tyrorhis
mod_res
(31)..(31)
alaorthr
1279
argphethrileserargaspasnserlysasnxaalystyrleugln
151015
metasnserleuargalaxaaaspthrxaavaltyrxaacysxaalys
202530
1280
11
prt
人工序列
描述人工序列:合成的
肽
mod_res
(1)..(1)
trporarg
mod_res
(3)..(3)
glnorpro
mod_res
(11)..(11)
serorasn
1280
xaaglyxaaglythrleuvalthrvalserxaa
1510
1281
116
prt
人工序列
描述人工序列:合成的
多肽
mod_res
(13)..(13)
glnorarg
mod_res
(99)..(99)
gluorgly
mod_res
(101)..(101)
ala,leuorglu
mod_res
(102)..(102)
pheortyr
mod_res
(106)..(106)
trporarg
1281
gluvalglnleuleugluserglyglyglyleuvalxaaproglygly
151015
serleuargleusercysalaalaserglyphethrpheglutrptyr
202530
glumetglntrpvalargargalaproglylysglyleuglutrpval
354045
seralaileserglyaspglytyrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysxaaleuxaaxaapheasptyrxaaglyargglythrleuval
100105110
thrvalserser
115
1282
116
prt
人工序列
描述人工序列:合成的
多肽
mod_res
(28)..(28)
throrpro
mod_res
(50)..(50)
alaorser
mod_res
(53)..(53)
argorgly
mod_res
(54)..(54)
arg,ser,asn,gln,gly,hisorleu
mod_res
(56)..(56)
tyr,phe,trporgly
mod_res
(57)..(57)
serorgly
mod_res
(102)..(102)
arg,metorpro
1282
gluvalglnleuleualaserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphexaapheglugluglu
202530
glumetiletrpvalargglnalaproglylysglyleuglutrpval
354045
serxaaileserxaaxaaglyxaaxaathrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
glylysgluprophexaatyrasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
1283
118
prt
人工序列
描述人工序列:合成的
多肽
mod_res
(36)..(36)
metorleu
mod_res
(39)..(39)
valorphe
mod_res
(76)..(76)
asporasn
mod_res
(77)..(77)
serorthr
mod_res
(97)..(97)
tyrorhis
mod_res
(100)..(100)
lysorarg
mod_res
(101)..(101)
asporglu
mod_res
(105)..(105)
tyrorphe
mod_res
(108)..(108)
trporarg
mod_res
(109)..(109)
glyorarg
mod_res
(110)..(110)
glnorhis
1283
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphealaglythr
202530
argtyrgluxaatrptrpxaaargglnalaproglylysglyleuglu
354045
argvalseralaileserglyserglyglyserthrtyrtyralaasp
505560
servallysglyargphethrileserargaspxaaxaalysasnthr
65707580
leutyrleuglnmetasnserleuargalagluaspthralavaltyr
859095
xaacysalaxaaxaaprotyrserxaaasptyrxaaxaaxaaglythr
100105110
leuvalthrvalserser
115
1284
232
prt
人工序列
描述人工序列:合成的
多肽
1284
gluprolysserserasplysthrhisthrserproproserproala
151015
progluleuleuglyglyserservalpheleupheproprolyspro
202530
lysaspthrleumetileserargthrprogluvalthrcysvalval
354045
valaspvalserhisgluaspprogluvallyspheasntrptyrval
505560
aspglyvalgluvalhisasnalalysthrlysproarggluglugln
65707580
tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln
859095
asptrpleuasnglylysglutyrlyscyslysvalserasnlysala
100105110
leuproalaproileglulysthrileserlysalalysglyglnpro
115120125
arggluproglnvaltyrthrleuproproserargaspgluleuthr
130135140
lysasnglnvalserleuthrcysleuvallysglyphetyrproser
145150155160
aspilealavalglutrpgluserasnglyglnprogluasnasntyr
165170175
lysthrthrproprovalleuaspseraspglyserphepheleutyr
180185190
serlysleuthrvalasplysserargtrpglnglnglyasnvalphe
195200205
sercysservalmethisglualaleuhisasnhistyrthrglnlys
210215220
serleuserleuserproglylys
225230
1285
229
prt
人工序列
描述人工序列:合成的
多肽
1285
gluserlystyrglyproprocysproprocysproalaprogluphe
151015
leuglyglyproservalpheleupheproprolysprolysaspthr
202530
leumetileserargthrprogluvalthrcysvalvalvalaspval
354045
serglngluaspprogluvalglnpheasntrptyrvalaspglyval
505560
gluvalhisasnalalysthrlysproargglugluglnpheasnser
65707580
thrtyrargvalvalservalleuthrvalleuhisglnasptrpleu
859095
asnglylysglutyrlyscyslysvalserasnlysglyleuproser
100105110
serileglulysthrileserlysalalysglyglnproargglupro
115120125
glnvaltyrthrleuproproserglngluglumetthrlysasngln
130135140
valserleuthrcysleuvallysglyphetyrproseraspileala
145150155160
valglutrpgluserasnglyglnprogluasnasntyrlysthrthr
165170175
proprovalleuaspseraspglyserphepheleutyrserargleu
180185190
thrvalasplysserargtrpglngluglyasnvalphesercysser
195200205
valmethisglualaleuhisasnhistyrthrglnlysserleuser
210215220
leuserleuglylys
225
1286
351
prt
人工序列
描述人工序列:合成的
多肽
1286
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleupropheargpheseraspargglyglnglythrleuval
100105110
thrvalserseralaserthrgluprolysserserasplysthrhis
115120125
thrserproproserproalaprogluleuleuglyglyserserval
130135140
pheleupheproprolysprolysaspthrleumetileserargthr
145150155160
progluvalthrcysvalvalvalaspvalserhisgluaspproglu
165170175
vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys
180185190
thrlysproargglugluglntyrasnserthrtyrargvalvalser
195200205
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
210215220
cyslysvalserasnlysalaleuproalaproileglulysthrile
225230235240
serlysalalysglyglnproarggluproglnvaltyrthrleupro
245250255
proserargaspgluleuthrlysasnglnvalserleuthrcysleu
260265270
vallysglyphetyrproseraspilealavalglutrpgluserasn
275280285
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
290295300
aspglyserphepheleutyrserlysleuthrvalasplysserarg
305310315320
trpglnglnglyasnvalphesercysservalmethisglualaleu
325330335
hisasnhistyrthrglnlysserleuserleuserproglylys
340345350
1287
348
prt
人工序列
描述人工序列:合成的
多肽
1287
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheargasptyr
202530
glumettrptrpvalargglnalaproglylysglyleugluargval
354045
seralaileasnproglnglythrargthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysleupropheargpheseraspargglyglnglythrleuval
100105110
thrvalserseralaserthrgluserlystyrglyproprocyspro
115120125
procysproalaproglupheleuglyglyproservalpheleuphe
130135140
proprolysprolysaspthrleumetileserargthrprogluval
145150155160
thrcysvalvalvalaspvalserglngluaspprogluvalglnphe
165170175
asntrptyrvalaspglyvalgluvalhisasnalalysthrlyspro
180185190
argglugluglnpheasnserthrtyrargvalvalservalleuthr
195200205
valleuhisglnasptrpleuasnglylysglutyrlyscyslysval
210215220
serasnlysglyleuproserserileglulysthrileserlysala
225230235240
lysglyglnproarggluproglnvaltyrthrleuproprosergln
245250255
gluglumetthrlysasnglnvalserleuthrcysleuvallysgly
260265270
phetyrproseraspilealavalglutrpgluserasnglyglnpro
275280285
gluasnasntyrlysthrthrproprovalleuaspseraspglyser
290295300
phepheleutyrserargleuthrvalasplysserargtrpglnglu
305310315320
glyasnvalphesercysservalmethisglualaleuhisasnhis
325330335
tyrthrglnlysserleuserleuserleuglylys
340345
